NAGETIER-ÜBERTRAGENE ZOONOSEN ENTLANG EINES EINES KLIMAGRADIENTEN IM NATIONALPARK BAYERISCHER WALD
Rodent-associated Zoonotic Agents along a Climate Gradient in the National Park Bavarian Forest
Aus dem Institut für Mikrobiologie der Bundeswehr, München ¹(Leiter: Oberstarzt Prof. Dr. L. Zöller), der Vetsuisse Fakultät, Bern, Schweiz² (Dekan: Prof. Dr. F. Althaus) und dem Nationalpark Bayerischer Wald, Grafenau ³(Leiter: Dr. F. Leibl)
Sandra Essbauer¹, Stephanie Speck¹, Bryan Thoma¹, Anja Osterberg¹, Pauline Bleichert¹, Susanne Schex², Gerhard Dobler¹, Claus Bässler³ und Jörg Müller³
Die Feldepidemiologie von Kleinsäuger-assoziierten Erregern wird seit acht Jahren am Institut für Mikrobiologie der Bundeswehr untersucht. Darauf aufbauend wurde eine zivil-militärische Kooperation im Netzwerk „Vektor-übertragene Infektionskrankheiten unter Einfluss des Klimawandels“ in Zusammenarbeit mit dem Nationalpark Bayerischer Wald initiiert. Exemplarisch wurden Hantaviren (Puumalavirus, PUUV) als Modell für hämorrhagische Fieberviren und Rikkettsien als Modell für Zecken-übertragene Fiebererreger untersucht.
Neben epidemiologischen Erkenntnissen, sollte das Projekt dazu dienen, Faktoren zu definieren, die das erregerspezifische Infektionsrisiko auch für Soldaten beeinflussen können.
Methoden:
Es wurden von 2008 bis 2010 an 23 Beprobungsstellen in Niederbayern entlang eines Höhen-Klima-Gradienten von 300 bis 1 450 m 674 Kleinsäuger gesammelt. Diese wurden molekularbiologisch und serologisch untersucht und die Daten statistisch ausgewertet.
Ergebnisse:
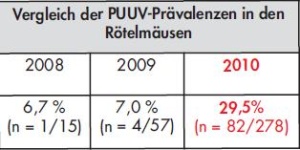
Im Jahr 2010 konnten zehnmal mehr Tiere als in den beiden Vorjahren gefangen werde n, was sich in der vierfachen PUUV-Präva lenz widerspiegelt. PUUV wurde bis zu einer Höhe von 1 420 m an 17 Beprobungsorten nachgewiesen. Umfangreiche statistische Ana lysen von 33 ökologischen, tierbezogenen, lokalen Wetter- und Klima-Parametern er gaben, dass sechs Fakto ren einen signifikanten Einfluss auf das Vorkommen von PUUV haben. Es wurden über 100 PUUV-Sequen zen neu generiert und der Stamm Bavaria bestätigt. Bei den Rickettsien wurden erstmalig drei humanpathogene Arten, Rickettsia (R.) helvetica, eine asiatische Spezies und R. felis mit einer Prävalenz von 6 % nachgewiesen. Zwei tierbezogene Faktoren, die das Vorkommen der Rickettsien beeinflussen können, waren statistisch signifikant.
Schlussfolgerungen:
Die erhobenen Daten für beide Erreger sind in Deutschland – sowohl militärisch als auch zivil – einmalig und fließen national wie international in verschiedene Projekte, zum Beispiel bei der NATO, ein.
Summary
Background:
Since eight years field epidemiology of agents associated with small mammals performed at the Bundeswehr Institute of Microbiolog y. Consequently a civil-military cooperation was initiated in a ne twork “Vector- borne Infectious Diseases in Climate Change Investigations” in cooperation with the National Park Bavarian Forest. Exemplarily studies focused on hantaviruses (Puumalavirus, PUUV) as model for hemorrhagic fever viruses and for Rickettsia as model for tick-transmitted agents. Aim of the project was to define the impact on the risk of human diseases caused by these pathogens.
Methods:
In Lower Bavaria from 2008 to 2010 at 23 sampling sites ranging over an altitude- climate-gradient from 300 m to 1 450 m, 674 small mammals were collected. The samples were investigated serologically and molecular-biologically and assessed statistically.
Results:
In 2010 numbers of trapped animals were tenfold in comparison to the previous two years, and the PUUV-prevalence was fourfold. PUUV was detected at altitudes up to 1 420 m at 17 sampling sites. Comprehensive statistical analyses were performed using 33 ecological, animal, local weather and climate parameters. Six factors had a significant influence on the occurrence of PUUV. Over 100 PUUV-sequences were generated and the strain Bavaria was confirmed. For the first time three human pathogenic species, Rickettsia (R.) helvetica, one asiatic Rickettsia species and R. felis with a prevalence of 6% was found. Two animal-related factors had a significant influence on the detection of Rickettsia.
Conclusions:
The acquired data for both infectious agents are unique in Germany and contribute to national and international projects e. g. of NATO.
1. Einführung
1.1 Hintergrund
Hantaviren und Rickettsien werden als potenzielle B-Agenzien der Kategorie B beziehungsweise C von den Centers of Disease Control and Prevention der USA gelistet [1]. Am Institut für Mikrobiologie der Bundeswehr (InstMikroBioBw) stehen ungewöhnliche Ausbruchsgeschehen im Untersuchungsfokus, um natürlich vorkommende hochpathogene Erreger von möglicherweise ausgebrachten B-Agenzien unterscheiden zu können. So werden beispielsweise Hantaviren als Modell für hämorrhagische Fieberviren und Rickettsien als Modell für Zecken-übertragene Fiebererreger in Kleinsäugern seit einigen Jahren regelmäßig untersucht.
Ziel der feldepidemiologischen Untersuchungen ist es langfristig, ökologische und andere Faktoren zu finden, die für eine Risikoanalyse für beide Krankheitserreger benutzt werden können, um so ein aktives Surveillance zu betreiben. Seit den Jahren 2004 und 2005 finden regelmäßige Herduntersuchungen zur Surveillance auf Hantaviren statt [2-4]. Diese wurden beispielsweise auf Truppenübungsplätzen (Freyung, Regen, Bogen) und auch an zivilen Standorten in Niederbayern durchgeführt. 2005 führte die hohe Puumalavirus (PUUV)-Prävalenz in Rötelmäusen (30 - 35 %) im Raum Freyung zeitweise zur Sperrung eines StandortÜbungsplatzes. Im Rahmen dieser Untersuchungen entstand ein enger Austausch mit zivilen Behörden, wie beispielsweise dem Nationalpark Bayerischer Wald, da unter anderem Ranger und Waldarbeiter berufsbedingt ein höheres Risiko für Hantavirus-Infektionen haben können. Seit 2007 wird auch regelmäßig einmal jährlich eine Hantavirus-Herdanalyse am Truppenübungsplatz Heuberg (Stetten am Kalten Markt) in Baden-Württemberg durchgeführt [4]. Dabei gewonnene Ergebnisse werden sowohl Bundeswehrintern als auch mit zivilen öffentlichen Gesundheitseinrichtungen, zum Beispiel mit dem bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit (LGL), dem Robert Koch-Institut und dem bundesweiten Netzwerk für Nagetier- übertragene Zoonosen [5], kommuniziert.
Im Jahr 2008 kontaktierte das LGL die Abteilung Virologie & Rickettsiologie am InstMikroBioBw, um die vorhandene Expertise zu Zecken- und Nagetierübertragenen Erregern aus Ausbruchsund Naturherduntersuchungen in einem Netzwerk über „Vektorübertragene Infektionskrankheiten unter Einfluss des Klimawandels“ (VICCI, Vector-Borne Infectious Diseases in Climate Change Investigation) einzubringen. VICCI wurde dabei im Forschungsverbund „Gesundheitliche Folgen des Klimawandels in Bayern“ durch das Bayerische Staatsministerium für Gesundheit, Umwelt und Verbraucherschutz gefördert. Dem Projekt wurde seitens des BMVg unabhängig von fachlichen Aspekten auch im Hinblick auf die zivil-militärische Zusammenarbeit eine hohe Bedeutung beigemessen.
Im Folgenden werden Inhalte und einige Ergebnisse des Projektes vorgestellt, das am InstMikroBioBw im VICCI-Verbund von August 2008 bis Dezember 2011 bearbeitet wurde.
1.2 Der VICCI-Verbund
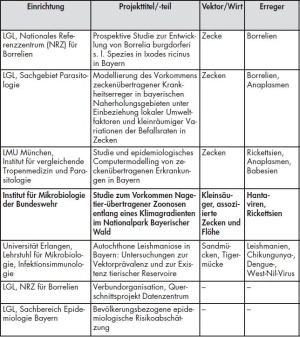
Dem VICCI-Netzwerk gehören neben dem InstMikroBioBw vier weitere zivile Einrichtungen an, darunter das LGL mit mehreren Fachabteilungen sowie Institute der Universitäten Bayreuth, Erlangen und München (siehe Tab 1). Weitere Details zu den anderen Projekten wurden kürzlich veröffentlicht [6].
1.3 Das VICCI-Teilprojekt zur Untersuchung von Hantaviren und Rickettsien in einem Klima-Höhengradienten im Nationalpark Bayerischer Wald
1.3.1 Hantaviren als Modell für hämorrhagische Fieberviren
Hantaviren bilden eine Gattung in der Familie Bunyaviridae mit wichtigen humanpathogenen Vertretern. In der Gattung mit mehr als 60 verschiedenen Viren spielen insbesondere Puumala-, Dobrava- und Hantaanvirus als Erreger von viralen hämorrhagischen Fiebern sowie Andes- und Sin Nombre-Virus als Erreger des Hantavirus Kardiopulmonalen Syndroms (HPS) eine wichtige Rolle. In Deutschland gibt es mindestens drei Virusspezies, die Infektionen beim Menschen hervorrufen können und die (zumeist) mit einer Wildmaus- Art als Wirtsspezies assoziiert sind: das Dobravavirus mit der Gelbhals- beziehungsweise Brandmaus, das Tulavirus mit der Erd- beziehungsweise Feldmaus und das Puumalavirus mit der Rötelmaus. Infektionen mit den verschiedenen Spezies unterscheiden sich in Schweregrad und Dauer. Hantavirus- Infektionen haben in den letzten Jahren in Deutschland stark zugenommen. In den Jahren 2005, 2007 und 2010 kam es hier zu einer deutlich erhöhten Anzahl von Erkrankungsfällen. Allein 2010 wurden mehr als 2 000 Erkrankungsfälle deutschlandweit gemeldet. Hantaviren verursachen unter anderem das Hämorrhagische Fieber mit Renalem Syndrom (HFRS) und sind auch in Einsatzgebieten der Bundeswehr, zum Beispiel im Kosovo, endemisch. Sie werden von persistent infizierten Wildmäusen ausgeschieden und durch Aerosole oder direkten Kontakt auf den Menschen übertragen. Soldaten besitzen aufgrund ihrer erhöhten Exposition ein besonderes Risiko für Hantavirus-Infektionen. Im Falle von Ausbrüchen von hämorrhagischem Fieber oder HPS in militärischen Populationen sind daher Hantaviren differenzialdiagnostisch gegenüber anderen Erregern viraler hämorrhagischer Fieber abzugrenzen.
1.3.2 Warum kommt es zu Hantavirus-Ausbrüchen?
Bisher werden die zyklisch wiederkehrenden Ausbruchsaktivitäten der Hantaviren nicht verstanden. Dieses Verständnis ist aber sowohl für den militärischen als auch den zivilen Bereich sehr wichtig, um zu erkennen, wann ein erhöhtes Risiko für Hantavirus-Ausbrüche besteht. Dies ist wiederum notwendig zum Abschätzen des Infektionsrisikos und Einleiten prophylaktischer Schutzmaßnahmen. Es wird ein Einfluss des Klimas und weiterer geoökologischer sowie anderer Faktoren auf die Populationen ansteckungsfähiger Wildnagetiere und auf die Erregerprävalenz in den Nagertieren vermutet. Ein besseres Verstehen dieser Zusammenhänge kann eine Vorhersage und damit eine Risikoanalyse für das Auftreten von Hantaviren ermöglichen. Weiterhin können diese Daten zum Verständnis anderer durch Nagetiere übertragener Virusinfektionen, zum Beispiel Arenavirus-bedingter hämorrhagischer Fieber durch Lassa- oder Junin-Virus, beitragen.
1.3.3 Rickettsien in Naturherden als Modell für einen Zecken-übertragenen „Fiebererreger“
Ein weiteres Ziel der durchgeführten Untersuchungen ist die Surveillance von Rickettsien. Rickettsien sind Erreger verschiedener Fleckfieber-Formen. Sie werden von Zecken oder von Flöhen und Läusen auf den Menschen übertragen. Rickettsien zählen zu den Krankheitserregern mit der höchsten Infektiosität. Rickettsiosen spielten militärhistorisch neben der Pest eine herausragende Rolle, zum Beispiel in den Napoleonischen Kriegen oder als Schützengrabenfieber im 1. und 2. Weltkrieg. Mit Rickettsien infizierte Läuse wurden von Japan als biologische Waffe ausgebracht [7]. Daneben gelten Rickettsiosen, nach der Malaria, als zweithäufigste Ursache fieberhafter Infektionen bei Reiserückkehrern aus Afrika [8]. Über das Vorkommen von Rickettsien in Deutschland und ihre humanpathogene sowie wehrmedizinische Bedeutung gibt es bisher nur wenige Daten. Frühere Untersuchungen am InstMikroBioBw zeigen, dass in Deutschland mindestens sechs verschiedene Rickettsienarten vorkommen. Für einige Arten der Zeckenbissfieber- Gruppe (Spotted Fever Group) wie R. helvetica, R. felis, R. monacensis oder R. slovaca sind humane Erkrankungsfälle in Deutschland belegt [8]. Über ihre Verbreitung und die Bedeutung von Nagetieren für die Aufrechterhaltung des natürlichen Übertragungszyklus existieren keinerlei Daten. Auch der Einfluss von klimatischen, geologischen, geografischen oder biologischen Parametern auf die Verbreitung und Intensität der Zirkulation von Rickettsien in endemischen Gebieten ist bisher unbekannt.
1.4 Ziel der Studie
Es gibt bislang nur unzureichende Erkenntnisse, welche Faktoren das Risiko von Nagetier-übertragenen humanen Erkrankungen beeinflussen. Im Rahmen des VICCI-Teilprojektes wurden das Vorkommen, die Prävalenzrate und die Epidemiologie von Hantaviren und Rikkettsien in Wildmäusen in Abhängigkeit von geoökologischen, klimatischen und Tier-assoziierten Parametern im Nationalpark Bayerischer Wald (NP) untersucht. Die am InstMikroBioBw gewonnenen Daten wurden mit abiotischen Faktoren (Klimadaten wie Temperatur, Sonneneinstrahlung, Geologie, Vegetation, Wasserversorgung, Nährstoffe im Boden) oder biotischen Faktoren (Erhebung von Gefäßpflanzen, Moose, Flechten und Holzpilzen, Tieren etc.) aus dem Biodiversität- und Klima-Projekt (BioKLIM-Studie) der Nationalparkverwaltung statistisch ausgewertet [6, 9]. Damit sollten Faktoren identifiziert werden, die mit dem Auftreten von Hantaviren und Rickettsien assoziiert sind und somit für eine Risikoanalyse und zur Überwachung bestehender beziehungsweise Identifizierung neuer Herde geeignet erscheinen.
2. Methoden
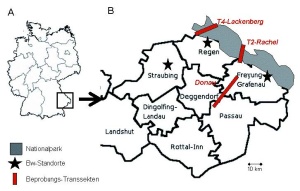
Für das Projekt wurden aus den im Rahmen des BioKLIM-Projekts bestehenden 394 Mess- / Beobachtungspunkten entlang linearer Höhengradienten („Transsekten“) von 300 m bis auf 1 450 m insgesamt 23 Probeorte im relativen Höhenabstand von 50 m ausgewählt. Die Probeorte befanden sich auf drei verschiedenen Transsekten (T), der T4 auf dem Lackenberg (Landkreis Regen), der T2 auf dem Rachel (Landkreis Freyung-Grafenau) und der sogenannten „Donau“-Transsekte (Landkreis Deggendorf und Freyung-Grafenau). Sie reichen von der Isarmündung (31 m über NN) bis über den Gipfel des Rachel (1 420 m über NN) hinaus (Abb 1A, 1B). Jede Beprobungsfläche lag um den Mittelpunkt der Transsekte. Nach Kartierung der Flächen wurden jeweils 16 Fallen aufgestellt (Abb 2a). Außerdem wurden an jeder Beprobungsstelle Datenlogger ausgebracht (Abb 2b), um stündlich Temperatur, Luftfeuchtigkeit und Taupunkt zu dokumentieren.
Kleinsäuger wurden mit Sherman-Lebendfallen tierschutzgerecht eingefangen und getötet. Am InstMikrobioBw erfolgte die Sektion, eine Entnahme von 12 Gewebeproben und pro Tier wurden 20 biometrische Parameter erfasst. Alle Tiere wurden mittels serologischer und molekularbiologischer Methoden auf Hantaviren und Rickettsien untersucht, und alle Daten in einer BioNumerics-Datenbank hinterlegt. Es wurden die Prävalenzrate bestimmt und die Epidemiologie von Hantaviren und Rickettsien in Wildmäusen in Abhängigkeit von 33 verschiedenen geoökologischen, klimatischen und anderen Parametern im Bayerischen Wald untersucht. Umfangreiche statistische Auswertungen erfolgten mittels logistischer und linearer Regressionsanalyse, unter anderem mit dem Programm ArcGIS.
3. Ergebnisse
3.1 Sammlung von Daten zu Nagetieren und lokalem Klima
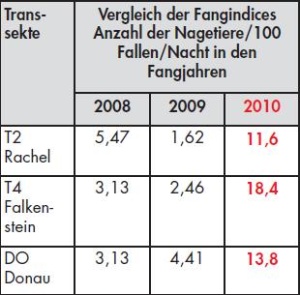
Von 2008 bis 2010 wurden in 82 Fangnächten auf den 23 Beprobungsflächen insgesamt 674 Kleinsäuger gesammelt. Die Fangindizes, berechnet als Nagetiere pro 100 Fallen pro Nacht, unterschieden sich in den Beprobungsjahren deutlich. Im Jahr 2010 kam es zu einem deutlich erhöhten Vorkommen von Nagetieren und zu einer Verzehnfachung des Fangindexes im Vergleich zu den beiden Vorjahren (Tab 2a). Zudem wurden über einen Verlauf von 30 Monaten an den 23 Standorten über 1 000 000 Wetterdaten wie Temperatur, Luftfeuchtigkeit und Taupunkt aufgezeichnet (Daten nicht gezeigt).
3.2 Hantavirus-Nachweis
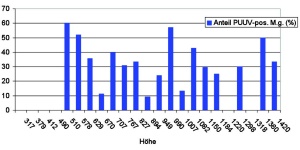
Hantaviren des Stammes Puumala (PUUV) Bayern konnten an 17 der 23 Untersuchungsorte im Höhengradienten bis zu einer Höhe von 1 420 m (Abb 3) in Rötelmäusen nachgewiesen werden. Das Virus war auch an Fangorten nachweisbar, von denen es bislang keine Daten zu humanen Hantavirus- Erkrankungen und Untersuchungen zum Vorkommen in Mäusen gab. Die Puumalavirus-Prävalenzen waren in den Tieren im Jahr 2010 im Vergleich zu den Vorjahren 2008/2009 um ein Vierfaches erhöht (Tab 2b).
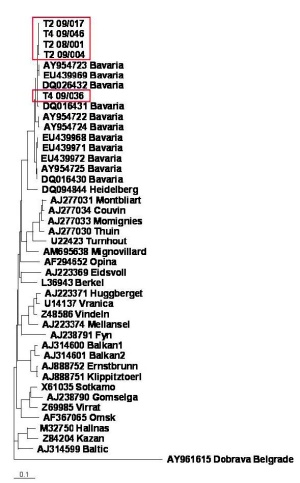
Es wurden mehrere Hotspots mit PUUVPrävalenzen über 40 % definiert (Abb 3). Die logistische Regressionsanalyse ergab, dass die PUUV-Prävalenz signifikant mit dem Alter der Reservoirtiere assoziiert war. Die maximale und mittlere Winterluftfeuchtigkeit und auch die mittlere Sonneneinstrahlung im Winter hatten einen negativen Einfluss auf das Vorkommen des Virus. Des Weiteren zeigten Generalized Linear Mixed Models (GLMM)- Analysen, dass sechs von 33 untersuchten ökologischen, klimatischen und tierbezogenen Variablen das Vorkommen von PUUV signifikant beeinflussten. Die PUUV-Prävalenz wurde durch das Vorkommen von Totholz, den Diversitätsindex der Tiere und die Deckung mit niedrigen Pflanzenschichten begünstigt. Von negativem Einfluss waren die mittlere Sonneneinstrahlung, das Vorkommen von Kryptogamen und die Krautschicht [10]. Insgesamt wurden über 50 S- und M-Segmente und zudem erstmals L-Segment- Sequenzen des PUUV generiert. Die molekularbiologischen Untersuchungen zeigten, dass der PUUVStamm Bavaria, der im Jahr 2004 und 2005 in Niederbayern erstmals von der Abteilung beschrieben wurde [2], auch in den beprobten Gebieten in Rötelmäusen vorherrscht (Abb 4).
3.3 Erstmaliger Nachweis von Wildmäusen als mögliche Reservoire für Rickettsien
Um Nagetiere molekularbiologisch auf Rickettsien zu untersuchen, wurden – in Anlehnung an frühere Arbeiten zu Borrelien (S. Eßbauer, unpubliziert) – die Ohren der Tiere für die DNA-Isolierung und anschließende PCR verwendet. Dieses Verfahren erwies sich in umfangreichen Analysen von Mäuseorganen als am besten geeignet zum Nachweis von Rickettsien. Es wird mittlerweile auch von der US-Navy und von den CDC für Rickettsien-Untersuchungen an Nagetieren verwendet. Unsere Arbeitsgruppe konnte mit diesem Verfahren weltweit zum ersten Mal den Nachweis von hu - manpathogenen Rickettsienarten in wild lebenden Mäusen erbringen und einen geografischen „Hotspot“ für Rickettsien definieren. Drei Rickettsienarten, R. felis, R. helvetica und auch eine asiatische Rickettsienart, wurden gefunden [11] (Abb 5). Letztere konnte bisher nur in China nachgewiesen und durch Sequenzierung von 6 Genloci bestätigt werden. Bemerkenswert war, dass R. felis sich in über 12 % der Apodemus flavicollis (Gelbhalsmäuse) und bei insgesamt 6 % der untersuchten Nagetiere nachweisen ließ. Es ist daher anzunehmen, dass Nagetiere zumindest für diese Rickettsienart einen wichtigen Reservoirwirt darstellen.
Mittels deskriptiver Statistik konnte gezeigt werden, dass Körpergewicht und -länge, Nieren-, Milz-, Gonaden- und Lebergewicht der Rickettsien-PCR-positiven und -negativen Wildmäuse sich voneinander unterschieden. Bei Rickettsien- PCR-positiven Tieren schien jeder dieser Parameter größer zu sein. Zudem wurden drei Hypothesen hinsichtlich des Nachweises von Rickettsien in Nagetieren generiert:
(1) Es scheint ein signifikanter Zusammenhang zwischen der Zahl der an den Wildmäusen gefundenen Ektoparasiten sowie (2) zwischen der Körpergröße der Tiere und dem Nachweis von Rickettsien zu bestehen. Nach den bisher vorliegenden Daten existiert (3) kein Zusammenhang zwischen der Höhe des Fangortes und dem Vorkommen der Rickettsien in Wildmäusen [11]. Eine weitere Auswertung klimatischer und weiterer Faktoren aus dem BioKLIM erfolgt derzeit.
4. Diskussion
Im vorliegenden Projekt wurde ein Hantavirus-Risikogebiet über drei Jahre regelmäßig beprobt. Die im Jahr 2010 erhöhten Kleinsäuger-Fangzahlen und parallel damit auftretenden höheren PUUV-Prävalenzen wurden in mehreren Regionen Deutschlands beobachtet [12]. Generell war das Jahr 2010 das bislang markanteste Ausbruchsjahr seit Einführung der Meldepflicht laut Infektionsschutzgesetz mit über 2 000 klinisch apparenten humanen Hantavirus- Infektionen in Deutschland. Damit konnte eine ausreichende Anzahl PUUV-positiver Nagetiere für eine erste Analyse und Identifizierung von biotischen und abiotischen Faktoren untersucht werden. Vergleichbare Studien zur Ermittlung von Faktoren, die die Oszillation von Hantavirus-Infektionen in Mitteleuropa (Belgien, Frankreich, Deutschland) beeinflussen, finden sich demnächst in einem Übersichtsartikel [10]. Inwieweit sogenannte Mäuse- Mastjahre die Zirkulation von Rickettsien intensivieren und damit das Infektionsrisiko für Menschen erhöhen, bleibt zu klären. R. felis galt bisher weltweit als Rickettsienart, die hauptsächlich in Katzenflöhen vorkommt und durch diese übertragen wird. Der erstmalige Nachweis in Wildnagetieren zeigt, dass neben dem bekannten („urbanen“) Entwicklungszyklus in Katzenflöhen möglicherweise ein weiterer („sylvatischer“) existiert. Ähnliche Beobachtungen wurden auch mit R. prowazekii gemacht, das in menschlichen Läusen, aber auch in Flughörnchen in Nordamerika vorkommt. Die bisher vorliegenden Nukleinsäuresequenzen des für das Oberflächenprotein ompB kodierenden Gens zeigen einige Unterschiede zu den bisher bekannten korrespondierenden Sequenzen von Isolaten aus Katzenflöhen (Abb 5). Damit stellt sich die Frage der Rolle von Wildmäusen als Wirte für die Aufrechterhaltung des Naturzyklus von R. felis.
Ebenso bleibt offen, mittels welcher Vektoren – Nagetierflöhe oder Zecken – R. felis übertragen wird. Diese Fragestellung zu klären, ist jedoch auch von besonderem Interesse, um das Infektionsrisikos für den Menschen zu beurteilen. Bei Nagerflöhen ist das Risiko als sehr gering einzustufen, da hier ein direkter Kontakt mit lebenden oder toten Nagetieren für das Überspringen der Flöhe notwendig ist. Bei einer Übertragung durch Zecken wäre das Infektionsrisiko für Menschen und damit auch für die Soldaten als erheblich höher einzustufen.
5. Schlussfolgerungen
Generell stellen die Untersuchungen nur einen kleinen Ausschnitt dar. Diese müssten aufgrund der Komplexität des Wechselspiels von Ökologie, Klima, Wirtsstier und Erreger bei Nagetierübertragenen Erregern über mindestens 10 Jahre verfolgt werden, um definitive Aussagen treffen zu können. Hantaviren sind grundsätzlich von enormer militärmedizinischer Bedeutung, weswegen das Projekt für die Prävention in Einsatzgebieten der Bundeswehr relevant ist und daher auch großen Anklang bei NATO-Partnern (Belgien, Frankreich, Ungarn, Niederlande, USA) gefunden hat. Die vorliegenden Ergebnisse werden als Grundlage für die Erstellung von Risikoanalysen für PUUV--Infektionen und möglicherweise auch andere durch Nagetiere übertragene Hämorrhagische Fieber wie Lassa-Virus, Dobravavirus, Junin-Virus oder Sin Nombre-Virus angesehen. Die Ergebnisse der bereits durchgeführten Analysen zum Auftreten von Hantaviren fließen in einen neuen NATO-Verbund mit ein. Neben den umfangreichen wissenschaftlichen Erkenntnissen konnte durch das Projekt ein reger Austausch mit den VICCI-Netzwerkpartnern sowie mit Partnern des Konsiliarlaboratoriums für Hantaviren, aus dem Robert Koch-Institut und dem Friedrich- Loeffler-Institut initiiert werden [12]. Die Ergebnisse fanden außerdem große Beachtung im UFOPLAN-Projekt (gefördert durch das Umweltbundesamt) sowie im Netzwerk Nagetier-übertragene Zoonosen (gefördert über die Nationale Zoonosenplattform). Auf Bundesebene fließen die im Teilprojekt erhobenen Daten in eine Risikoanalyse ein, um durch ein bundesweites Nagetier- Monitoring eine prospektive Abschätzung der Krankheitsrisiken beim Menschen geben zu können. Im Bereich der Rickettsien sind die durchgeführten Untersuchungen einmalig und geben erste Hinweise darauf, dass Nagetiere als Reservoire für diese humanpathogenen Erreger nicht unterschätzt werden dürfen.
Literatur
- http://www.bt.cdc.gov/agent/agentlistcategory. asp
- Essbauer S, Schmidt J, Conraths FJ, et al.: A new Puumala hantavirus subtype in rodents associated with an outbreak of Nephropathia epidemica in South-East Germany in 2004. Epid Infect 2006; 134(6): 1333-1344.
- Mertens M, Kindler E, Emmerich P, et al.: Phylogenetic analysis of Puumala virus subtype Bavaria, characterization and diagnostic use of its recombinant nucleocapsid protein. Virus Genes 2011; 43: 177-191.
- Essbauer SS, Dobler G, Zöller L, et al.: Hantavirus-Herdanalyse zur Abschätzung des Infektionsrisikos am Truppenübungsplatz Heuberg. Wehrmed Mschr 2010; 54 (3): 83-86.
- Ulrich RG, Schlegel M, Jacob J, Pelz HJ, et al.: Network „Rodent-borne pathogens“in Germany: Longitudinal studies on the geographical distribution and prevalence of hantavirus infections. Parasitology Res. 2008; 103(Suppl. 1): 121-129.
- Silaghi C, Bässler C, Baum U, et al.: Vektorübertragene zoonotische Erkrankungen in Zeiten des Klimawandels. Der bayerische Forschungsverbund VICCI stellt sich vor. Tierärzteblatt 2012; 3: 350-359.
- Bouyer DH, Walker DH : Rickettsia rickettsii and other members of the spotted fever group as potential bioweapons. Microorganisms and Bioterrorism. Anderson B, Friedman H, Bendinelli M (Eds.): Springer Verlag; 2006: 227-235.
- Dobler G: Läuse-Fleckfieber, Zeckenstichfieber und andere Rickettsiosen. Krank durch Arthropoden. Aspöck H (Ed.): Denisia 2010; 30: 565–592.
- Bässler C, Förster B, Moning C, Müller J: The BIOKLIM Project: Biodiversity Research between Climate Change and Wilding in a Temperate Montane Forest – The conceptual framework. Waldökologie, Landschaftsforschung und Naturschutz 2009; 7: 21-34.
- Heyman P, Thoma BR, Marié JL, Cochez C, Essbauer SS: In search for factors driving hantavirus endemics. Frontiers in Physiology. Frontiers in Systems Biology. Topic: Global change and human vulnerability to vector-borne diseases. Bueno-Marí R, Jiménez-Peydró R (Eds.) 2012 (submitted).
- Schex S, Dobler G., Riehm J, Müller J, Essbauer S: Rickettsia spp. in wild small mammals in Lower Bavaria, South-Eastern Germany. Vector Borne Zoonotic Dis 2011; 11: 493-502.
- Ettinger J, Hofmann J, Enders M, et al.: Multiple synchronous Puumala virus outbreaks, Germany, 2010. Emerg Infect Dis 2012 (in revision).
Danksagung
Im Rahmen des Projektes wurden eine Promotion (S. Schex) und zwei Masterarbeiten (A. Osterberg, B. R. Thoma) erstellt. Danke an die Helfer bei den aufwendigen Feldarbeiten H. Weber, D. Woll, M. Pollaerts, R. Reiter, D. Timineri. Das VICCI-Projekt wurde von 7/2008 bis 12/2011 gefördert vom Bayerischen Staatsministerium für Umwelt, Gesundheit und Verbraucherschutz (Projekt 08-18).
Datum: 27.08.2012
Quelle: Wehrmedizinische Monatsschrift 2012/4