TOLLWUT - ENTWICKLUNG EINSATZORIENTIERTER DIAGNOSTIKVERFAHREN
Aus dem Zentralen Institut des Sanitätsdienstes der Bundeswehr Kiel¹, Laborabteilung II, Spezielle Tierseuchen- und Zoonosendiagnostik (Institutsleiter: Oberstveterinär Dr. H.-H. Pott), dem Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit² (Präsident: Prof. Dr. Dr. h.c. Th. C. Mettenleiter), dem Veterinary Laboratory Europe³, Landstuhl, United States Army Europe Regional Veterinary Command (Commander: Colonel L. G. Huck) und dem Referat Veterinärwesen⁴(Referatsleiter: Oberstveterinär Dr. M. Hoffmeister) der Stabsabteilung I des Führungsstabes des Sanitätsdienstes (Stabsabteilungsleiter: Generalarzt Dr. Ch. Veit)
von Alfred Binder¹, Jens Peter Teifke², Greg A. Saturday³, Bernd Hoffmann², Conrad Freuling², Thomas Müller² und Sabine Sauer⁴
Zusammenfassung
Die Tollwut verläuft als akute, letale virale Enzephalomyelitis und ist in den Einsatzländern der Bundeswehr häufig weit verbreitet. Das Reservoir sind besonders Hunde, Wildfleischfresser und verschiedene Fledermausarten.
Die Infektion des Menschen erfolgt meistens durch Hunde. Im Rahmen eines Sonderforschungsvorhabens der Bundeswehr wurde als Alternative zum etablierten Immunfluoreszenz- Test ein Real-time RT-PCR-Verfahren zum schnellen, hoch sensitiven Nachweis des Tollwutvirus etabliert. Die PCR wurde mit verschiedenen anderen diagnostischen Verfahren in Zusammenarbeit mit dem Veterinary Laboratory Europe, US-Army, Landstuhl, erfolgreich für die Untersuchung von Probenmaterial aus Afghanistan, dem Irak und Bosnien eingesetzt. 2011 ist die Erprobung dieser Realtime RT-PCR im Einsatzlabor bei KFOR im Kosovo geplant.
Rabies – Development of Diagnostic Tests for Deployment
Summary
Rabies is an acute lethal viral encephalomyelitis. The virus infection is widely distributed in areas of the German Armed Forces deployment. Carnivores especially dogs and also bats are reservoirs of this virus. Humans are mainly infected by dogs. In a scientific research project a Real-time RT-PCR was established as a rapid and highly sensitive test method for rabies virus. PCR was used besides other diagnostic methods. This project was conducted in cooperation with the Veterinary Laboratory Europe, US-Army, Landstuhl, for testing samples from Afghanistan, Iraq and Bosnia. A field trial for the establishment of the test method in Kosovo (KFOR) is planned for 2011.
1. Einleitung
Die Tollwut, eine seit mehr als 4000 Jahren bekannte Zoonose, wird durch neurotrope Lyssaviren aus der Familie der Rhabdoviridae verursacht, die eine akute, progressive Enzephalomyelitis hervorrufen. Nach Auftreten klinischer Erscheinungen ist der Verlauf der Erkrankung nahezu in jedem Fall tödlich. Es sind bislang weltweit 12 Spezies des Virus beschrieben, von denen das Klassische Tollwutvirus (RABV), das European Bat Lyssa Virus 1 (EBLV-1), das European Bat Lyssa Virus 2 (EBLV-2) sowie das West Caucasian Bat Lyssavirus (WCBV) in Europa vorkommen. Hunde, Wildfleischfresser und einige Fledermausarten gelten als Reservoirspezies dieser Viruserkrankungen [1].
Die Letalität der Erkrankung, verbunden mit dem endemischen Vorkommen in derzeitigen und möglicherweise zukünftigen Einsatzgebieten, erfordert neben der Impfprävention eine feldtaugliche zuverlässige Diagnostik dieser Virusinfektion. Der Goldstandard zum Nachweis des Tollwutvirus post mortem ist nach wie vor der direkte Immunfluoreszenztest (IFT) in Abklatschpräparaten verschiedener Hirnabschnitte [2]. Diese Nachweismethode ist bereits im Veterinärmedizinischen Einsatzlabor etabliert; jedoch ist die Zuverlässigkeit dieser Diagnostikmethode u. a. stark von der Qualifikation und dem Training des Untersuchers abhängig. Für die Diagnostik im Auslandseinsatz wurde daher als molekularbiologisches Nachweisverfahren der Tollwutinfektion eine hoch sensitive und spezifische Real-time RT-PCR entwickelt. Die hier beschriebenen Arbeiten werden in Kooperation mit dem „Collaborating Centre“ der Weltgesundheitsorganisation (WHO) für Tollwut und dem Nationalen Referenzzentrum für Tollwut am Friedrich-Loeffler-Institut (FLI) im Rahmen des Sonderforschungsvorhabens „Nachweis des Tollwutvirus nach automatisierter RNA-Präparation aus Organen mittels Real-time RT-PCR unter Einsatzbedingungen“ (01Z5-S-850708) durchgeführt.
2. Erkrankung
Tollwutvirus wird mit dem Speichel infizierter Tiere ausgeschieden und in der Regel durch Bisse übertragen. Seltener erfolgt die Infektion durch Kratzer, Lecken von Wunden oder Schleimhäuten oder in Einzelfällen auch durch Organtransplantationen. Das Virus repliziert primär am Inokulationsort und führt zur Infektion von Skelettmuskeln. Anschließend gelangt es über die Bindung an nikotinerge Acetylcholinrezeptoren in periphere Nervenendigungen der neuromuskulären Endplatte. Dringt das Virus direkt in periphere Nervenendigungen ein, verkürzt sich die Inkubationszeit drastisch. Das Virus bewegt sich mit einer Geschwindigkeit von ca. 12– 100 mm pro Tag durch intraaxonalen retrograden Transport in sensorischen und motorischen Nerven von der Peripherie ins ZNS.
Eine hämatogene Ausbreitung spielt keine wesentliche Rolle. Klinische Symptome treten auf, sobald das Virus das Gehirn erreicht. Die Dichte der Nervenendigungen an der Bissstelle und die Entfernung zum Gehirn bestimmen deshalb im Wesentlichen die Inkubationszeit. Bisse im Gesicht und an den Händen sind dabei besonders gefährlich. Während der Ausbreitung des Virus im ZNS kommt es auch zu einer zentrifugalen Bewegung über anterograden axonalen Transport in die peripheren Hirnnerven. Dieser Prozess führt zu einer Infektion verschiedener Gewebe, wie der Mundhöhle und der Speicheldrüsen, und ermöglicht zusammen mit dem aggressiven Verhalten infizierter Tiere die Übertragung des Virus auf den nächsten Wirt. Der Speichel von Hunden und Katzen kann schon drei bis fünf Tage vor Auftreten klinischer Symptome infektiös sein. Bei fast allen Säugetieren verläuft eine manifeste Infektion tödlich [3]. Bis zur Mitte des vorigen Jahrhunderts trat die Tollwut in Mitteleuropa als typische Haustiertollwut auf.
Das Hauptreservoir waren Hunde. Durch strenge veterinärbehördliche Regelungen konnte diese urbane Form der Tollwut unter Kontrolle gebracht werden. Nach dem zweiten Weltkrieg breitete sich dann allerdings aus dem damaligen Ostpreußen die silvatische Form der Tollwut durch den Rotfuchs (Vulpes vulpes) aus. Im Jahre 1951 überschritt sie die damalige innerdeutsche Grenze. Bis in die 90er Jahre des vorigen Jahrhunderts gab es jährlich mehrere tausend Fälle in der Tierpopulation und vereinzelt, dann aber stets letal verlaufende, Erkrankungen beim Menschen. Durch Impfung mit präparierten Ködern gelang es, die Krankheit in der Fuchspopulation unter Kontrolle zu bringen.
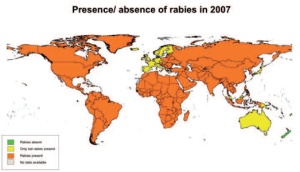
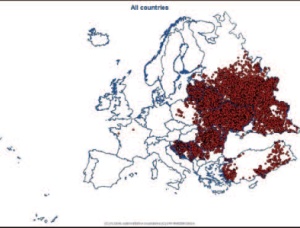
Der letzte Fall von Tollwut beim Fuchs wurde im Februar 2006 festgestellt und seit 2008 gilt Deutschland nach internationalen Kriterien als frei von klassischer Tollwut [4]. Trotz strenger tierseuchenrechtlicher Vorschriften kam es in Mitteleuropa gelegentlich zum illegalen Import infizierter, in der Inkubationsphase befindlicher, Hunde aus Ländern mit endemischer Tollwut, die dann im Importland erkrankten [5]. In weiten Teilen Mitteleuropas ist die Infektion entweder getilgt oder mittlerweile selten. In anderen Teilen der Welt stellt sich die Situation wesentlich dramatischer dar. Weltweit sind 2 - 3 Mrd. Menschen gefährdet und bereits im nahen Osteuropa ist die Tollwut stark verbreitet (Abb 1, 2).
Nach Schätzung der WHO fallen der Infektion jährlich 40 000 bis 55 000 Menschen mit Schwerpunkt in Asien und Afrika zum Opfer, wobei die Dunkelziffer durch mangelhaftes Meldewesen in den meisten Regionen hoch einzuschätzen ist. In diesen Ländern ist nach wie vor der Hund der Hauptüberträger der Erkrankung [1]. Fledermäuse stellen weltweit für 11 der 12 klassifizierten Virusspezies innerhalb des Genus Lyssavirus das Hauptreservoir dar. Deutschland beherbergt ca. 34 Fledermausarten mit unterschiedlichem geografischem Vorkommen und gehört zu den Ländern Europas mit den meisten Fällen von Fledermaustollwut. In Europa sind es das European Bat Lyssa Virus 1 und 2 (EBLV-1 und -2) sowie das West Caucasian Bat Lyssavirus (WCBV). Tollwutfälle sind zwar selten, wenn sie jedoch auftreten, sind besonders Tiere in Norddeutschland betroffen, weil hier die empfänglichen Fledermausarten, die Breitflügel- und die Wasserfledermaus, vorkommen [6]. Nach den Vorgaben des Internationalen Tierseuchenamtes (OIE) ist Deutschland damit tollwutfrei. Die Kriterien der WHO werden allerdings nicht erfüllt, denn dort wird sowohl die Freiheit von terrestrischer als auch von Fledermaustollwut gefordert.
3. Diagnostik der Tollwut
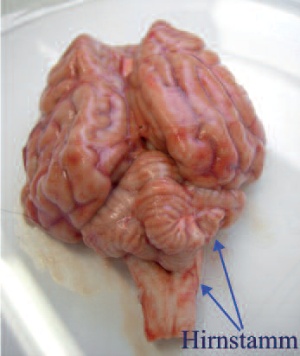
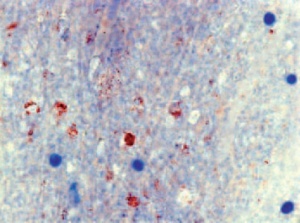
Die Tollwutdiagnostik bei verendeten und getöteten Tieren beruht fast immer auf der Untersuchung von Gehirnmaterial. Der Virusnachweis ist auch aus Cornea- Abstrichen, Speichel- und Liquorproben möglich, ein negatives Ergebnis schließt eine Infektion jedoch nicht aus. Tollwutvirus ist bei Fleischfressern überwiegend im Bereich des Hirnstamms und des limbischen Systems (Ammonshorn) zu finden (Abb 3). Bei Pflanzenfressern findet sich das Virus oft im Bereich des Kleinhirns. Besonders wichtig ist die Auswahl des Probenmaterials für Immunfluoreszenzuntersuchungen und andere histologische bzw. immunhistologische Nachweise.
3.1. Immunfluoreszenztest
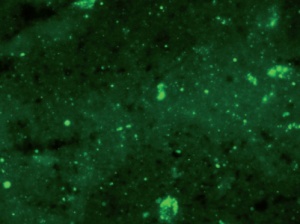
Goldstandard und Arbeitsvorschrift der WHO ist nach wie vor der Nachweis des Tollwutvirusantigens mittels Immunfluoreszenztest (Abb 4) [7]. Abklatschpräparate werden von den betroffenen Gehirnabschnitten, vorzugsweise Ammonshorn und Kleinhirn, hergestellt, mit Fluoreszenz-markierten Antikörpern behandelt und bei 200- bis 400-facher Vergrößerung im Mikroskop in einem abgedunkelten Raum untersucht. Intrazytoplasmatische Negri-Einschlüsse sind als kleine staubförmige oder auch als größere runde oder ovale Aggregate sichtbar mit brillant grün strahlender Fluoreszenz. Der Test stellt einige Anforderungen an die Erfahrung des Untersuchers und ist daher regelmäßig durchzuführen. Außerdem sollte die anatomische und zelluläre Integrität des Gehirngewebes weitgehend erhalten sein. Besonders in Einsatzgebieten ist dies nicht immer der Fall, bei höheren Temperaturen kommt es schnell zu autolytischem und heterolytischem Gewebszerfall, der häufig eine unspezifische Hintergrundfärbung zur Folge hat.
3.2. Molekularbiologischer Nachweis
Als schnelles, hoch sensitives Verfahren - auch aus stark autolytischen Proben - wurde daher am ZInstSanBw Kiel in einem Sonderforschungsvorhaben eine Real-time RT-PCR etabliert. Die kompakte Diagnostik-Einheit besteht aus einer Schüttelmühle zur Aufbereitung der Organe (Fa. Retsch), einem Aufreinigungsautomaten zur Extraktion der RNA (EZ 1, Fa. Qiagen) und dem Smart-Cycler zur Durchführung der Real-time PCR (Fa. Cepheid) (Abb 5). Die kompletten Untersuchungen einschließlich der Organaufbereitung und RNA-Extraktion können in 4 Stunden abgeschlossen werden. Die Real-time RT-PCR zeigte in den unterschiedlichen Versuchsanätzen eindeutige Ergebnisse. Aus Proben 10 verschiedener Tierarten (Fleisch-, Pflanzenfresser) und des Menschen war Tollwutvirus-RNA sicher nachweisbar. Der Nachweis von Virus-RNA aus Gehirnmaterial nach Lagerung bis zu 86 Tagen mit fortschreitender Autolyse des Organmaterials war möglich. Dabei war nur ein geringer Einfluss der Lagerung auf die Empfindlichkeit der PCRReaktion festzustellen. Die RNA-Extraktion aus Gehirnmaterial ist mit Ausgangsmengen zwischen 5 mg und 100 mg (Maximum der Testkit-Kapazität) Organmaterial ohne Schwierigkeiten möglich. Dies dokumentiert die Robustheit des Tests.
Durch die Auswertung der Reaktion mit fluoreszierenden Sonden als Realtime- Nachweis müssen die Amplifikate nach Ablauf der PCR nicht mehr weiter bearbeitet werden. Das Kontaminationsrisiko durch hoch angereicherte DNA-Produkte wird dadurch auf ein Minimum begrenzt. Die kompakte Bauart und die einfache, übersichtliche Bedienung der Geräte ermöglichen es, mit der Ausstattung sowohl im Zentralinstitut als auch im Einsatzlabor optimal zu arbeiten. Zudem kann das Gerät mit entsprechenden Primer-Sonden- Systemen einfach und schnell für den Nachweis weiterer Mikroorganismen, wie beispielsweise Bakterien, angepasst bzw. erweitert werden. In Zusammenarbeit mit dem „Veterinary Laboratory Europe“ (VLE, US-Army) in Landstuhl erfolgte die Untersuchung von Gehirnmaterial von 12 Hunden, 3 Rindern und einem Schwein aus Afghanistan, Bosnien und dem Irak. Alle untersuchten Proben von Tollwut-kranken Tieren konnten mit der etablierten PCRMethode sicher als „Tollwut-positiv“ diagnostiziert werden. Das Gehirnmaterial wurde nach dem Auftauen bei Zimmertemperatur gelagert und im Abstand von 7 Tagen zweimal untersucht. In beiden Ansätzen waren alle Untersuchungen eindeutig positiv.
3.3. Direct Rapid Immunohisto - chemical Test (DRIT-Test)
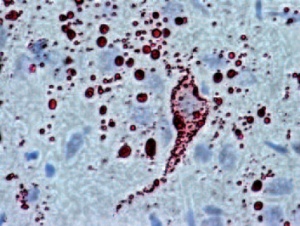
Als weitere diagnostische Option wurde in Zusammenarbeit mit dem VLE als Alternative zum Immunfluoreszenztest der vom amerikanischen Center for Disease Control (CDC) entwickelte „Direct Rapid Immunohistochemical Test (DRIT)“ etabliert [8]. Es handelt sich um ein chromatographisches Verfahren mit Markierung der tollwutinfizierten Zellen mit Antikörpern und die Anfärbung der Komplexe mit einem spezifischen Farbstoff (AEC). Die Gehirnproben können nach der Färbung mit einem normalen Lichtmikroskop ausgewertet werden. Ein aufwändiges Fluoreszenzmikroskop und die Auswertung in abgedunkelter Umgebung sind nicht nötig. Die Methode wurde insbesondere zur Anwendung in Ländern mit eingeschränkter oder mangelhafter Laborausstattung entwickelt, in denen Tollwut endemisch ist [9]. Die Methode ist geeignet für den Auslandseinsatz mit reduzierter Labor- Infrastruktur. Die Färbung infizierter Nerven- und Gliazellen ist im Tollwutpositiven Gehirngewebe sehr zuverlässig zu beurteilen (Abb 6a). Wie beim IFT stellt der DRIT jedoch ähnliche Anforderungen an die Erfahrung des Untersuchers und ist daher regelmäßig durchzuführen. Im Vergleich dazu ist die immunhistologische Färbung am Paraffinschnitt im Einsatzlabor zu zeitund arbeitsaufwändig (Abb 6b).
4. Diskussion und Schlussfolgerungen
Die Tollwut ist oftmals eine in den Einsatz- und Übungsgebieten der Bundeswehr weit verbreitete Erkrankung. Ziel des Forschungsvorhabens war die Entwicklung eines Real-time RT-PCRVerfahrens zum Nachweis des Tollwutvirus im Veterinärmedizinischen Einsatzlabor. Besonderes Interesse gilt hier der Feldtauglichkeit und der einfachen Durchführbarkeit der Nachweismethoden. Diese beruhen auf weitgehend automatisierten Arbeitsschritten. Für die Extraktion der Virus-RNA aus Gehirnmaterial ist das automatisierte Verfahren mit einem kompakten Aufreinigungsautomaten optimal geeignet.
Die PCR-Untersuchungen von Tollwutpositiven Gehirnen im Vergleich zu negativen Kontrollorganen zeigten auch noch nach 86 Tagen in stark autolytischem Material eindeutig positive Reaktionen mit gleichbleibend niedrigen CT-Werten bzw. negative Reaktionen bei nicht infizierten Gehirnen. In Bezug auf den Einsatz unterschiedlicher Probenmengen erwies sich der Test ebenfalls als sehr robust. Die Untersuchungsverfahren haben sich bei der Untersuchung von Feldmaterial aus dem Irak, Afghanistan und Bosnien in Zusammenarbeit mit dem Veterinary Laboratory Europe (VLE, US-Army, Landstuhl) bewährt. Im Rahmen der Kooperation wurden die Proben mit der im Forschungsvorhaben entwickelten Real-time RT-PCR, dem in Ergänzung zum Forschungsvorhaben getesteten DRIT, der Immunfluoreszenz und der Zellkultur untersucht.
Als Vorbereitung für die Etablierung der Tierseuchen- und Zoonosendiagnostik im Einsatzlabor ist geplant, die im ZInstSanBw Kiel erprobten Verfahren einschließlich der beschriebenen Laborausstattung im Kosovo auf Einsatztauglichkeit zu prüfen.
Literatur
- World Health Organization (WHO). Human and animal rabies. http://www.who.int/rabies/en/. Aufgerufen am 20. November 2010.
- World Organization for Animal Health [OIE]. Manual of diagnostic tests and vaccines for terrestrial animals. OIE; 2008. Rabies. Available at: http://www.oie.int/eng/normes/mmanual/2008/ pdf/2.01.13_RABIES.pdf. Aufgerufen am 20. November 2010.
- Ugolini G: Use of rabies virus as a transneuronal tracer of neuronal connections: implications for the understanding of rabies pathogenesis. Dev Biol (Basel) 2008; 131: 493-506.
- Müller T, Bätza HJ, Beckert A, Bunzenthal C, Cox JH, Freuling CM et al.: Analysis of vaccine-virusassociated rabies cases in red foxes (Vulpes vulpes) after oral rabies vaccination campaigns in Germany and Austria. Arch Virol 2009; 154(7): 1081-1091.
- Galperine T, Neau D, Moiton MP, Rotivel Y, Ragnaud JM.: Risque de rage en France et importation illégale d’animaux en provenance de zones d’endémie rabique. Presse Med 2004; 33(12 Pt 1): 791-792.
- Freuling C, Vos A, Johnson N, Fooks AR, Müller T: Bat rabies—a Gordian knot? Berl Munch Tierärztl Wochenschr 2009; 122(11-12): 425-433.
- Dean DJ, Abelseth MK, Atanasiu P: The fluorescent antibody test. In: Meslin FX, Kaplan MM, Koprowski H, editors. Laboratory Techniques in Rabies, fourth ed. Geneva: World Health Organization. 1996; pp. 88–89.
- 8. Lembo T, Niezgoda M, Velasco-Villa A, Cleaveland S, Ernest E, Rupprecht CE: Evaluation of a direct, rapid immunohistochemical test for rabies diagnosis. Emerg Infect Dis 2006; 12(2): 310-313.
- Durr S, Naissengar S, Mindekem R, Diguimbye C et al. Rabies diagnosis for developing countries. PLoS Negl Trop Dis 2008; 2(3): e206
Datum: 22.02.2011
Wehrmedizinische Monatsschrift 2010/11-12