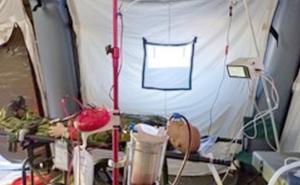
ECMO in der Einsatzmedizin - nützliches Hilfsmittel oder aufwändiges High-Tech Tool?
Aus der Klinik für Orthopädie und Unfallchirurgie (Leitender Arzt: Oberstarzt M. Johann) des Bundeswehrkrankenhauses Hamburg (Kommandeur und Ärztlicher Direktor: Generalarzt Dr. J. Hoitz)
Zusammenfassung
Die extracorporale Membranoxygenierung (ECMO) ist in den letzten Jahrzehnten bei der Versorgung kardiopulmonaler Erkrankungen zum festen Bestandteil der Intensivmedizin geworden. Die zunehmende Sicherheit der Systeme, die mittlerweile auch als portable Einheiten - dann als ECLS (Extracorporeal Life Support) - zur Verfügung stehen, hat deren Anwendungsgebiet auch in die Kardiologie sowie für die Versorgung bei kardiopulmonaler Reanimation ausgeweitet. Erste Erfahrungen mit militärischem Einsatz der Systeme stammen von den US-amerikanischen und britischen Streitkräften aus dem letzten Irak-Krieg.
Bei der ECMO handelt es sich um eine Art Herz-Lungen-Maschine, die ein für Erwachsene ausreichendes Herzzeitvolumen sowie einen kompletten Gasaustausch ermöglicht. Herzstück sind eine Zentrifugalpumpe und ein Oxygenator. Während in der Intensivtherapie auch veno-venöse Systeme Anwendung finden, hat sich insbesondere für den Transport eine venös-arterielle Versorgung in der zivilen Anwendung etabliert, da hierdurch auch die Hämodynamik stabil gewährleistet ist. Die Gerinnungshemmung erfolgt mit Heparin, das Monitoring über die ACT (Activated Clotting Time).
Während ein Einsatz von ECMO-Systemen im Rahmen von Operationen oder intensivmedizinischen Maßnahmen im Einsatzland derzeit aufgrund des Personalbedarfs und des Equipments nicht denkbar ist, wären die Systeme für die Repatriierung im Rahmen des StratAirMedEvac¹ durchaus anwendbar und würden hier den zügigen Transport auch schwer kardiopulmonal eingeschränkter Soldaten und Soldatinnen nach Deutschland mit anschließender intensivmedizinischer Weiterbetreuung ermöglichen.
Stichworte: ECMO, ECLS, Lungenersatz, Kreislaufunterstützung, strategische Evakuierung
Keywords: ECMO, ECLS, pulmonary assist, cardiac assist, strategic evacuation
Einleitung
Die extracorporale Membranoxygenierung (ECMO) wurde ursprünglich in den neunziger Jahren in die Klinik eingeführt, um bei Patienten mit schweren akuten Lungenerkrankungen die Oxygenierung und Decarboxylierung des Körpers zu ermöglichen, wenn dies mit konventionellen Beatmungstechniken nicht mehr erreicht werden konnte. Unter der Therapie kann die Ventilation physiologisch gestaltet werden, wodurch der Stress auf das Lungenparenchym durch die ansonsten invasive und belastende Beatmung mit hohen Drücken und Sauerstoff-Partialdrücken reduziert werden konnte und eine Regeneration erreicht wurde. In den folgenden Jahren wurde das Anwendungsgebiet zunächst sehr erfolgreich vorwiegend auf die Kinderherzchirurgie ausgedehnt. Hier konnte durch Einsatz als veno-arterielles System nach komplexen kinderherzchirurgischen Korrekturoperationen Oxygenierung und Kreislaufstabilität nach Operation mit der Herz-Lungen-Maschine mit konsekutivem capillary-leak und pulmonalem sowie kardinalem Ödem sichergestellt werden. Hierdurch wurde es den Patienten ermöglicht, sich vom operativen Stress zu erholen; insbesondere die kardiale und pulmonale Funktion zeigten unter dieser Indikation bei erfolgreicher Korrektur des Vitiums sehr gute Regenerationsmöglichkeiten.
In der folgenden Zeit wurden die Einsatzgebiete der ECMO im Bereich der Erwachsenen-Herzchirurgie weiter ausgedehnt, auch wenn die Ergebnisse bei Verwendung bei Post-Kardiotomie-Patienten deutlich schlechter im Vergleich zu den pädiatrischen Patienten ausfallen. In den letzten Jahren sind die Systeme zunehmend verkleinert, standardisiert und mittlerweile auch transportabel geworden, so dass sie nun unter der Bezeichnung ECLS (Extracorporeal Life Support) nach einer Reanimation oder auch zum Transport kardiopulmonal schwer beeinträchtigter und instabiler Patienten in ein entsprechendes Zentrum eingesetzt werden.
Erste Einsatzerfahrungen wurden durch die US-amerikanischen und britischen Streitkräfte im letzten Irak-Krieg gesammelt [1, 2, 4, 6]. Bei der Erstanwendung kam es während der Repatriierung eines Schwerverletzten zu einer pulmonalen Dekompensation, so dass die begleitende Rettungsmedizinerin den Soldaten kaum noch ventilieren konnte. Im Rahmen der dadurch erzwungenen Landung erfolgte dann in Kooperation mit der Universität Regensburg die Versorgung mit einer ECMO; der Patient überlebte.
Technik und Material
Grundsätzlich handelt es sich bei der ECMO oder auch dem prinzipiell baugleichen ECLS-System um eine Art kleiner Herz-Lungen-Maschine. Über großlumige Kanülen erfolgt die Drainage venösen Blutes, das über eine Zentrifugalpumpe durch einen Oxygenator geleitet und anschließend wieder über eine entsprechende Kanüle in den Körper zurückgeleitet wird. Die beiden Hauptunterschiede zur konventionellen Herz-Lungen-Maschine, wie sie im Rahmen kardiochirurgischer Eingriffe eingesetzt wird, sind der Pumpenmechanismus und das Vorliegen eines geschlossenen Systems.
Als Pumpen kommen in ECLS-Systemen grundsätzlich Zentrifugalpumpen zum Einsatz, während bei der konventionellen Herz-Lungen-Maschine Rollerpumpen eingesetzt werden. Der große Vorteil besteht in der deutlich geringeren Traumatisierung insbesondere der korpuskulären Bestandteile des Blutes, wodurch
- die Hämolyse verringert,
- Thrombozyten in geringerem Ausmaß zerstört und aktiviert werden und dadurch auch
- die Komplementaktivierung deutlich vermindert wird.
Nachteilig ist der höhere Preis der Pumpenköpfe sowie die große Empfindlichkeit gegenüber Luftbläschen im System, die sich im Pumpenkopf ansammeln und zum Transportverlust führen. Aus diesem Grund handelt es sich ausschließlich um geschlossene Systeme. Es existiert kein Reservoir und keine Öffnung zur Umwelt, wodurch Lufteintritte verhindert werden. Gleichzeitig existieren aber auch keine Luftfallen, so dass die Systeme bei Inbetriebnahme oder auch bei Komponentenwechseln sorgfältig entlüftet werden müssen.
Der Einsatz kann grundsätzlich auf zwei verschiedene Arten erfolgen:
- veno-venös oder
- veno-arteriell.
Es kommt daher bei schweren, isoliert pulmonalem Funktionsstörungen, z. B. ARDS, im Rahmen der intensivmedizinischen Behandlung zum Einsatz.
Veno-arterielle Implantation
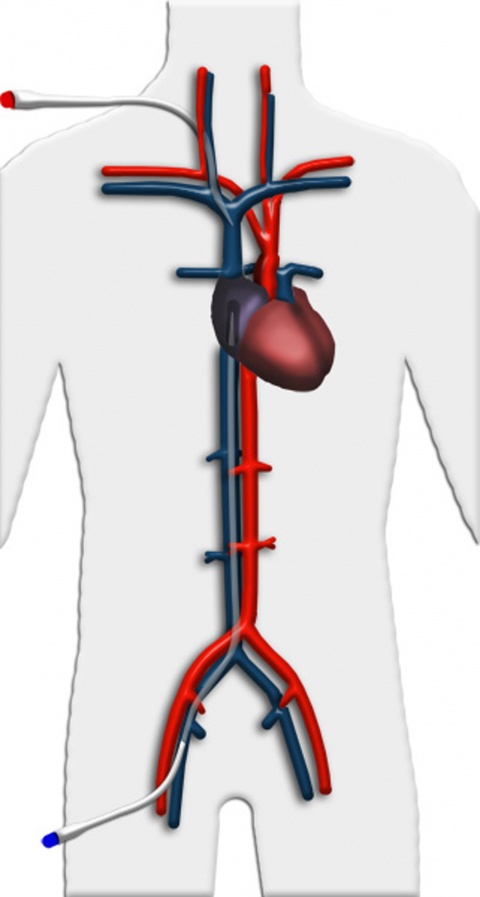
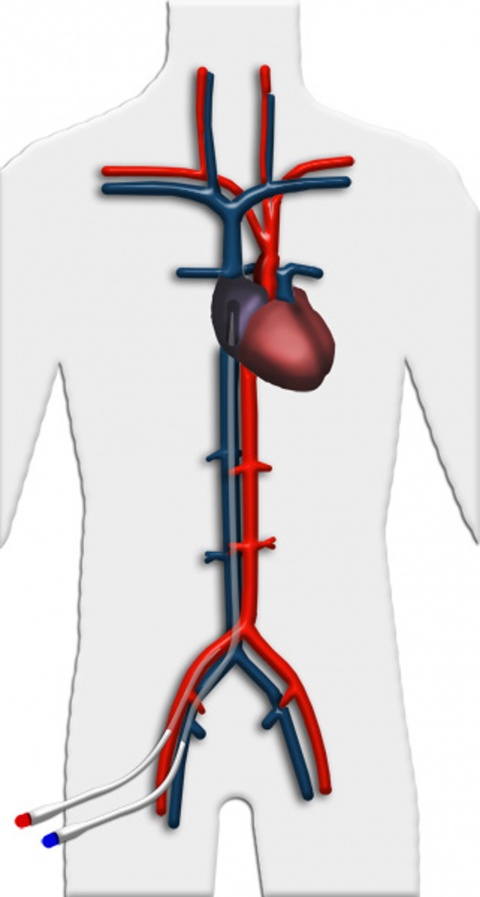
Eine weitere Einsatzmöglichkeit ist die Wiedererwärmung stark unterkühlter Patienten, z. B. nach Eisunfällen. Durch das System wird hierbei ein suffizientes Herzzeitvolumen zur Perfusion der Organe sichergestellt, zusätzlich kann das Blut über einen an den Oxygenator angeschlossenen Wärmeaustauscher angewärmt werden. Hierdurch kann eine schonende Wiedererwärmung eines Patienten ohne die gefürchteten Komplikationen bei reiner Oberflächenerwärmung in etwa zwei Stunden erreicht werden.
Gerinnungsmanagement
Die große Fremdoberfläche insbesondere des Oxygenators führt trotz moderner Coating-Verfahren zu einer Gerinnungsaktivierung, so dass zur Vermeidung von Oxygenator-Thrombosen und Thromboembolien eine suffiziente Gerinnungshemmung, in der Regel mit Heparin, erfolgen muss. Aufgrund der geringeren Traumatisierung des Blutes durch die Zentrifugalpumpe im Vergleich zu den Rollerpumpen, den kürzeren Schlauchlängen und des Fehlens jeden Luftkontaktes ist hier allerdings eine ACT von 180 Sekunden ausreichend; bei einer konventionellen Herz-Lungen-Maschine werden hier Zeiten > 400 Sekunden angestrebt. Bei Implantation erfolgt in der Regel eine Bolusgabe von 5000 IE Heaprin i. v., anschließend wird die Gerinnung durch kontinuierliche Heparingabe über Perfusor eingestellt. Nach Erreichen des Steady State im Zielbereich ist entsprechend der Halbwertszeit eine ACT-Kontrolle alle 30 - 120 Minuten erforderlich, abhängig von der Gesamtsituation und Stabilität des Patienten.
Komplikationen
An erster Stelle sind hier die vaskulären Komplikationen bei der Implantation der Kanülen zu nennen. Diese reichen von lokalen Gefäßverletzungen, wie Perforation oder Abscherung von Seitenästen bis hin zur retrograden Aortendissektion (etwa 2 – 5 % der Anwendungsfälle), letztere in der Regel mit letalem Ausgang. Allerdings muss hier bei einem potenziellen Einsatz in der militärischen Einsatzmedizin der große Unterschied zum zivilen Bereich, aus dem die Erfahrungen stammen, hervorgehoben werden. Während es sich im zivilen Bereich in der Regel um ältere Patienten mit z. T. erheblichen Comorbiditäten, insbesondere einer häufig vorhandenen Arteriosklerose, handelt, sind verletzte Soldatinnen oder Soldaten in aller Regel jünger und gesund; sie sind nicht "krank", sondern "beschädigt", was einen deutlichen Einfluss auf die Inzidenz vaskulärer Komplikationen haben dürfte. So ist es bei jungen Patienten zum Beispiel möglich, auch 17F-Kanülen aus der A. femoralis zu entfernen und die Punktionsstelle der Arterie durch 25-minütige lokale Kompression ohne Residenz zu verschließen (eigene Erfahrung).
Schwierigkeiten mit der Perfusion können manchmal auftreten, wenn die Patientinnen und Patienten hypovoläm sind, da die Systeme für ein ausreichendes Flussvolumen ein gut gefülltes Gefäßsystem benötigen. Hier ist dann eine differenzierte Katecholamin-/Volumentherapie erforderlich. Bei noch erhaltener linksventrikulärer Funktion kann es zu einer Minderoxygenierung des Kopf-/Halsbereiches kommen, wenn nämlich der linke Ventrikel bei schwer eingeschränkter pulmonaler Funktion noch soviel Eigenauswurf produziert, dass das untersättigte Blut aus den Lungenvenen primär in die Kopf-/Halsgefäße ausgeworfen wird, während die über die A. femoralis zuführende ECMO das gesättigte Blut gegen den Auswurf des linken Ventrikels nur bis in die Aorta descendens fördert. Um diese Problematik zu erkennen, ist eine Überwachung der Blutgase über eine Radialarterie erforderlich. Sollte dieses Phänomen detektiert werden, kann durch eine bessere Drainage, z. B. eine zusätzliche venöse Kanüle, die Vorlast des linken Ventrikels und damit dessen Auswurfleistung gesenkt werden. Alternativ besteht auch die Möglichkeit einer zweiten arteriellen Kanüle zur Rückführung oxygenierten Blutes über die A. subclavia.
Die Thrombose des Oxygenators ist ein in der Regel langsam auftretendes Phänomen, das über einen variablen Zeitraum einiger Stunden zum Verschluss des Oxygenators und damit zum Erliegen der Funktion der ECMO/ECLS führt. Es ist durch die Druckverhältnisse im System, die Oxygenierungsleistung sowie auch optisch durch Thrombenbildung im Oxygenator frühzeitig erkennbar und erfordert den Wechsel des Oxygenators. In aller Regel wird hierfür ein neues System gefüllt (Priming). Anschließend wird während eines kurzen Stillstandes das alte Systems von den Kanülen des Patienten diskonnektiert und anschließend das neue angeschlossen; hierfür liegt der Zeitansatz bei unter einer Minute, bis das neue System wieder angefahren wird, so dass selbst bei Patienten, die vollständig vom ECMO/ECLS abhängen, keine Beeinträchtigung zu erwarten ist.
Die übrigen Komplikationen betreffen hauptsächlich den mittelfristigen Verlauf und damit kaum die Einsatzmedizin. Sie beinhalten thromboembolische, vor allem aber septische Verläufe nach mehreren Wochen ECMO-Therapie, die bei fehlender Regeneration der kardialen/pulmonalen Funktionen des/der Behandelten dann im Rahmen der intensivmedizinischen Therapie verlaufsbestimmend werden.
Personelle Voraussetzungen zum Betrieb einer ECLS
In der Regel bestehen Teams, die mit mobilen ECLS-Geräten Patientinnen oder Patienten transportieren, aus drei Personen der Fachrichtungen:
- Rettungsmedizin/Anästhesie,
- Chirurgie (Kardio-/Gefäßchirurgie) und
- Kardiotechnik.
Die Implantation der Kanülen erfolgt in Seldinger-Technik, bei besonderer anatomischer Situation (Adipositas, periphere arterielle Verschlusskrankheit) kann eine chirurgische Freilegung der Leistengefäße nötig sein; gegebenenfalls erfolgt dann die Implantation über eine End-zu-Seit aufgebrachte 8 mm Gefäßprothese, den sogenannten „Schornstein". Das Management des Kreislaufs und der Ventilation obliegt der Anästhesie bzw. Rettungsmedizin und die Funktionsüberwachung des Systems während des Transportes liegt in den Händen einer eingewiesenen, erfahrenen Pflegekraft; diese gehört im zivilen Bereich in aller Regel zur Kardiotechnik.
Verwendungsmöglichkeiten der ECMO in der Einsatzmedizin
Neben dem Ersatz der pulmonalen Funktion ermöglicht insbesondere die veno-arterielle Implantation auch eine Stabilisierung der Kreislaufsituation. Dadurch wird es möglich, auch komplexere intrathorakale Eingriffe vorzunehmen. Es ergeben sich also folgende theoretische Einsatzmöglichkeiten:
- Ersatz der pulmonalen Funktion [2, 5],
- Transport (kardio-)pulmonal schwer kompromittierter Patienten sowie
- kurzzeitiger perioperativer Einsatz bei schweren thorakalen Verletzungen.
Ersatz der pulmonalen Funktion
Patienten mit schwer beeinträchtigter pulmonaler Funktion profitieren von einem ECMO-Einsatz durch die Sicherstellung der Oxygenierung des Körpers bei gleichzeitiger Vermeidung einer invasiven Beatmung, wodurch die Chance auf eine Erholung der Lungenfunktion erhöht wird. Je nach Ausmaß der Schädigung kommen heute auch weniger invasive Verfahren wie ILA² oder ILA-active zum Einsatz, bei denen das arteriovenöse Druckgefälle (ILA), ggf. mit geringer Pumpenunterstützung (Rollerpumpen, ILA-active), ausgenutzt werden. Beide Verfahren haben gegenüber der ECMO aber Grenzen im Einsatzspektrum; auch dürfte eine eine derart differenzierte Assist-Therapie voll ausgestatteten Intensivstationen (Role 4) vorbehalten sein, zumal die Kanülierungstechniken und damit zum Teil die vaskulären Komplikationen gleich sind.
Der reine Ersatz der pulmonalen Funktion geht immer einher mit einer längeren intensivmedizinischen Behandlung. Für einen Transport über längere Strecken erscheint eine rein veno-venöse Implantation eher riskant. Aus den zivilen ECLS-Programmen wissen wir, dass oftmals Patienten, die unter der Vorstellung einer rein pulmonalen Problematik für den Transport ins Zentrum zunächst veno-venös versorgt wurden, in einem hohen Prozentsatz (> 40 %) auf dem Transport oder bereits vor dem Verladen auch hämodynamisch instabil werden und dann auf eine veno-arterielle Instrumentierung umgestellt werden muss. Daher wird dieser Ansatz bei für den Transport vorgesehenen Patienten nur noch in Ausnahmefällen angewandt.
Transport
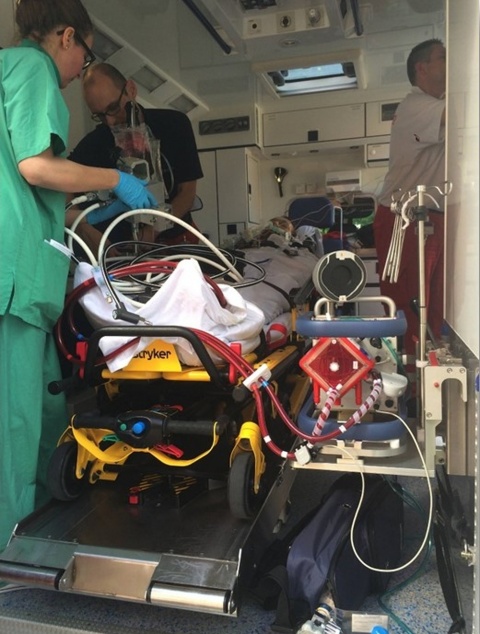
Intra-/perioperativer Einsatz
Durch den verbesserten Körperschutz kommen heute Verwundete zur medizinischen Versorgung, die es noch vor wenigen Jahrzehnten nicht einmal bis zu einer DCS-Unit geschafft hätten. Hierbei stehen dann oft schwere thorakale Verletzungen im Vordergrund, deren Versorgung chirurgisch aufwändig ist. Besondere Bedeutung kommt hierbei der hämodynamischen Stabilität und der Oxygenierung zu, da diese Faktoren entscheidend für die weitere Prognose nach chirurgischer Versorgung der thorakalen Verletzungen sind; nach Blutstillung/Versorgung von pulmonalen Verletzungen steht ein drohendes Multiorganversagen bei zu lange bestandener hämodynamischen Instabilität und/oder Hypoxie dann im Vordergrund und wird verlaufsbestimmend. Durch den Einsatz einer ECMO könnten bei schweren thorakalen Verletzungen hämodynamische Stabilität und Oxygenierung sichergestellt werden. Im zivilen Bereich erfolgen praktisch alle Lungentransplantationen, die eine Unterstützung benötigen, heute mit ECMO und nicht mehr mit herkömmlicher Herz-Lungen-Maschine. Auch kardiale Verletzungen sind unter entlastetem deutlich besser und sicherer zu versorgen als bei unter Last stehendem Herzen. Der Einsatz der ECMO wird daher perspektivisch auch im Rahmen der Traumaversorgung an sich zumindest diskutiert [3], da sich das chirurgische Trauma durch den Erhalt der hämodynamischen Stabilität und der Oxygenierung insbesondere bei Polytraumatisierten reduzieren lässt.
Zusammenfassung und Ausblick
Zuallererst muss festgehalten werden, dass ECMO/ECLS keine Therapien im eigentlichen Sinne darstellen sondern Hilfsmittel sind, um die wichtigen kardiopulmonalen Funktionen für einen gewissen Zeitraum (maximal etwa vier Wochen) zu ersetzen und somit Zeit für chirurgische Maßnahmen beziehungsweise die Regeneration zu schaffen. Der Einsatz dieser Verfahren gewinnt für die behandelnden Ärztinnen und Ärzte und die zu Behandelnden also lediglich Zeit für die eigentliche Therapie.
Aufgrund der notwendigen personellen und logistischen Erfordernisse ist eine Anwendung der Verfahren im Einsatz derzeit schwer vorstellbar, da in der Bundeswehr zurzeit die erforderlichen Fähigkeiten nicht in ausreichendem Maß vorgehalten werden. Es ist aber durchaus denkbar, entsprechende Teams aus Rettungsassistenz/Kardiotechnik, Rettungsmedizin und Chirurgie zu schulen, um als ersten Schritt den Einsatz von ECLS/ECMO im Rahmen von Verwundetenlufttransporten (StratAirMedEvac) zu etablieren. Hier wären Kooperationen der Bundeswehrkrankenhäuser mit zivilen Zentren, die bereits flächendeckend ECLS-Transporte durchführen, zu diskutieren, um das Know-how zu erlangen. Es erscheint nicht sinnvoll, auf zivile Begleitung für derartige Transporte zu setzen, wie dies in den Publikationen der US-Amerikaner zusammen mit der Universität Regensburg noch erfolgte; erstens wäre für solche Einsätze eine gewisse Einsatzerfahrung aller Teammitglieder notwendig, zweitens darf bezweifelt werden, ob sich Personal der zivilen Kardiotechnik/Chirurgie abseits von den publizierten "Pionierflügen" dazu bereit erklären würden.
Anlaufstelle für solche Transporte wäre dann in jedem Fall das Bundeswehrzentralkrankenhaus Koblenz, da dort alle erforderlichen Fachabteilungen sowie das entsprechende Know-how für die weitere intensivmedizinische Betreuung vorhanden sind. Primär wäre dabei die Implantationstechnik und der Umgang mit den erforderlichen Geräten zu schulen, was angesichts der eigentlich standardisierten Technik (Seldinger-Punktion, hämodynamisches Monitoring) realisierbar erscheint.
Ein Einsatz der Technik im Einsatzland bei der Versorgung schwerer thorakalen Verletzungen hingegen wird zum gegenwärtigen Zeitpunkt als nicht realisierbar beurteilt. Zum Ersten muss davon ausgegangen werden, dass bei einer entsprechenden Gefechtsintensität es zu einem MASCAL-Ereignis kommt, wodurch derart aufwändige Verfahren für Individualpatienten nicht anwendbar sind. Zum Zweiten wäre aber auch die Anwesenheit entsprechend geschulten Personals und des Equipments erforderlich - zwei Voraussetzungen, die vielleicht in der ferneren Zukunft erfüllt werden könnten, in absehbarer Zeit allerdings sicher nicht gegeben sein werden.
Der Einsatz solch invasiver Verfahren setzt naturgemäß eine gute Indikationsstellung voraus. Patienten, die mit an Sicherheit grenzender Wahrscheinlichkeit ohne ECMO repatriiert werden können, würde sicher niemand mit einem solchen Gerät versorgen wollen. Umgekehrt ist aber die zu erwartende Komplikationsrate bei dem zu therapierenden Patientenkollektiv als gering einzustufen, so dass bei Zweifeln an der kardiopulmonalen Stabilität durch die Versorgung mit einem ECLS die zügige Repatriierung und damit die optimale intensivmedizinische Betreuung gewährleistet werden kann. Der von den US-Streitkräften initial publizierte Fall und die daraus resultierende Kooperation mit der Universität Regensburg haben zu einem festen ECMO-Team der US-Amerikaner geführt, die angesichts der Möglichkeiten der Systeme auf diese Technik zur Rettung pulmonal schwer kompromittierter Patienten nicht mehr verzichten möchten.
Literatur
- Allan PF et al.: The introduction of extracorporeal membrane oxygenation to aeromedical evacuation. Mil Med. 2011; 176: 932 – 937.
- Bein T et al.: Transportable extracorporeal lung support for rescue of severe respiratory failure in combat casualities. J Trauma Acute Care Surg. 2012; 73: 1450 – 1456.
- Casas F et al.: Performance and reliability of the CPB/ECMO Initiative forward lines casuality management system. ASAIO J. 2005; 51: 681 – 685.
- Fang R et al.: Closing the „care in the air“ capability gap for severe lung injury: the Landstuhl Acute Lung Rescue Team and extracorporeal lung support. The Journal of Trauma 2011; 71 (1): S91 – S 97.
- Guirand DM et al.: Venovenous extracorporeal life support improves survival in adult trauma patients with acute hypoxemic respiratory failure: a multicenter retrospective. J Trauma Acute Care Surg. 2014; 76(5): 1275 – 1281.
- Klaergaard B et al.: Aero-medical evacuation with interventional lung assist in lung failure patients. Resuscitation 2007; 72: 280 – 285.
Abbildungsnachweis:
Mit freundlicher Genehmigung von Dr. Björn Sill, Herzzentrum des Universitätsklinikums Eppendorf, Hamburg
Für die Verfasser:
Oberstabsarzt Priv.-Doz. Dr. Helmut Gulbins
Bundeswehrkrankenhaus Hamburg
Klinik für Orthopädie und Unfallchirurgie
Lesserstr. 110, 22049 Hamburg
E-Mail: [email protected]
[1] StratAirMedEvac = Strategic Aeromedical Evacuation; Langstreckentransport von Verletzten/Erkrankten vom Einsatzland in eine sanitätsdienstliche Versorgungseinrichtung der Role 4, in der Regel ins Heimatland
[2] ILA = intervetional lung assist; extrakorporales Oxygenierungssystem zur Unterstützung der Lungenfunktion
Datum: 10.07.2018