Drei Laborgruppen mit einem Ziel – Sichere Arzneimittel und Medizinprodukte
F. Plößl, R. Bogan, S. Röhl, H.-J. Maas
Die Abteilung C Pharmazie des Zentralen Institutes der Bundeswehr München ist seit 2004 die zentrale Arzneimittel- und Medizinprodukteuntersuchungsstelle der Bundeswehr. Als vergleichbares Labor der Bundeswehr ist die Abteilung wie die korrespondierenden Einrichtungen der Bundesländer Mitglied im europäischen Netzwerk der offiziellen Arzneimittelkontrolllaboratorien (General European Official Medicines Control Laboratory Network). Sie umfasst die drei Laborgruppen Arzneimitteluntersuchung, Pharmazeutische Forschung und Entwicklung sowie Medizinprodukteuntersuchung.
Der Anteil Arzneimitteluntersuchung ist durch die Deutsche Akkreditierungsstelle GmbH nach der DIN EN ISO/IEC 17025 akkreditiert und der Bereich Medizinprodukteuntersuchung durch die Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten anerkannt. Die Laborgruppe Pharmazeutische Forschung und Entwicklung ist beauftragte Einrichtung nach § 14 Abs. 4 Arzneimittelgesetz (AMG) für die pharmazeutische Herstellungsstätte der Bundeswehr am Bundewehrkrankenhaus (BwKrhs) Ulm.
Neben der breitgefächerten Arbeit im Rahmen der Überwachung des Verkehrs mit Arzneimitteln und Medizinprodukten in der Bundeswehr, z. B. im Auftrag des Arzneimittelüberwachungsbeauftragten der Bundeswehr, werden auch Proben aus Einsatzvorräten oder beispielsweise Angebotsmuster der Industrie im Auftrag des Bundesamtes für Ausrüstung, Informationstechnik und Nutzung der Bundeswehr untersucht und bewertet.
Im Folgenden sollen beispielhaft Schwerpunkte der Tätigkeit aus den Bereichen Pharmazeutische Forschung und Entwicklung und Medizinprodukteuntersuchung vorgestellt werden.

den Vermerk XX.XXXX
Stabilitätsuntersuchungen bei Autoinjektoren – neue Herangehensweise in der Auswertung
Die Laborgruppe Pharmazeutische Forschung und Entwicklung ist zentraler analytischer Dienstleister für Stabilitätsprüfungen und analytische Methodenentwicklung und somit Bindeglied zwischen den pharmazeutischen Herstellungsstätten und der Arzneimitteluntersuchung.
Die Laborgruppe begleitet dabei das Arzneimittel von einer frühen Entwicklungsphase beginnend bis hin zum Verfalldatum. Im Auftrag der Qualitätskontrolle der BwKrhs werden spezialisierte Untersuchungen zentral durchgeführt, die aufgrund der erforderlichen apparativen Ausstattung nicht in der Fläche verfügbar sind. In der frühen Entwicklung eines Arzneimittels und bei der Beurteilung von Packmitteln sowie deren Wechselwirkung mit dem Medikament selbst liefern Untersuchungen der Laborgruppe zudem wichtige Beiträge.
Grundsätzlich sind Arzneimittel mit der Angabe eines Zeitraums der Verwendbarkeit zu versehen, währenddessen der Hersteller die Qualität, Wirksamkeit und Unbedenklichkeit verantwortet. Für den Geschäftsbereich des Bundesministeriums der Verteidigung (BMVg) sind dabei parenterale Medikamente von besonderer Bedeutung, die im Rahmen der Eigenherstellung nach § 13 AMG bzw. in Form von besonderen Defekturen mit erweitertem Versorgungsbereich, z. B. in den Einsätzen und Missionen der Bundeswehr, in Verkehr gebracht werden. Hierzu zählen die klassischen atropinhaltigen Antidote ebenso wie die sterilen Flüssigarzneimittel Chinin, Ribavirin, Naloxon und hyperosmolare Natriumchloridlösung.
Zur Ableitung des Verwendbarkeitszeitraums werden diese Produkte aus der Eigenherstellung Stabilitätsprüfungen durch die Laborgruppe Forschung und Entwicklung nach international harmonisierten Vorgaben unterzogen.
Zunächst wird hier das Arzneimittel gezielt besonderen Stressoren (Hitze, Oxidationsmittel, pH-Wert-Verschiebungen) ausgesetzt, um Abbauprodukte zu erzeugen, die über den regulären Verwendbarkeitszeitraum entstehen könnten. Im Anschluss werden bei unterschiedlichen Normklimata, die sich in Luftfeuchtigkeit und Temperatur unterscheiden und sich an den Klimazonen der Erde orientieren, mehrere Chargen des Arzneimittels über einen Prüfzeitraum von bis zu fünf Jahren eingelagert und kontinuierlich auf Veränderungen des Wirkstoffgehaltes, Anzahl und Konzentration von möglicherweise toxischen Abbauprodukten und anderen chemisch-physikalischen Parametern untersucht. Aus den umfangreichen Datensätzen wird mit Hilfe statistischer Methoden wie einer Kovarianzanalyse (ANCOVA) geprüft, ob die Datensätze für die Auswertung zu vereinen sind und damit die Ergebnissicherheit erhöht werden kann. Die Verwendbarkeit des Arzneimittels wird dann in Hinblick auf die Qualität und Wirksamkeit als auch der toxikologischen Unbedenklichkeit für künftige Herstellungen festgelegt.
Für auf dem zivilen Markt erworbene Medikamente (z. B. Autoinjektoren, andere A- und C-Antidote) ohne aufgedrucktes Verfalldatum muss das BMVg die Qualität, Wirksamkeit und Unbedenklichkeit während der Nutzung gewährleisten und stützt sich dabei u. a. auf die Untersuchungsergebnisse und deren Bewertung der Abteilung C. Mit Hilfe der für Arzneimittel aus eigener Produktion entwickelten statistischen Ableitungen können auch diese langzeitgelagerten Arzneimittel während ihrer Nutzung bewertet und ein voraussichtliches Nutzungsende errechnet werden.
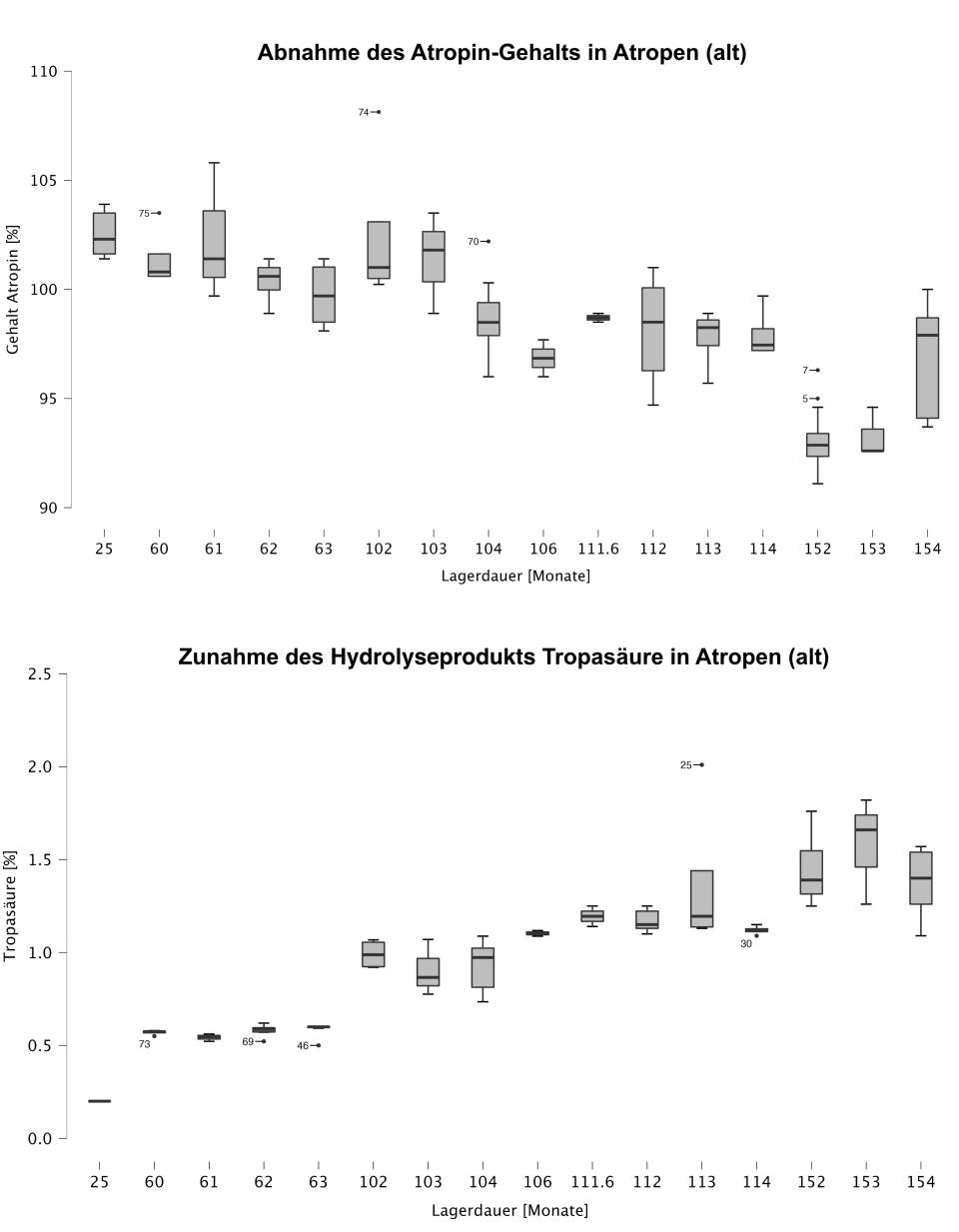
So zeigte sich am Beispiel des Atropin-Autoinjektors Atropen® bei der früher üblichen Verwendung von Edelstahlkarpulen als Packmittel eine signifikant kürzere Laufzeit als in den später verwendeten Karpulen aus Kunststoff. Grund hierfür ist der raschere Abbau des Atropins und die damit verbundene beschleunigte Bildung toxischer Abbauprodukte, weshalb sich Edelstahl als Packmittel nicht durchsetzen konnte.
Die bislang und teilweise über mehrere Jahrzehnte erhobenen Daten, z. B. aus der Untersuchung langzeitgelagerter Autoinjektoren, ermöglichen heute eine hocheffiziente Analytik mit geringerem Stichprobenumfang, die Ableitung einer Zersetzungskinetik der Inhaltsstoffe sowie eine entsprechende Information an die für die Nutzung verantwortlichen Stellen zur Einleitung weiterer Maßnahmen.
Wie andere Artikel im vorliegenden Heft verdeutlichen, entwickelt und verändert sich das Portfolio der Eigenherstellung pharmazeutischer Produkte derzeit sprunghaft. Mit dem Ziel, Autoinjektoren aus der Eigenherstellung mit einer eigenen Zulassung in Verkehr zu bringen, wird eine erhebliche Erweiterung des Untersuchungsumfangs mit einem Anstieg der einzulagernden Muster und damit einhergehendem Platzbedarf sowie eine Steigerung der Anforderungen an die Analytik in naher Zukunft notwendig werden.
Untersuchung von Corona-Schutzmasken – sichere (Medizin-)Produkte in der Pandemie
Die Qualität der in der Coronapandemie genutzten Schutzmasken stand in hohem Maße im Fokus des öffentlichen Interesses und des staatlichen Handelns. Aufgrund eines damit klar erkennbaren Bedarfes wurde die Methodik zur Untersuchung von Corona-Schutzmasken in der Laborgruppe Medizinprodukteuntersuchung etabliert. Ziel war dabei nicht die routinemäßige Kontrolle der Normkonformität der Masken, sondern die Überprüfung der Eignung als Corona-Schutzmaske. Die Fokussierung auf die hierfür relevanten Parameter (Filterleistung und Atemwiderstand) ermöglichte die zeitnahe Untersuchung großer Probemengen und damit die Bereitstellung fachlicher Grundlagen für schnelle Entscheidungen im Rahmen von Beschaffung und Überwachung.
Abgesehen von den aufgrund der zu Beginn der Pandemie bestehenden Mangelsituation genutzten sogenannten Alltagsmasken, sind unter dem Begriff Corona-Schutzmaske zwei verschiedene Maskentypen subsummiert: Medizinische Gesichtsmasken nach DIN EN 14683 (auch genannt Mund-Nasen-Schutz) und Filtrierende Halbmasken nach DIN EN 149 (auch genannt FFP2). Im Zuge der Pandemie wurde im Infektionsschutzgesetz für Medizinische Gesichtsmasken die Bezeichnung Corona-Pandemie-Infektionsschutzmaske (CPI), für Filtrierende Halbmasken die Bezeichnung Corona-Pandemie-Atemschutzmaske (CPA) eingeführt.
Medizinische Gesichtsmasken sind Medizinprodukte der Klasse I und dienen dazu, die „Übertragung infektiöser Keime vom Personal auf Patienten während chirurgischer Eingriffe und sonstiger medizinischer Situationen mit ähnlichen Anforderungen zu begrenzen“. Im Hinblick auf einen damit bestehenden Fremdschutz wird auch ein Tragen „zur Verminderung des Risikos einer Verbreitung von Infektionen [...], insbesondere in epidemischen oder pandemischen Situationen“ in der DIN EN 14683 erwähnt. Sie schützen vor allem das Gegenüber vor abgegebenen potenziell infektiösen Tröpfchen. Filtrierende Halbmasken sind per se Persönliche Schutzausstattungen und schützen den Träger vor festen und flüssigen Aerosolen. Eine fachliche Zuständigkeit im Bereich der Medizinprodukteuntersuchung ergibt sich hier aus der medizinischen Zweckbestimmung eines Infektionsschutzes. Das Medizinprodukte-EU-Anpassungsgesetz gilt auch für Produkte, „die nicht als Medizinprodukte in Verkehr gebracht wurden, aber mit der Zweckbestimmung eines Medizinproduktes [...] angewendet werden.“
Für beide Maskentypen wurden dabei auf den Einsatzzweck ausgerichtete, verkürzte Prüfverfahren veröffentlicht: durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) der „Prüfgrundsatz für Corona SARS-CoV-2 Pandemie – medizinische Gesichtsmasken Rev. 0“ vom 14.04.2020 und durch die Zentralstelle der Länder für Sicherheitstechnik (ZLS) der „Prüfgrundsatz für Corona SARS-CoV-2 Pandemie Atemschutzmasken Rev. 2“ vom 02.06.2020. Wenngleich hiermit zwei grundsätzlich unterschiedliche Maskentypen erfasst sind, gehen beide Prüfgrundsätze aufgrund derselben Zweckbestimmung, nämlich des Infektionsschutzes hier im Sinne eines Eigenschutzes, methodisch gleich vor (Bestimmung des Atemwiderstandes nach DIN EN 149 und Bestimmung der Filterleistung nach DIN EN 149 in Verbindung mit DIN EN 13274–7). Die Prüfung nach DIN EN 149 in Verbindung mit der DIN EN 13274–7 verwendet ein natriumchloridhaltiges Prüfaerosol mit einem Medianwert der Partikelgrößenverteilung von 0,06–0,10 µm, welche innerhalb der damit hinterlegten Streuung den für SARS-CoV-2 relevanten Größenbereich von ca. 0,15 µm somit einschließt.
Die für Medizinische Gesichtsmasken normkonforme Prüfung nach DIN EN 14683 schreibt im Gegensatz dazu ein Staphylococcus aureus-haltiges Prüfaerosol von 3,0 ± 0,3 µm vor. Insofern ist festzustellen, dass diese Prüfung der Filterleistung von Medizinischen Gesichtsmasken nach DIN EN 14683 aufgrund der Partikelgröße keine Aussage zur Eignung als Corona-Pandemie-Schutzmaske liefert.
Die Untersuchungen zeigten, dass bei Medizinischen Gesichtsmasken der Atemwiderstand weitgehend spezifikationskonform, die Filterleistung im Sinne eines Eigenschutzes mit einer Beanstandungsquote von 90 % hingegen zunächst als ungenügend einzustufen ist. Sie erfüllen also größtenteils nicht die Anforderungen an eine Corona-Schutzmaske. Aufgrund der unmittelbar vor Mund und Nase noch sehr hohen Partikelgröße darf jedoch von einer Wirksamkeit im Sinne eines Fremdschutzes ausgegangen werden. Dieser Fremdschutz entspricht zudem der normativen Zweckbestimmung dieses Maskentyps. Bei diesen Masken bedeutet ein Nichterfüllen der Anforderungen des BfArM-Prüfgrundsatzes keinesfalls eine Nonkonformität zur DIN EN 14683 und lässt damit keine Aussage zur grundsätzlichen Verkehrsfähigkeit zu. Vergleichende Untersuchungen des Bayerischen Landesamtes für Lebensmittel und Gesundheitsschutz belegen diesen Sachverhalt. Auch zeigt sich, dass bei einer normgerechten Prüfung nicht die Filterleistung, sondern der ebenfalls in der Laborgruppe geprüfte Atemwiderstand den kritischen Parameter darstellt.
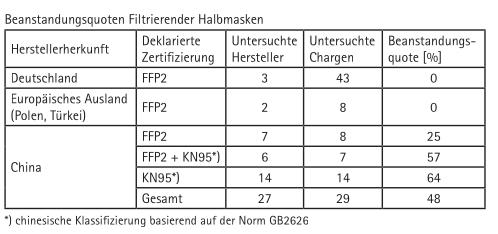
Bei Filtrierenden Halbmasken ergaben sich beim Atemwiderstand nur singuläre Spezifikationsüberschreitungen. Diese beschränkten sich zudem auf die Ausatmung und befanden sich im Grenzbereich der Spezifikation, so dass sie in der Gesamtschau zu vernachlässigen sind. Die Filterleistung führte hingegen zu den in der Tabelle dargestellten Beanstandungsquoten. Hierbei ist ein deutlicher Zusammenhang zur Herkunft der Masken festzustellen.
Der ZLS-Prüfgrundsatz entspricht bei filtrierenden Halbmasken den Anforderungen der DIN EN 149 in Bezug auf Atemwiderstand und Filterleistung, wodurch aus der Nichterfüllung der hierin festgelegten Spezifikationen, durchaus ein Rückschluss auf die Normenkonformität gezogen werden kann.
Zusammenfassend ergeben sich folgende Schlussfolgerungen: Für die Beurteilung von Medizinischen Gesichtsmasken als Corona-Pandemie-Schutzmasken ist die Anwendung der im BfArM-Prüfgrundsatz hinterlegten DIN EN 149 unumgänglich. Ein Nichterfüllen der Filtereffizienz schließt eine Wirksamkeit im Sinne des Fremdschutzes aber nicht aus und bedeutet keinesfalls eine Nonkonformität zur DIN EN 14683. Bei einer Überprüfung der Normkonformität Medizinscher Gesichtsmasken stellt der Atemwiderstand den kritischen Parameter dar.
Bei einer risikoorientierten Marktüberwachung von Filtrierenden Halbmasken wird eine Untersuchung von Masken chinesischer Herkunft weiterhin dringend empfohlen.
Wehrmedizin und Wehrpharmazie 1/2023
Oberfeldapotheker Dr. F. Plößl
Zentrales Institut des Sanitätsdienstes der Bundeswehr München
Ingolstädter Landstraße 102, 85748 Garching
E-Mail: [email protected]