War es Gift? - Der diagnostische Nachweis von biologischen Toxinen
Aus dem Kompetenzbereich „Bakterien und Toxine“ (Leiter: Oberfeldveterinär Dr. H. von Buttlar) des Instituts für Mikrobiologie der Bundeswehr (Institutsleiter: Oberstarzt Prof. Dr. L. Zöller)
Die Liste der biologischen Agenzien, die als Kampfstoff missbraucht werden können, umfasst neben Bakterien und Viren auch biologische Toxine. Dabei handelt es sich um Giftstoffe, die von einem biologischen Organismus produziert werden. Bekannte Vertreter dieser Gruppe sind u. a. die Toxine Rizin und Abrin, die in Pflanzen ihren Ursprung haben oder das Mykotoxin T2, das von Schimmelpilzen produziert wird, oder die Botulinum-Neurotoxine (BoNT), die von Bakterien in die Umgebung abgegeben werden. Die einfache Produktion durch natürlich vorkommende Organismen macht die Herstellung der biologischen Toxine vergleichsweise einfach, da der Anbau der Pflanzen oder die Kultivierung der Bakterien oder Pilze oftmals gut etabliert sind. Die Aufreinigung des Toxins stellt dann den letzten Schritt des Produktionsprozesses dar, der in den meisten Fällen auch mit begrenzten Mittel gut durchführbar ist. Die Lagerung und Ausbringung ist oftmals mit einfacheren Mitteln möglich, als es bei Viren und den meisten Bakterien der Fall ist.
Somit sind die biologischen Toxine nicht nur in staatlichen Biowaffenprogrammen, wie z. B. dem des Irak unter Saddam Hussein, bearbeitet worden, sondern werden auch immer wieder in der terroristischen Szene als Anschlagsmittel betrachtet. Hier seien als Beispiel aus den letzten Jahren Rizin-haltige Briefe genannt, die an den amerikanischen Präsidenten Obama verschickt wurden. In Europa, unter anderem auch in Köln, wurden mehrfach Täter aus dem islamistischen Spektrum aufgegriffen, die versuchten, Rizin herzustellen. Diese Beispiele zeigen, wie real die Bedrohung im Zusammenhang mit diesen Agenzien ist.

Aktuelle Entwicklungen in der Toxindiagnostik am Institut für Mikrobiologie der Bundeswehr (IMB) beruhen deshalb zum einen auf dem immunologischen Nachweis des Toxins, z. B. mittels ELISA, oder auf dem Nachweis seiner Funktion oder auf einer Kombination aus beiden.
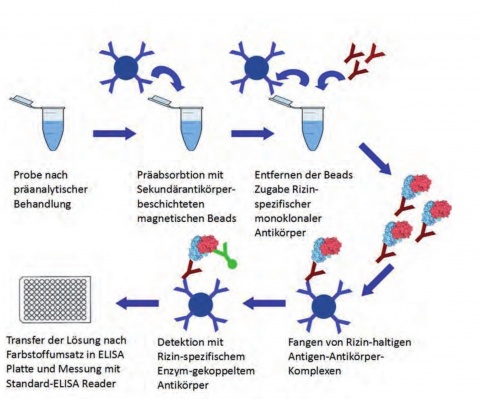
Als Beispiel für den immunologischen Nachweis ist hier die Detektion von Rizin mittels On-Bead-ELISA dargestellt Hier wird der Analyt Rizin mit monoklonalen Antikörpern, die an magnetische Partikel gebunden sind, aus der Probenmatrix angereichert. Anschließend erfolgt der Nachweis des Rizins durch Bindung an einen zweiten, Enzym-gekoppelten Antikörper und den Nachweis des Substratumsatzes durch das Enzym. So wird eine hohe Sensitivität und Robustheit gegenüber Matrixeffekten des Testsystems gewährleistet. Mit diesem System kann Rizin nicht nur in klinischem Probenmaterial, wie z. B. Plasma, nachgewiesen werden, sondern auch komplexe Matrices wie Nahrungsmittel-, Stuhl- oder Umgebungsproben können untersucht werden. Darüber hinaus wurde das System so konzipiert, dass es mit Standard-Laborequipment durchgeführt werden kann. Neben einem Magnetstand und Pipetten wird nur ein ELISA-Reader benötigt. Dies macht den Einsatz in nicht speziell ausgerüsteten Laboren und vor allem auch in mobilen Laboreinrichtungen, wie sie z. B. im Rahmen der mobilen B-Aufklärung genutzt werden, möglich.
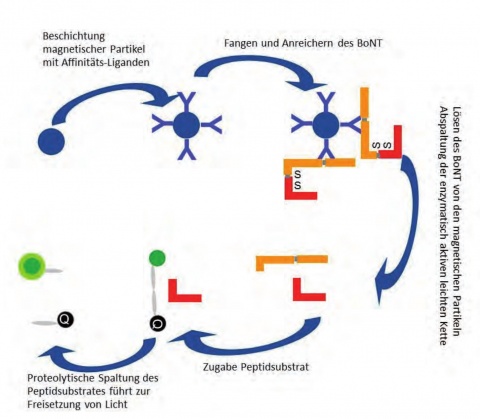
Fazit: Biologische Toxine sind mit einem hohen Risiko assoziiert, sowohl im Rahmen internationaler Konflikte als auch aus dem terroristischen Spektrum heraus als biologische Kampfstoffe eingesetzt zu werden. Ihr schneller, spezifischer und sensitiver Nachweis ist daher von hoher wehrmedizinischer Relevanz. Am Institut für Mikrobiologie der Bundeswehr wird darüber hinaus großer Wert auf die Entwicklung von Methoden gelegt, die mit einfachem Laborequipment durchführbar sind, um auch einen feldtauglichen Einsatz in mobilen Laborinfrastrukturen gewährleisten zu können.
Verfasser:
Oberfeldveterinär Dr. med. vet. Heiner von Buttlar
Institut für Mikrobiologie der Bundeswehr
Neuherbergstrasse 11
80937 München
E-Mail: [email protected]
Datum: 28.10.2019
Quelle: Wehrmedizin und Wehrpharmazie 3/2019