WISSENSCHAFTSBASIERTE DIAGNOSTISCHE DIENSTLEISTUNGEN IM MEDIZINISCHEN B-SCHUTZ AM INSTITUT FÜR MIKROBIOLOGIE DER BUNDESWEHR
Science-Based Services in Medical Biological Defence Provided by the Bundeswehr Institute of Microbiology
Aus dem Institut für Mikrobiologie der Bundeswehr, München (Leiter: Oberstarzt Prof. Dr. L. Zöller)
Sabine Schmoldt und Lothar Zöller
Der schnelle und verlässliche Nachweis von B-Gesundheitsstörungen beim Menschen ist eine der Hauptaufgaben des Instituts für Mikrobiologie der Bundeswehr.
In dem zu diesem Zweck 2009 neu gegründeten Zentralbereich für Diagnostik beruht die Diagnostik auf Verfahren, die den Anforderungen europäischer und nationaler Richtlinien für die humanmedizinische Laboratoriumsdiagnostik entsprechen.Eine Reihe von Methoden zum Nachweis biologischer Agenzien oder der Immunantwort des Wirts wurden auf höchstem wissenschaftlichem Niveau entwickelt, nach den Vorgaben validiert und in Diagnostikalgorithmen umgesetzt. Der Beitrag gibt einen Einblick in die am Institut vorhandenen diagnostischen Fähigkeiten.
Summary
Fast and reliable identification of biological agents and diagnostics of related health disorders is one of the main tasks of the Bundeswehr Institute of Microbiology. The institutes newly established Central Diagnostic Laboratory Division provides a broad array of validated in-house methods for algorithmbased serological, cultural and molecular diagnosis at the highest confidence level and according to national and international guidelines.
Einleitung
Das Institut für Mikrobiologie der Bundeswehr in München ist das Kompetenzzentrum der Bundeswehr für den Medizinischen B-Schutz. Als Ressortforschungseinrichtung befasst es sich wissenschaftlich mit einer Vielzahl von Krankheitserregern und Biogiften, die potenziell als biologische Kampfstoffe eingesetzt werden können. Ein Schwerpunkt ist die Entwicklung diagnostischer Verfahren zum Nachweis von Gesundheitsstörungen durch biologische Kampfstoffe und zur Aufklärung unklarer Krankheitsausbrüche speziell im Hinblick auf deren unbeabsichtigte oder vorsätzliche Freisetzung. Zu den infrage kommenden Verursachern gehören zahlreiche Bakterien wie zum Beispiel Bacillus anthracis (Anthrax), Yersinia pestis (Pest) oder Francisella tularensis (Tularämie), Viren wie Orthopockenviren (Variolavirus: Menschenpocken) oder hämorrhagische Fieber- Viren, aber auch Biogifte wie Botulinumtoxine. Bei den durch diese Agenzien ausgelösten Krankheiten handelt es sich in aller Regel um in der Natur selten vorkommende, schwere, zum Teil tödlich verlaufende und teilweise von Mensch zu Mensch übertragbare Krankheiten oder um Intoxikationen. Sie zweifelfrei zu diagnostizieren und damit eine möglichst rasche Behandlung zu ermöglichen, ist eines der Ziele der Forschung und Entwicklung im Medizinischen B-Schutz.
Das diagnostische Konzept
Die vorsätzliche Freisetzung eines biologischen Kampfstoffes würde sich zunächst wahrscheinlich als eine ungewöhnliche Häufung von Krankheitsfällen zeigen, die von einem natürlichen Vorkommen abgegrenzt werden müssten. Ein vorrangiges Ziel erster Handlungen bei einem unklaren Krankheitsausbruch ist die schnelle Diagnose, um eine rasche, frühzeitige Behandlung zu ermöglichen und die Ausbreitung einer Krankheit zum Beispiel durch Absonderungsmaßnahmen, Impfungen oder Chemoprophylaxe zu verhindern. Dies trifft gleichermaßen auch im Falle eines biologischen Angriffs zu. Hier ist außerdem aus sicherheitspolitischen Gründen eine zweifelsfreie Identifizierung des ursächlichen biologischen Kampfstoffes essenziell.
Abb 1: Echtzeit-PCR auf Orthopockenviren mit Schmelzkurvenanalyse: Während der Schmelzpunkt für die meisten Orthopockenviren um 65°C liegt, weist ein deutlich niedrigerer Schmelzpunkt auf das Vorliegen von Variolavirus (Erreger der in der Natur als ausgerottet geltenden Menschenpocken) hin.
Richtlinien für die Durchführung laboratoriumsmedizinischer Untersuchungen
Die europäische In-vitro-Diagnostika- Richtlinie (1, 2) stellt ebenso wie die Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (3, 4) hohe Anforderungen an die laboratoriumsmedizinische Diagnostik. Neben anderen Vorgaben sind danach folgende Forderungen zu erfüllen:
Alle Methoden und Verfahren müssen in ein Qualitätsmanagement eingebettet sein. Vor der ersten Verwendung sind sie einer umfangreichen Validation zu unterziehen und kontinuierlich intern und extern zu überwachen. Zur Validation eines Testverfahrens gehört die Evaluation der Leistungsfähigkeit, Richtigkeit, Präzision und Linearität der erzeugten Ergebnisse. Die interne Qualitätssicherung umfasst neben der Austestung der Haltbarkeit von Testkit-Bestandteilen und Reagenzien auch die Bereitstellung von Referenzmaterial für In-Prozess-Kontrollen. Für kommerziell verfügbare In-vitro-Diagnostika erfolgen die Validation und Überwachung durch den Testhersteller und dies wird durch die CE-Markierung ausgewiesen. Für In-house-Methoden muss dies der Anwender durchführen. Aufgrund des seltenen Vorkommens potenzieller biologischer Kampfstoffe in der Natur, stehen zu deren Nachweis jedoch kaum kommerzielle Testverfahren zur Verfügung. In der Diagnostik des medizinischen B-Schutzes müssen die Anbieter daher die Validation der Testverfahren und deren Überwachung selbst übernehmen. Zusätzlich muss eine externe Qualitätssicherung durch die regelmäßige Teilnahme an Ringversuchen gewährleistet werden, bei denen Probenmaterialien von unabhängigen Stellen versandt und die Untersuchungsergebnisse bewertet werden. Je nach Parameter schreiben die Richtlinien eine Teilnahme an Ringversuchen, mindestens ein bis zweimal jährlich, vor.
Abb 2: Gezielte Untersuchungen auf Erreger der Risikogruppe 3 werden in einem Labor der Schutzstufe BSL-3 durchgeführt.
Aufgaben und Dienstleistungen des neuen Zentralbereichs für Diagnostik
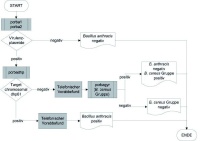
In den Forschungsabteilungen des Instituts wurden Verfahren zum direkten Erregernachweis durch Identifizierung des Genoms (Abb 1) und Anzüchtung in vitro (Abb 2) sowie zur Antikörperbestimmung (Serodiagnostik von B-Gesundheitsstörungen) entwickelt und nach den eingangs genannten Richtlinien der EU und der Bundesärztekammer umfangreich validiert. Für jeden Erreger wurden komplexe Untersuchungsalgorithmen durch Hintereinanderschaltung verschiedener Tests erarbeitet, um eine diagnostische Aussage zu erzielen. Diese ermöglichen mit hoher Sensitivität und Spezifität eine Aussage über das Vorhandensein des untersuchten Parameters im Untersuchungsmaterial. In Abbildung 3 ist ein solcher Algorithmus am Beispiel der molekularbiologischen Diagnostik von Anthrax dargestellt. Insgesamt wurden in den letzten drei Jahren 112 Testverfahren für 29 biologische Agenzien entwickelt und diese in mehr als 600 Qualitätsmanagement- Dokumenten abgebildet. Um die Anforderungen der Richtlinien zu erfüllen, wurden die Testverfahren in ein Qualitätsmanagement eingebettet und in eine zentrale Diagnostikabteilung, den Zentralbereich Diagnostik (ZBD), transferiert. Diesem neu gegründeten Bereich wurden ein fester Mitarbeiterpool, definierte Räumlichkeiten und Material zugewiesen. Ein Analysenverzeichnis mit Hinweisen zur Probennahme und zum Transport und ein Materialbegleitschein wurden erstellt (Abb 4). Bei jeder eingehenden Probe werden die klinischen Daten erfasst, eine Gefährdungsbeurteilung erstellt und die Testverfahren unter der jeweils adäquaten biologischen Schutzstufe (BSL 2 oder BSL 3) durchgeführt (Abb 2).
Abb 3: Beispiel für einen komplexen Untersuchungsalgorithmus für die molekularbiologische Diagnostik von Bacillus anthracis: Nach einem ersten Suchtest auf die zwei Bacillus-spezifischen Virulenzplasmide folgt, bei positivem Ergebnis, eine weitere Differenzierung zur Bestätigung von Bacillus anthracis.
Abb 4: Leistungsverzeichnis mit Hinweisen zur Probennahme und zum Transport und Materialbegleitschein des Zentralbereichs Diagnostik am Institut für Mikrobiologie der Bundeswehr.
Alle Untersuchungsaufträge und die Analysenergebnisse werden in einem Labor-DV-System erfasst, in dem am Ende ein Befund erstellt wird. Die Beurteilung der Befunde erfolgt unter Berücksichtigung der klinischen Daten. Die interne Qualitätssicherung erfolgt durch In-Prozess-Kontrollen mit in den Forschungsabteilungen definiertem Referenzmaterial. Zusätzlich erfolgt die Überwachung der Funktionsfähigkeit von Test-Kitbestandteilen und Reagenzien durch mindestens monatliche Funktionsprüfung und durch die Erstellung von Statistiken anhand von Qualitätskontrollkarten. Die externe Qualitätskontrolle erfolgt für jeden Parameter national und international in militärischen und zivilen Diagnostik- und Forschungsverbünden, insbesondere durch die regelmäßige Teilnahme an Ringversuchen. Dabei werden Probenmaterialien von unabhängigen Stellen versandt und die Untersuchungsergebnisse bewertet. Diese Entwicklungsarbeit ermöglicht es jetzt, eine breite Palette Richtlinien-konformer In-vitro-Diagnostika für die medizinische B-Aufklärung vorzuhalten. Die Tests werden durch den ZBD des Instituts allen Bedarfsträgern im Sanitätsdienst angeboten.
Literatur:
- Directive 98/79/EC of the European Parliament and of the Council of 27 October 1998 on in vitro diagnostic medical devices. Official J Eur Commun 1998; L331: 1-37.
- Commision Decision of May 2002 on common technical specifications for in vitro-diagnostic medical devices. Official J Eur Commun 2002; L131: 17-30.
- Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen. Dtsch Ärztebl 2008; 105(7); A341-55 .
- Ergänzungen zur Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen. Dtsch Ärztebl 2011; 108(30); A1647-51.
Datum: 24.08.2012
Quelle: Wehrmedizinische Monatsschrift 2012/4