„SCHNELLER DER TULARÄMIE AUF DER SPUR“: FELDTESTS ZUM ANTIKÖRPERNACHWEIS GEGEN FRANCISELLA TULARENSIS
"Fast Track to Tularemia": Field Tests for the Detection of Antibodies against Francisella tularensis
Aus dem Konsiliarlaboratorium für Tularämie am Institut für Mikrobiologie der Bundeswehr (Leiter: Oberstarzt Prof. Dr. L. Zöller)
Marion Götz, Margot Ehrle und Wolf Splettstößer
In den letzten Jahren traten größere Tularämieausbrüche häufig in Ländern oder Regionen auf, in denen es nur eine eingeschränkte moderne Laborinfrastruktur gibt beziehungsweise in denen keine kommerziellen In-vitro-Diagnostika für die Tularämie erhältlich sind (Türkei, Kroatien, Kosovo). Unter diesen Bedingungen wäre die Anwendung einfacher und zuverlässiger Schnelltests, die ohne oder nur mit minimalem technischem Aufwand durchgeführt werden können, sowohl für die individuelle Diagnostik als auch im Rahmen von epidemiologischen Ausbruchsuntersuchungen sehr hilfreich.
Ziel dieser Arbeiten war die Bereitstellung eines Schnelltests, der innerhalb von 15 min spezifische Antikörper sowohl beim Menschen als auch bei verschiedenen Tierspezies mit hoher Sensitivität und Spezifität nachweisen kann.
Methoden:
Der neu entwickelte Immunchromatographie- Test (ICT) beruht auf dem „Lateral Flow-Prinzip“, bei dem im Serum vorhandene Antikörper an antigenbeschichtete Nitrocellulose- Membranen gebunden und durch ein Gold-Protein A-Konjugat detektiert werden. Dieser Schnelltest wurde anhand von 208 Se - rumproben und 11 Antikörper-Präparationen vom Menschen und von fünf Tierspezies evaluiert. Alle Proben wurden parallel mittels Mikroagglutinationstest, ELISA und Schnelltest untersucht.
Ergebnisse:
Mit Hilfe des neu entwickelten ICT wurden spezifische anti-F. tularensis-LPS-Antikörper in verschiedenen Serumverdünnungen vom Menschen, zwei Makakenspezies, Schweinen, Kaninchen und Mäusen innerhalb von 15 min nachgewiesen. Insgesamt zeigte dieser Assay damit eine Testperformance, die mit Routineverfahren (ELISA, Western Blot) vergleichbar war.
Schlussfolgerungen:
Die Durchführung serologischer Untersuchungen mittels feldtauglicher Schnelltests kann im Rahmen von Auslandeinsätzen oder in Ländern mit begrenzten Ressourcen eine wichtige, oftmals die einzige, Alternative zu klassischen Labormethoden in der Diagnostik gefährlicher Infektionskrankheiten darstellen.
Summary Background:
Recently, large outbreaks of tularemia occurred in countries or regions in which modern laboratory infrastructure was lacking or where suitable and licensed in vitro diagnostics for tularemia were not easily available (Turkey, Croatia, Kosovo region). Under these conditions, the application of simple and reliable rapid tests, which would need no or only minimal technical instrumentation, would be very helpful in diagnosing individual cases of human tularemia as well as for epidemiological outbreak investigations. Aim of this study was the development of a rapid assay (ICT), which can detect specific antibodies in humans as well as different animal species within 15 min.
Methods:
The developed test is based on the “lateral flow principle” in which diluted serum samples are applied to nitrocellulose membranes. The rapid test was validated using 208 serum references samples and 11 antibody preparations from humans as well as five animal species. All samples were tested in parallel employing micro-agglutination, ELISA and the new rapid test.
Results:
Using the new ICT, specific antibo - dies directed against F. tularensis LPS were detected in diluted serum samples from humans, two macaque species, pigs, rabbits and mice within 15 min. Overall, the newly developed assay showed a test performance comparable to the routine methods ELISA and Western Blot.
Conclusions:
The performance of serological studies employing fieldable rapid assays in the framework of missions abroad or in countries with limited resources may represent an important or sometimes the only alternative to classical laboratory methods for the diagnosis of dangerous infectious diseases.
1. Hintergrund
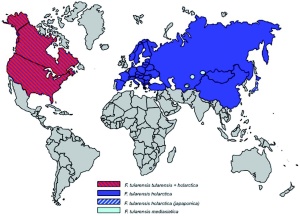
Die Tularämie – auch als Hasenpest bezeichnet – ist eine durch das Bakterium Francisella (F.) tularensis hervorgerufene Infektionskrankheit, die von infizierten oder kranken und ansteckungsfähigen Tieren wie Hasen, Wildkaninchen oder Mäusen auf den Menschen übertragen werden kann (1). Diese Zoonose wurde erstmals 1911 durch den Mediziner George W. McCoy beschrieben und kommt in der gesamten nördlichen Hemisphäre vor (Abb 1). Über 150 Säugetierarten, vor allem Nagetiere, dienen Francisella tularensis als Wirt. Der Mensch infiziert sich vor allem durch direkten Kontakt mit Wildtieren, durch Aufnahme von erregerhaltigen Lebensmitteln und Trinkwasser oder durch Einatmen infektiöser Aerosole. Daneben können auch Zecken, Stechmücken und andere Insekten die Krankheit auf den Menschen übertragen (2).
Regelmäßig treten Fälle von Tularämie in allen skandinavischen Ländern sowie in Deutschland, Österreich, Tschechien, Frankreich, in der Slowakei, Türkei und in Japan auf. Am häufigsten jedoch ist der Erreger in Russland und Amerika verbreitet. Zum gefährdeten Personenkreis zählen Jäger, Tierärzte, Landwirte, Förster und Soldaten.
2010 traten in Deutschland 31 Fälle der Tularämie auf, die im Fall einer akuten Erkrankung in Zusammenhang mit einem positiven Labornachweis nach § 7 IfSG meldepflichtig ist. Potenziell gefährlich ist der Erreger auch als Bestandteil möglicher B-Waffenprogramme, denn die Infektionsdosis ist mit 10 bis 50 Keimen sehr gering. Anstrengungen, Francisella tularensis als biologischen Kampfstoff zu verwenden, gab es bereits im 2. Weltkrieg (Japan, USA, UdSSR) (3).
Francisellen sind kleine, gramnegative, pleomorphe und unbewegliche Bakterien. Ihr Wachstum ist strikt aerob. Es gibt vier Subspezies, von denen die beiden klinisch relevanten Unterarten F. tularensis subsp. holarctica und F. tularensis subsp. tularensis serologisch identisch sind (1, 2).
Die Inkubationszeit beim Menschen liegt in der Regel bei zwei bis zehn Tagen. Bei der Erkrankung kommt es zu Allgemeinsymptomen wie Fieber (bis über 40 °C), Kopfschmerzen, Schweißausbrüche und Erschöpfung. Die weiteren Beschwerden hängen von der Art der Eintrittspforte des Erregers ab. Überwindet der Erreger zum Beispiel die Hautbarriere oder wird er inhaliert, kann es zu lokalen oder systemischen Infektionen und zur Pneumonie kommen (4).
Die Vielfalt der klinischen Symptomatik verzögert die Diagnose einer Tularämie sehr häufig. Der direkte Erregernachweis mit Hilfe einer Kultur ist meistens erfolglos und auf Grund der niedrigen Infektionsdosis sehr gefährlich. Daher sollte die Anzucht ausschließlich in Speziallaboren erfolgen (Biosicherheitsstufe 2 oder 3) (5).
Eine andere Möglichkeit der direkten Erregerdetektion ist ein Nukleinsäure - nachweis (PCR) oder ein Antigennachweis (Immunfluoreszenztest, ELISA) (5). Auch diese Verfahren sind Speziallaboratorien vorbehalten. Bis heute stellt die Serologie daher den Grundpfeiler in der Diagnostik der Tularämie dar (5).
F. tularensis-spezifische Antikörper werden 6 bis 10 Tage nach Symptombeginn feststellbar (4, 5). Überwiegend werden Agglutinations- oder Immunfluoreszenztests zum Nachweis von anti-F. tularensis-Antikörpern eingesetzt (5). Diese Verfahren sind zeitaufwendig, wenig empfindlich und auch aufgrund ihrer Kreuzreaktivität für die Untersuchung vieler Seren im Rahmen epidemiologischer Untersuchungen wenig geeignet. Neue Tests, die auf der ELISA Technik beruhen, scheinen geeignet zu sein, diese Probleme zu umgehen (5).
In den letzten Jahren kam es zu größeren Tularämieausbrüchen häufig in Ländern beziehungsweise Regionen, in denen eine moderne Laborinfrastruktur nur eingeschränkt zur Verfügung steht, oder in denen keine kommerziellen Invitro- Diagnostika für die Tularämie erhältlich sind (Türkei, Kroatien, Kosovo) (6, 7). Zwei dieser Ausbrüche traten im Kosovo auf, wo zudem kriegbedingt klinisch-mikrobiologische Laborkapazitäten nur noch rudimentär vorhanden waren (7). Unter diesen Bedingungen wäre die Anwendung einfacher und zuverlässiger Schnelltests, die ohne oder nur mit minimalem technischem Aufwand durchgeführt werden können, sowohl für die individuelle Diagnostik als auch im Rahmen von epidemiologischen Ausbruchsuntersuchungen sehr hilfreich. Aus diesem Grund wurde ein immunchromatographischer Test (ICT) auf der Basis des Lipopolysaccharids (LPS) von F. tularensis entwickelt und evaluiert. Ziel dieser Arbeiten war die Bereitstellung eines Schnelltests, der innerhalb von 15 min spezifische Antikörper sowohl beim Menschen als auch bei verschiedenen Tierspezies mit hoher Sensitivität und Spezifität nachweisen kann.
2. Material und Methoden
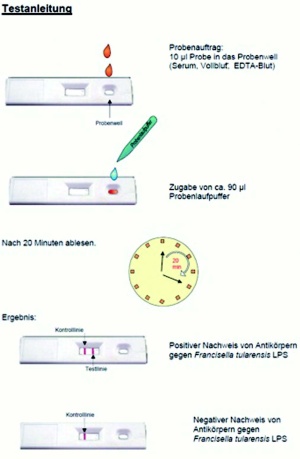
Der entwickelte Assay beruht auf dem „Lateral Flow-Prinzip“, bei dem verdünnte Serumproben auf eine Nitrocellulose-Membran aufgetragen werden. Spezifische Antikörper werden dabei nach ihrer Bindung an das Antigen auf der Testlinie mit Hilfe von kolloidalem Goldkonjugat sichtbar gemacht (Abb 2). Um den Test spezies-unabhängig einsetzen zu können, wurden die Goldpartikel kovalent an Protein A gekoppelt, das in der Lage ist, an das Fc-Stück von IgG des Menschen und weiterer Säugetierspezies zu binden. Die Serumproben, Puffer und Reagenzien werden dabei allein durch Kapillarkräfte über die Test- und Kontrollzone geführt. Das Probenmaterial (Serum) kann dabei mit Einmal-Pasteur-Pipetten aufgetragen werden. Das Testergebnis wird visuell durch den Anwender ausgelesen.
Der entwickelte Schnelltest wurde anhand von 208 Serumproben und 11 Antikörper (Ak)- Präparationen vom Menschen und von fünf Tierspezies evaluiert. Alle Proben wurden parallel mittels Mikroagglutinationstest, ELISA und Schnelltest untersucht. Proben, die in einem dieser Assays positive Reaktionen zeigten, wurden zusätzlich mittels Western Blot untersucht (Abb 3).
Um eine größere Unabhängigkeit vom französischen Projektpartner zu erhalten, mit dem ein erster Prototyp erstellt und validiert worden war (8) und um die langfristige Verfügbarkeit des technischen Know-hows am InstMikroBioBw sicherzustellen, wurde die eigene Weiterentwicklung dieses Schnelltests vorangetrieben. Hierbei wurden zunächst zehn verschiedene Blot- beziehungsweise Nitrocellulose-Membranen in Bezug auf ihre Antigenbindungskapazität untersucht. Die Entwicklung erfolgte im Spotting-Verfahren, wobei alle neuen Komponenten mit dem französischen Referenztest verglichen wurden.
Der Aufbau des ICT besteht aus 9 Komponenten (Abb 2-4). Dazu gehören ein Plastikgehäuse (Kassettenteile, BioDot Ltd., Cambridge, UK), eine Trägerplatte (.015” white matte/70 mm x 303 mm; G&L) auf der die weiteren Komponenten wie zum Beispiel das Wickingpad aufgeklebt wurden.
Die sensibleren Komponenten sind eine Blutseparationsmembran, ein Konjugatpad mit dem Gold-Protein A-Konjugat (40 nm, OD10, EM PAG40, BBI) sowie eine Trennmembran, die mit LPS (Virion/Serion, Würzburg) beschichtet ist und Kaninchenantikörper gegen Protein A (Sigma, München), die zur Herstellung der Kontrolllinie verwendet wurden (Abb 2 - 4). Die Auswahl der richtigen Membran erfolgte mit Hilfe eines vereinfachten Testaufbaus („halfstick“), der aus drei Komponenten besteht: 1. Trägerplatte, 2. „Wickingpad“ und 3. zu testende Trennmembran (Abb 4; 5). Auf der Trennmembran wurden jeweils 1 µl Kaninchenantikörper gegen Protein A (Kontrollantikörper) sowie 1 µl LPS (Testantigen) in Form von Dots pipettiert und bei Raumtemperatur getrocknet. Zur Stabilitätsprüfung der LPS-Bindung an die Membran wurden im Probenlauf 100 µl einer Mischung von anti-Francisella tularensis-Positivserum, PBS und Gold- Protein A-Konjugat darüber geführt. Dabei wurde zunächst eine größere Auswahl an Trennmembranen getestet. Mit Hilfe eines Frontline-Gerätes (BioDot Ltd., Cambridge, UK) wurden Testantigen (1 µl/cm) und Kontrollantikörper (0,75 µl/cm) gleichzeitig aufgetragen.
Sechs verschiedene Konjugatpads wurden mit einer Lösung aus Gold-Protein A, PBS (Sigma; P – 4417), 20 Gew % Saccharose (Roth; 9286), 5 Gew % Trehalose (Roth; 5151) und 0,5 % Tween 20 (Merck; 8.22184.1000) inkubiert. Dabei saugten sich die Pads komplett mit Lösung voll und wurden anschließend bei Raumtemperatur getrocknet. Die endgültige Fixierung erfolgte bei 40 °C für 20 min im Trockenschrank.
Zur Testung der Freisetzung des Konjugats aus dem Pad wurden zunächst „Dipsticks“ hergestellt (Abb 5). Sie bestehen im Gegensatz zum fertigen Testsystem aus sieben Komponenten: Trägerplatte, „Wickingpad“ (Whatman, 470), Trennmembran (Vivid 170 oder FF85/100) mit Test- und Kontrolllinie, zu testendes „Konjugatpad“, und „Samplepad“ (Pall, Type 111).
Der Testlauf erfolgte mit positivem Serumpool und negativem Serum (FA Bio Whittaker/Lonza: Cat 14-402F, Schweiz). Nach Validation des im Institut hergestellten ICT erfolgte die Umstellung der Probenmatrix von Serum auf Vollblut und EDTA-Blut. Es standen hierfür neun verschiedene Separationsmembranen zur Verfügung. Sie wurden ebenfalls im Dipstickformat getestet, ungeachtet ihrer speziellen Herstellerbeschreibung. Hierbei wurde das Samplepad gegen die zu testende Blutseparationsmembran getauscht.
Im letzten Schritt erfolgte dann die Umstellung des Dipstickformats (Gesamtlänge: 8cm) auf das Kassettenformat (Gesamtlänge: 6 cm) (Abb 5).
Die Überprüfung der Reaktionsfähigkeit und Zuverlässigkeit der entwickelten Kassetten wurde mit den eingangs beschriebenen Seren aus der Serenbank unseres Konsiliarlaboratoriums getestet. Pro Testlauf wurden jeweils 10 µl Probe und 90 µl PBS in das Probenwell der Kassette nach ein ander eingebracht und das Ergebnis nach 15 min abgelesen (Abb 6). Die Untersuchung von Vollblut erfolgte mit „gespikten“ Blutproben, die mit anti-F. tularensis- Antikörpern angereichert wurden. In einigen Fällen konnten eingesandte Laborproben parallel zu den Standardtests untersucht werden (Abb 7).
3. Ergebnisse
3.1 Validation des Feldtests für Serumproben
Mit Hilfe des neuen ICT wurden spezifische anti-F. tularensis-LPS-Antikörper in verschiedenen Serumverdünnungen vom Menschen und von zwei Makakenspezies (Macaca (M.) mulatta, M. fascicularis), Schweinen, Kaninchen und Mäusen innerhalb von 15 min nachgewiesen (Tab 1). Bei einer Serumverdünnung von 1:10 lag die Sensitivität bei 98,8 % mit einem 95 %- Konfidenzintervall (KI) von 93,2 bis 99,9 % und die Spezifität bei 98,4 % (95 %-KI: 94,5 bis 99,8 %) im Vergleich zum Agglutinationstest, der als Goldstandard definiert wurde. Die Konkordanz beider Tests betrug 98,1 % (k = 0,95).
Bei der Untersuchung von anonymisierten Serumrückstellproben vom Laborpersonal vor und nach Immunisierung mit dem Lebendimpfstamm F. tularensis- LVS im Jahr 2004 wurde eine Serokonversion bei allen fünf Impflingen nachgewiesen (Tab 2).
Eine Serokonversion wurde auch bei fünf Makaken des Deutschen Primatenzentrums festgestellt, die aufgrund ihrer Haltung in einem Außengehege gegenüber F. tularensis im Zeitraum 2002 - 2005 exponiert waren (9). Ähnliche Resultate ergaben sich bei vakzinierten Kaninchen und Schweinen mit F. tularensis subsp. holarctica oder F. tularensis subsp. tularensis. Bei Kaninchen, die mit anderen bakteriellen Erregern wie Yersinia pestis, Burkholderia (B.) mallei, B. cepacia, oder Pseudomonas aeruginosa immunisiert worden waren, fanden sich keine positiven Reaktionen. Da keine positiven Mausseren zur Verfügung standen, wurden stattdessen murine monoklonale Antikörper (mAk) untersucht. Hierbei zeigten nur die F. tularensis-spezifischen mAk positive Testergebnisse.
Bei sehr wenigen hochtitrigen Seren (5 %) trat ein „high-dose-hook“ Effekt auf, der zu etwas schwächeren Banden auf den Teststreifen führte. Trotzdem wurden auch diese Seren bei einer Standardverdünnung von 1:10 alle sicher als positiv erkannt.
Bei einer rein visuellen Auswertung einer Einzeluntersuchung durch unabhängige Anwender kann mit den entwickelten Teststreifen ein semiquantitatives Resultat angegeben werden. Durch Herstellen von log2-Verdünnungsreihen konnte außerdem gezeigt werden, dass auch eine quantitative Auswertung im Sinn einer Endpunkttitration, ähnlich wie im ELISA, erfolgen kann. Insgesamt zeigte der neu entwickelte Assay damit eine Testperformance, die mit den oben genannten Routineverfahren (ELISA, Western Blot) (Abb 3) vergleichbar war.
3.2 Umstellung des Testformats für die direkte Untersuchung von Blutproben „im Feld“
Aus den zur Verfügung stehenden Trennmembranen wurden die „Vivid 170“ (Fa. Pall) und „FF85/100“ (Fa. GE Healthcare) ausgewählt. Beide erbrachten im Test gute Resultate: Testund Kontrolldots waren gut sichtbar und als klare Punkte zu erkennen.
Die „Vivid 170“-Membran überzeugte weiter mit einer hohen Laufgeschwindigkeit der Flüssigkeitsfront. Der LPSDot (Ag) war bereits nach 1,5 min klar zu erkennen. Die „FF85/100“ zeigte erst nach > 3 min ein Ergebnis. Im zweiten Schritt wurden mit Hilfe eines Frontline-Geräts (BioDot) gleichzeitig Testantigen und Kontrollantikörper auf die jeweilige Nitrocellulose aufgetragen. Festgelegt wurde ein Auftragsvolumen von 1 µl/cm für LPS sowie 0,75 µl/cm für den Kontrollantikörper. Die Auftragslinie des Testantigens auf der „FF85/100“ zeigte dabei eine leicht stärkere Linienbreite als auf der „Vivid 170“-Membran. Im Halfstickformat wurden die Membranen auf ihre Sensitivität getestet. Auf beiden Trennmembranen ergab sich eine gut abzulesende Testlinie bei den Verdünnungen 1:200 bis 1:3 200. Linienintensität und -stärke der beiden Membranen waren identisch. Für die Konjugatkomponente wurden das Konjugatpad „6613“ (Fa. Pall) für die „Vivid 170“ und das Konjugatpad „8964“ (Fa. Pall) für die FF85/100-Membran ausgewählt. Beide Kombinationen zeigten Endpunkttijeweils für sich eine klare Testlinie und ergaben keine falsch positiven Signale der Testlinie in den Negativkontrollen. Auch die Hintergrundeinfärbung der Trennmembranen war sehr gering. Die Auswahl der Blutseparationsmembran im dritten Schritt stellte kein Problem dar. Alle getesteten Membranen erbrachten gute Ergebnisse. Durch die Vorgabe des Kassettenformats wurde der „Dipstick“ auf die Größe von 0,5 x 6 cm gekürzt. Dies wurde vor allem durch die Verwendung des saugstarken Fließes „Grade 900“ (Fa. GE Healthcare) kompensiert. Trotz der geringen Größe konnte die anfallende Restflüssigkeit sicher aufgenommen werden.
Die Trennmembran und das Konjugatpad wurden in der ursprünglichen Größe eingesetzt. Die Blutseparationsmembran wurde an die Größe des Konjugatpads angepasst. Zur Evaluierung der Prototypen wurden zunächst Referenzseren aus dem Konsiliarlabor (je 10 µl) eingesetzt. Diese wurden zuvor in einem ELISA getestet. Hochpositive Seren (OD > 1,8) wiesen sehr kräftige Test- und nur noch sehr schwache Kontrolllinien auf. Bei 2 von 5 schwach positiv getesteten Seren (OD < 0,5) war die Testlinie nur leicht angefärbt. Bei allen 10 negativen Seren kam es zu keinem Signal an der Testlinie. Anschließend wurden auch positive und negative Vollblutproben getestet (Abb 7). Die Testlinie ergab bei 4 von 5 mit Serum von geimpften Personen „gespikten“ Vollblutproben ein deutliches positives Signal. Bei EDTA-Blut von nicht infizierten Personen (Negativkontrollen) war keine Reaktion an der Testlinie feststellbar.
4. Diskussion
In klinisch-diagnostischer Hinsicht stellt die Tularämie eine besondere Herausforderung dar: Nur sehr wenige Ärzte in Deutschland haben klinische Erfahrung mit dieser sehr seltenen Erkrankung und die Infektion mit F. tularensis kann je nach Eintrittspforte und Virulenz der beteiligten Unterart des Erregers zu völlig verschiedenen, meist sehr unspezifischen Krankheitsbildern führen (4). Dies macht die Anwendung geeigneter bakteriologischer, serologischer oder molekularbiologischer Labormethoden zur Diagnosestellung zwingend notwendig, wobei wiederum nur sehr wenige Labore in Deutschland eine spezifische Laboruntersuchung durchführen und kommerzielle Diagnostika kaum zur Verfügung stehen (5). Aus diesen Gründen war die Entwicklung von spezifischen und sensitiven Nachweissystemen für die Tularämiediagnostik beim Menschen und möglichen Reservoirtieren von F. tularensis ein zentrales Thema der Arbeit des Konsiliarlaboratoriums in den letzten Jahren.
Während ELISA und Western Blot heute als Standardmethoden in modernen klinisch-mikrobiologischen Laboren eingeführt sind und zum Teil auch automatisiert durchgeführt werden können (5), steht für die Schnelldiagnostik vor Ort häufig keine oder nur eine sehr einfache Laborausstattung zur Verfügung. Dies gilt zum Beispiel bei Krankheitsausbrüchen in Ländern mit begrenzten Ressourcen, in Regionen, in denen durch Naturkatastrophen oder kriegerische Auseinandersetzungen die medizinische Infrastruktur zerstört ist oder im Rahmen von Felduntersuchungen, bei denen Proben direkt am Untersuchungsort untersucht werden sollen. In diesen Fällen hat sich die Anwendung von immunchromatographischen Tests, die in verschiedenen Formaten für unterschiedliche Infektionserreger entwickelt wurden und mittlerweile auch teilweise kommerziell erhältlich sind, sehr bewährt (10). So werden unter anderem ICT oder „Lateral Flow Assays“ in der Schnelldiagnostik der Pest, Brucellose, Leptospirose oder des Dengue- Fiebers und anderer virologischer Infektionserkrankungen erfolgreich eingesetzt (11, 12).
Basierend auf diesem Format haben wir einen Schnelltest entwickelt, mit dessen Hilfe in Zukunft innerhalb von 15 min die Verdachtsdiagnose Tularämie vorläufig serologisch bestätigt werden kann. Diese Untersuchung kann vor Ort in einem Feldlabor durchgeführt werden. Neben dem Einsatz in der Humandiagnostik lässt sich dieser Test auch in der Veterinärmedizin verwenden, da der Antikörpernachweis spezies-unabhängig erfolgt. Diese Methode ist nicht nur schnell und einfach durchführbar, sondern auch sehr kostengünstig (Herstellungskosten circa 1 – 2 Euro). Die Sensitivität und Spezifität dieses Tests war ähnlich hoch wie die Testparameter des oben erwähnten ELISA. Durch die semiquantitative Auswertung oder durch Titration von Akutund Rekonvaleszentenseren lassen sich außerdem Titerbewegungen oder eine Serokonversion als Indikatoren einer frischen Infektion und damit Exposition gegen den Erreger auch mit diesem einfachen Verfahren feststellen. Dieser Aspekt ist insbesondere wehrmedizinisch relevant, da während multinationaler Auslandseinsätze der Bundeswehr im Falle eines Ausbruchs eine eventuell vorliegende Tularämie erkannt und der Immunstatus bei subklinischer Exposition rasch und zuverlässig vor Ort untersucht werden könnten. In unserer Abteilung wurden dazu bereits auch Schnelltestprototypen zum Antikörper- Nachweis gegen Pest und Anthrax hergestellt und geprüft.
Zurzeit erfolgt eine umfangreiche prospektive Validation des Tularämietests, um den Antikörper-Nachweis auch ohne Laborausrüstung direkt aus dem Vollblut im Feld durchführen zu können. Dies würde insbesondere ökologische Untersuchungen und eine Surveillance der Tularämieprävalenz und -aktivität in Wildtierpopulationen an Bundeswehrstandorten in und außerhalb Deutschlands erleichtern.
5. Schlussfolgerungen
Die Durchführung serologischer Untersuchungen mittels feldtauglicher Schnelltests kann im Rahmen von Auslandeinsätzen oder in Ländern mit begrenzten Ressourcen eine wichtige, oftmals die einzige Alternative zu klassischen Labormethoden in der Diagnostik gefährlicher Infektionskrankheiten darstellen.
F. tularensis kann sich besonders unter Bedingungen, die zur Zerstörung von Ökosystemen und wichtigen Infrastrukturen führen (militärische Konflikte, Naturkatastrophen) sehr rasch epizootisch in empfänglichen Nager- und Feldhasenpopulationen ausbreiten. Diese Epizootien sind in der Folge häufig mit einem signifikanten Anstieg der Humanfälle in der betroffenen Region assoziiert, wie epidemiologische Studien in Schweden, dem Kosovo und Spanien, sowie die Erfahrungen der Wehr - macht hygieniker an der Ostfront im 2. Weltkrieg gezeigt haben (13). Zuverlässige Systeme zur Surveillance von Zoonosen in Tierpopulationen stellen einen wichtigen Beitrag zum Schutz der Humanbevölkerung dar. Der im InstMikroBioBw neu entwickelte ICT ist sowohl für die Diagnostik der Tularämie beim Menschen als auch zur Tularämie- Surveillance in Tierpopulationen geeignet.
Literatur
- Sjöstedt A: Tularemia: history, epidemiology, pathogen physiology, and clinical manifestations. Ann N Y Acad Sci 2007; 1105: 1-29.
- Keim P, Johansson A, Wagner DM: Molecular epidemiology, evolution, and ecology of Francisella. Ann N Y Acad Sci 2007; 1105: 30-66.
- Dennis DT, Inglesby TV, Henderson DA, et al.: Tularemia as a biological weaponmedical and public health management. JAMA 2000; 285: 2763-2773.
- Tärnvik A, Chu MC: New approaches to diagnosis and therapy of tularemia. Ann N Y Acad Sci 2007; 1105: 378-404.
- Splettstoesser WD, Tomaso H, Al Dahouk S, Neubauer H, Schuff-Werner P: Diagnostic procedures in tularaemia with special focus on molecular and immunological techniques. J Vet Med B Infect Dis Vet Public Health 2005; 52: 249-261.
- Petersen JM, Schriefer ME. Tularemia: emergence/ re-emergence. Veterinary Research 2005; 36: 455–467.
- Reintjes R, Dedushaj I, Gjini A, et al.: Tularemia outbreak investigation in Kosovo: case control and environmental studies. Emerg Infect Dis 2002; 8: 69-73.
- Splettstoesser WD, Guglielmo-Viret V, Seibold E, Thullier P: Evaluation of an immunochromatographic test (ICT) for the rapid and reliable serodiagnosis of human tularemia and the detection of F. tularensisspecific antibodies in serum from different mammalian species. J Clin Microbiol 2010; 48(5): 1629-1634.
- Mätz-Rensing K, Floto A, Schrod A, et al.: Epizootic of Tularemia in an Outdoor Housed Group of Cynomolgus Monkeys (Macaca fascicularis). Vet Pathol 2007; 44, 327-34.
- Splettstoesser WD, Frangoulidis D, Puthucheary SD: Validation and comparison of an extrapolysaccharide (EPS)- based in-house ELISA and the PanBio melioidosis rapid cassette test-kits for serodiagnosis of melioidosis in a non-endemic area. Trans R Soc Trop Med Hyg 2008; 102 S1: 45-46.
- Smits HL, Abdoel TH, Solera J, Clavijo E, Diaz R: Immunochromatographic Brucella- specific immunoglobulin M and G lateral flow assays for rapid serodiagnosis of human brucellosis. Clin Diagn Lab Immunol 2003; 10: 1141-1146.
- Tomaso H, H Thullier P, Seibold E, et al.: Comparison of hand-held test kits, immunofluorescence microscopy, ELISA, and flow cytometric analysis for the rapid presumptive identification of Yersinia pestis. J Clin Microbiol 2007; 45: 3404-3407.
- Croddy E, Krcálová S: Tularemia, biological warfare, and the battle for Stalingrad (1942-1943). Mil Med. 2001; 166(1): 837-838.
Fotos: Konsiliarlaboratorium für Tularämie, InstMikroBioBw, MÜNCHEN
Datum: 27.08.2012
Quelle: Wehrmedizinische Monatsschrift 2012/4