Untersuchungen zum Hook-Effekt bei Lateral Flow Assays für -Staphylokokken Enterotoxin B
Christian Silberbauer, Maximillian Mosig, Marina Hagl, Henri Derschum
Aus dem Bereich Wissenschaften (Leiter: Oberstleutnant M. Arnold) der Schule für ABC-Abwehr und Gesetzliche Schutzaufgaben, Sonthofen (Kommandeur: Oberst V. R. Quante)
Zusammenfassung
Immunologische Assays, wie Enzyme-linked Immunosorbent Assay (ELISA) oder Lateral flow assay (LFA), können unter Umständen ein falsch negatives Ergebnis liefern. Neben anderen Ursachen, wie Kreuzreaktivität oder Antikörper-Inter-ferenz, ist für dieses Phänomen der sogenannte „High-Dose Hook-Effekt“ verantwortlich. Hierbei zeigt der Test aufgrund von Übersättigung der Antikörper mit in zu hoher Konzentration vorhandenem Antigen ein falsch negatives Ergebnis.
Im vorliegenden Versuch sollte die obere Nachweisgrenze (upper detection limit, UDL) des in der Praxis vielfach genutzten Handheld-Testkit-Systems miPROTECT® (miprolab) für das Bakterientoxin SEB eingegrenzt werden. Hierzu wurde mit zwei Verdünnungsreihen aus jeweils einer Stammlösung eine Dreifachbestimmung durchgeführt. Das erwartete Ergebnis war ein Ausbleiben der positiven Anzeige oberhalb einer Konzentration von 500 µg*l-1 (Herstellerangabe).
In der ersten Versuchsreihe wurden die untere Nachweisgrenze (lower detection limit, LDL) und ein Anhalt für die obere Grenze herausgearbeitet. Die zweite Verdünnungsreihe mit kleineren Verdünnungsschritten zeigte, dass das System miPROTECT® - bei visueller Auswertung – bei Antigenkonzentrationen, die deutlich über der vom Hersteller angegebenen UDL liegen, noch positiv anzeigt, wenn auch extrem schwach. Ein Hook-Effekt ist zwar zu beobachten, eine obere Nachweisgrenze wurde aber noch nicht gefunden.
Schlüsselwörter: Hook-Effekt, obere Nachweisgrenze, ELISA, Testkit
Keywords: Hook effect, upper detection limit, ELISA, test kit
Einleitung
Der Hook-Effekt

Dieser Effekt ist darin begründet, dass nicht nur die immobilisierten Antikörper, sondern auch die Detektionsantikörper mit dem Antigen in der Probe reagiert haben und es zu einer Absättigung kam. Dies geschieht, wenn die Probe eine zu hohe Konzentration von Antigen enthält [5,6]. Es kann sich keine Verbindung zwischen immobilisiertem und Detektions-Antikörper bilden und ein Signal bleibt aus. Die höchste Konzentration, bei der noch ein positives, wenn auch schwaches Ergebnis zu beobachten ist, ist dann die obere Nachweisgrenze (upper detection limit, UDL) für den jeweiligen Stoff in dem verwendeten Testsystem. Unterhalb dieser Konzentration ist eine positive Anzeige zu beobachten, während der Assay oberhalb dieser Konzentration kein positives Ergebnis mehr erbringt, da alle Antikörper an Antigen gebunden sind und damit der Nachweisweg blockiert ist.
Eine Möglichkeit seitens des Herstellers, den Hook-Effekt zu verhindern, ist die Verwendung von polyklonalen Antikörpern, die durch Affinitäts-Chromatografie gereinigt wurden. Die Menge, der in einer solchen Präparation enthaltenen Epitop-Bindungsstellen ist laut Hersteller (AdVnt Biotechnologies) so groß, dass eine Übersättigung unwahrscheinlich wird [1]. Außerdem wird eine große Menge Antikörper zur Detektion eingesetzt, was ebenfalls die Möglichkeit einer Übersättigung einschränkt [1].
Es gibt für den Probenehmer vor Ort eine Methode, das Auftreten eines Hook-Effekts zu verhindern. Wenn ein Test ein negatives Ergebnis zeigt und eher davon auszugehen ist, dass das gesuchte Antigen in der Probe vorhanden war, so verdünnt man die Probe, bis eine Konzentration unterhalb der UDL erreicht ist [5, 6]. Hierfür ist es notwendig, die UDL zu kennen, damit der Probenehmer einschätzen kann, ob eine Verdünnung durchgeführt werden sollte und wie weit diese erfolgen werden muss.
Diese Untersuchung wurde deshalb durchgeführt, um Personal, welches für Probenahmen trainiert wird, über den Hook-Effekt und die Möglichkeit seiner Vermeidung zu informieren.
Staphylokokken Enterotoxin B (SEB)
SEB ist eines von derzeit 14 identifizierten [2] Peptiden, die von Staphylococcus aureus als Exotoxine gebildet werden [2, 3]. Staphylococcus aureus gehört zu den wichtigsten Auslösern von lebensmittelassoziierten Erkrankungen weltweit und ist außerdem der Haupterreger von nosokomialen Infektionen. Bei lebensmittelassoziierten Erkrankungen, die durch Staphylococcus aureus oder – in Form von Lebensmittelvergiftungen – dessen Toxine verursacht werden, ist SEB am häufigsten beteiligt [2]. Auftretende Symptome sind vor allem Magen- und Darmkrämpfe, Durchfall und Entzündungsreaktionen des Darmes. Da SEB ein sogenanntes Superantigen ist, kann es unspezifisch CD4+ und CD8+-Zellen aktivieren, welche dann im Übermaß Zytokine produzieren. Dies kann zu einem Schock führen und lebensbedrohlich sein [2, 3]. Aufgrund hoher Stabilität, sowie Unempfindlichkeit gegenüber Hitze und einigen Peptidasen [2, 3], eignet sich SEB grundsätzlich auch als biologischer Kampfstoff und wurde als solcher in verschiedenen offensiven Biowaffenprogrammen erforscht. Die niedrige eine Erkrankung auslösende Dosis (ED50) von nur 0,0004 µg*kg-1 Körpergewicht [2, 7] qualifiziert SEB als biologischen Kampfstoff ebenso. Als letale Dosis (LD50) werden 0,02 µg*kg-1 Körpergewicht bei Aufnahme als Aerosol angegeben, wobei eine symptomauslösende Dosis um einige Zehnerpotenzen niedriger anzunehmen ist [7].
Aufgrund seiner Eignung als biologische Waffe oder Mittel des Bioterrorismus ist SEB für die ABC-Abwehr von Interesse. Eine Standardmethode zur Detektion sind antikörperbasierte Nachweise, welche in Form von ELISA-Kits kommerziell erhältlich sind. Auch Schnelltests (Handheld Testkit, HHTK) für SEB gibt es von verschiedenen Anbietern (z. B. miprolab, AdVnt, Tetracore) auf dem Markt; diese werden unter anderem von ABC--Abwehrkräften der Streitkräfte mehrerer Staaten eingesetzt, da diese Systeme sich gut für den Einsatz durch „first-responder“ und Probenahme-Trupps eignen.
Material und Methoden
Vorbemerkung
Die Arbeiten wurden (sofern nicht anders angegeben) in einer mikrobiologischen Sicherheitswerkbank Klasse II (Laminar--Flow-System) durchgeführt. Dekontamination während und nach der Arbeit wurde 0,25 N Natronlauge in einem Becherglas als Abfallbehälter vorgelegt, sodass kontaminierte Abfälle schon beim Sammeln inaktiviert werden konnten.
SEB-Stammlösung und Verdünnungsreihen
Erster Durchgang
Die Stammlösung zum Ansetzen der Verdünnungsreihe wurde in einer mikrobiologischen Sicherheitswerkbank Klasse III (GloveBox) aus 1 mg SEB in Pulverform (Sigma Aldrich LOT: 062K4109) in 100 ml destilliertem Wasser als Lösemittel hergestellt. Die Anfangskonzentration betrug c0 = 10 mg*l-1.
Aus dieser Stammlösung wurden Gebrauchslösungen mit c1 = 5 mg*l-1, c2 = 1 mg*l-1, c3 = 500 μg*l-1, c4 = 1 µg *l-1 und c5 = 0,5 µg *l-1 mit einem Volumen von jeweils 10 ml durch Verdünnung mit destilliertem Wasser hergestellt.
Zweiter Durchgang
Die Stammlösung (10 ml) zum Ansetzen der Verdünnungsreihe wurden aus 1 mg SEB in Pulverform (Sigma Aldrich LOT: 020K4071) hergestellt. Als Lösemittel diente ein Phosphatpuffer-System. (50 mM Phosphat, 150 mM NaCl, pH = 6,8). Die Anfangskonzentration betrug c0 = 100 mg*l-1.
Aus der Stammlösung wurden Gebrauchslösungen mit c1 = 5 mg*l-1, c2 = 10 mg*l-1, c3 = 15 mg*l-1, c4 = 20 mg*l-1, c5 = 25 mg*l-1, c6 = 30 mg*l-1, c7 = 40 mg*l-1 und c8 = 50 mg*l-1 mit einem Volumen von jeweils 0,5 ml hergestellt. Als Lösemittel diente das o.g. Phosphat-Puffersystem.
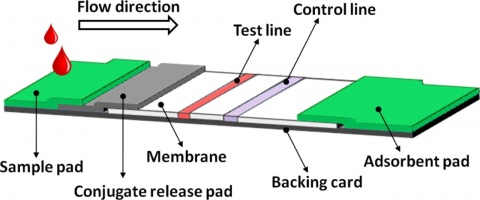
Lateral-Flow-Assay
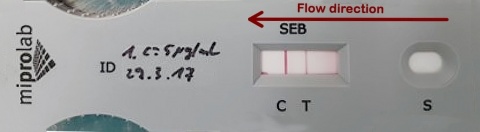
Zum Einsatz kamen Testsysteme des Typs miPROTECT® der Firma miprolab. Der Test wurde jeweils als Dreifachbestimmung durchgeführt. Bei diesem System muss für ein gültiges Ergebnis die Kontrolllinie C deutlich erkennbar sein. Ist die Testlinie T ebenfalls erkennbar, so gilt der Test als positiv (Abbildung 2 und 3). Alle Tests wurden nach 5 bzw. 20 Minuten Inkubationszeit (Herstellerangabe) abgelesen, visuell ausgewertet und per Foto dokumentiert.Erster Durchgang
Ausgehend von der niedrigsten Verdünnungsstufe (c5) wurden jeweils drei Tropfen der Gebrauchslösung mit einer Einweg-Pasteurpipette auf die Testkassetten gegeben.
Zweiter Durchgang
Ausgehend von der niedrigsten Verdünnungsstufe (c1) wurden pro Testkassette 100 µl der jeweiligen Gebrauchslösung mit einer Kolbenhub-Pipette (Eppendorf, 100 - 300 µl) aufgetragen.Ergebnisse
Erster Durchgang
Im ersten Durchgang waren die Tests für die Lösungen mit c3 (500 µg*l-1), c4 (1 µg*l-1) und c5 (0,5 µg*l-1) negativ. Erst bei c2 (1 mg*l-1) wurde ein positives Ergebnis angezeigt, wobei bei der Lösung c1 (5 mg*l-1) die am stärksten ausgeprägte Testlinie sichtbar wurde. Zuletzt wurde noch die Stammlösung c0 (10 mg*l-1) untersucht, wobei der Test positiv anzeigte, die Testlinie jedoch – trotz höherer SEB-Konzentration – wieder schwächer ausgeprägt war.
Zweiter Durchgang

Diskussion
Der erste Durchgang wurde durchgeführt, um den Detektionsbereich grob eingrenzen zu können. Nach Herstellerangabe musste angenommen werden, oberhalb einer SEB-Konzentration von 500 µg*l-1 keine positiven Ergebnisse mehr zu finden. Aufgrund dieser Annahme wurden die Konzentrationen der Verdünnungsreihe im ersten Durchgang zu niedrig gewählt. Unterhalb von 500 µg*l-1 zeigte kein Test ein positives Ergebnis. Die LDL wurde vom Hersteller auf erneute Anfrage mit 10 µg*l-1 angegeben. Wir hatten allerdings als nächste Verdünnungsstufe unterhalb von 500 µg*l-1 nur eine Konzentration von 1 µg*l-1 gewählt und deshalb kein positives Ergebnis mehr erhalten. Damit stehen unsere Ergebnisse in Übereinklang mit den Herstellerangaben.
Anhand der immer schwächer werdenden Testlinien bei höheren Konzentrationen kann auf eine Übersättigung der Detektionsantikörper geschlossen werden. Bei einer Konzentration von 1 mg*l-1 war die Testlinie am stärksten ausgeprägt. Hier ist offenbar das Optimum des Testsystems zu finden. Bei SEB-Konzentrationen über 1 mg*l-1 wurden die Testlinien deutlich blasser. Da der Test nur visuell ausgewertet wurde, ist ein etwaiger Kurvenverlauf nicht mit Sicherheit zu bestimmen. Es ist allerdings mit bloßem Auge eine graduelle Abschwächung des Signals zu erkennen. Es ist weiterhin nicht mit bloßem Auge zu erkennen, ob die Abschwächung der Intensität der Testlinien einen hakenförmigen Kurvenverlauf produzieren würde, da es nicht möglich ist, aus rein visuellen Ergebnissen eine Kurve zu zeichnen. Eine Abschwächung des Signals durch Übersättigung ist zweifelsfrei aufgetreten, aber die Konzentration, ab der sich der Hook-Effekt einstellt, kann mit der Methode nicht exakt dargestellt werden. Hierfür müsste die Erhebung der Ergebnisse auf eine andere Weise (z. B. densitometrisch) erfolgen, die eine statistische Auswertung möglich macht.Eine Verfälschung der beobachteten Testergebnisse durch auftretende Kreuzreaktivitäten ist nicht zu erwarten, da keine Lebensmittel- oder Umweltproben untersucht wurden, sondern Lösungen aus einem hochreinen Toxinstandard, welcher der Qualitätskontrolle eines kommerziellen Herstellers unterliegt. Antikörperinterferenz ist möglich, aber sehr unwahrscheinlich, da die Antikörper des Testsystems aufeinander abgestimmt sind und auch die Entwicklung der Testsysteme der Qualitätskon-trolle eines kommerziellen Herstellers unterliegt.
Schlussfolgerung und Ausblick
In unseren Versuchen haben wir für das eingesetzte Testkit keine UDL gefunden. Die Ergebnisse bei sehr hohen Konzentrationen legen jedoch nahe, dass wir der oberen Nachweisgrenze nahegekommen sind, da die Test-linien immer schwächer wurden. Im Laborversuch ist die Grenze nicht gefunden worden, jedoch wären die gezeigten Resultate im Feldversuch oder scharfen Einsatz wahrscheinlich andere. Die Testlinien zeigten sich bei hohen Konzentrationen derart schwach, dass sie mit bloßem Auge kaum wahrnehmbar waren und davon ausgegangen werden kann, dass bei Einschränkung der Sicht, beispielsweise durch eine ABC-Schutzmaske, ein entsprechendes Testergebnis nicht mehr als positiv erkannt wird (Abbildung 3). Für die praktische Anwendung, insbesondere unter Einsatzbedingungen, kann man die UDL spätestens bei etwa 50 mg*l-1 als erreicht betrachten. Um die UDL für das miPROTECT® - Detektionssystem definitiv exakt zu ermitteln, muss ein weiterer Versuch mit dem gleichen Aufbau durchgeführt werden. Die Konzentrationen der Testlösungen müssen dann dem hier ermittelten Rahmen angepasst und die Schritte zwischen den zu untersuchenden SEB-Konzentrationen entsprechend verkleinert werden. Um den Hook-Effekt darstellen zu können, sollte außerdem eine optische Detektion der Intensität der Testlinien ermöglicht werden, sodass eine Kurve gezeichnet und die Ergebnisse statistisch ausgewertet werden können, z. B. durch die Verwendung eines Densitometers.
Eine Relevanz für anwendungsbezogene Wissenschaft hat sich hier aus der Praxis entwickelt. Die Anwendung und Auswertung der beschriebenen LFA wird an der Schule ABC-Abwehr und Gesetzliche Schutzaufgaben der Bundeswehr ausgebildet. Als erstes Indiz bildendes Detektionsmittel unterstützen sie die -SIBCRA[1]-konforme Aufklärung und Probennahme. Umso wichtiger ist es, den Anwender praktisch auf mögliche Grenzen des angewandten Testkits hinzuweisen und ihm damit Handlungssicherheit zu vermitteln.
Wie bereits erwähnt, kann der Hook-Effekt bei allen Testkits, die immunchromatographische Verfahren nutzen, dazu führen, dass bei hohen Konzentrationen des nachzuweisenden Agens ein falsch negatives Ergebnis angezeigt wird. Deshalb sollte bei klinischen Anwendungen (z. B. Mononucleose-LFA oder Drogentest) im Falle eines negativen Ergebnisses die Untersuchung nach entsprechender Dilution der untersuchten Flüssigkeit (z. B. Blut, Urin) wiederholt werden.
Literatur
- Advnt Biotechnologies: Factsheet zum Hook Effekt. (Aufgerufen: 21. Oktober 2018).
- Bhatia A, Zahoor S (2007) Staphylococcus Aureus Enterotoxins: A Review. Journal of clinical and diagnostical research 2007; (Aufgerufen: 18. Oktober 2018.)
- Gopalakrishnakone P, Balali-Mood M, Llewellyn L, Singh BR (Eds.): Biological Toxins and Bioterrorism. Netherlands: Springer 2007.
- Koczula KM, Gallotta A: Lateral flow assays. Essays in Biochemistry 2016; 60(1): 111 - 120.
- Lourens A, Jarvis J, Meintjes G, Samuel C: Rapid diagnosis of Cryptococcal meningitis by use of lateral flow assay on cerebrospinal fluid samples: Influence of the high-dose “hook” effect. Journal of Clinical Microbiology 2014; 52(12): 4172 - 4175.
- Miller J: Interference in Immunoassays: avoiding erroneous results. CLI Online 2004 (Aufgerufen: 18. Oktober 2018).
- Robert-Koch-Institut: Biologische Gefahren II, Kap 4.13: SEB. (Aufgerufen am 17. Oktober 2018).
- Rusnak JM, Kortepeter M, Ulrich R, Poli M, Boudreau E: Laboratory Exposures to Staphylococcal Enterotoxin B. Emerg Infect Dis. 2004; 10(9): 1544 - 1549.
Bilder: C. Silberbauer, Sonthofen
Für die Verfasser
Stabsunteroffizier Christian Silberbauer
Schule für ABC-Abwehr und Gesetzliche Schutzaufgaben'
Mühlenweg 12, 87527 Sonthofen
E-Mail: [email protected]
[1] SIBRCA steht für „Sampling and Identification of Bological, Chemical and Radiation Agents“
Datum: 11.01.2019