Infektionsrisiken in der Chirurgie des Erwachsenen – Update 2015 auf der Basis einer Literaturanalyse der Jahre 2011 - 2015
Aus der Abteilung Abteilung Unfallchirurgie / Orthopädie, Septisch-Rekonstruktive Chirurgie (Leiter: Oberstarzt Professor Dr. C. Willy) des Bundeswehrkrankenhauses Berlin (Chefarzt: Flottenarzt Dr. K. Reuter)
Christian Willy
WMM, 59. Jahrgang (Ausgabe 6-7/2015; S. 201-207)
Wir wissen nichts - das ist das Erste.
Deshalb sollen wir sehr bescheiden sein,
das ist das Zweite. Dass wir nicht behaupten,
zu wissen, wenn wir nicht wissen, das ist das Dritte.
Sir Karl Popper, 1902 - 1994
Einleitung
Oberstarzt Prof. Dr. Gerngroß war in den Anfangsjahren der Deutschen Gesellschaft für Wundbehandlung e. V. (DGfW e. V.), die 1994 als interdisziplinäre wissenschaftliche Fachgesellschaft in Wiesbaden gegründet worden war, ihr Präsident. Ein besonderes Anliegen war ihm die Verbesserung der interprofessionellen Zusammenarbeit von Pflegenden, Ärzten und nichtärztlichen Therapeuten bei der Behandlung komplexer Wunden. Sein Ziel war es zudem, eine Organisation zu schaffen, welche den Wissenstransfer zwischen Forschung und Praxis zur verbesserten Behandlung dieser Wunden unterstützt.

„Wissen durch Forschung und akademisches Denken macht zukunftsfähig!“
Mit diesen Worten drückte er seine Überzeugung davon aus, dass auch für einen leistungsfähigen Sanitätsdienstes gelten müsse, dass die eigenständige Bearbeitung wehrmedizinischer Fragen und akademisch kritisches Denken der Schlüssel zum dauerhaften Nutzen für den Soldaten-Patienten ist.
Die Behandlung komplexer unfallchirurgischer Wunden unter Beteiligung von Knochen, Weichgewebe und vaskulärer sowie nervaler Strukturen stand für ihn als Unfallchirurg bei all diesen Bemühungen im besonderen Fokus. Ihn interessierte hierbei ganz allgemein die Knochenbruchheilung und speziell die Frakturbereichsfestigkeit während einer Fixateur externe Behandlung, die frühzeitige Diagnose und Therapie des Kompartmentsyndroms und die Vermeidung von Komplikationen im Verlauf der Behandlung. Hier beschäftigte er sich vor allem mit dem Thema Wunddrainagentechnik und Drainagenmaterial, aber auch allgemein mit den Strategien zur Prophylaxe dieser sogenannten „surgical site infections“ (SSI) zur Vermeidung postoperativer Infektionen. Vor diesem Hintergrund soll infolge der nach wie vor sehr hohen Infektraten chirurgischer Wunden eine wissenschaftlich basierte Analyse der Literatur der letzten fünf Jahre (2011 - 2015) zum Thema Infektvermeidung und Risikominderung postoperativer Infektionen dargestellt werden.
Methodik
Die Recherche wurde auf Publikationen konzentriert, die ein Mindestmaß an qualitativen Ansprüchen erfüllen. Dazu wurden diejenigen Arbeiten ausgewählt, die folgende Kriterien erfüllen:
- Publikation in einem Journal mit klar definierten Autoren-Richtlinien und einer definierten Beschreibung des „Peer-review“ Verfahrens und
- Publikation in einem Journal, das einen „Impact factor“ besitzt.
Die Analyse konzentrierte sich auf das Ergebnis einer computergestützten MEDLINE- (mit PubMed) und EMBASE- sowie Cochrane-Recherche[1] sowie einer umfangreichen Handsuche, bei der die Quellenangaben aller verfügbaren Literaturstellen mitbeurteilt wurden (Schneeballsystem mit fortgesetzter Suche in den Quellenangaben der jeweils eigen-recherchierten Arbeiten). Gegenstand der Suche waren – unabhängig von der Evidenz der jeweiligen Arbeiten (aller Sprachen) – randomisierte klinische und experimentelle Studien, systematische und nicht-systematische Übersichtsarbeiten, Metaanalysen, Expertenmeinungen, Fallberichte, experimentelle Arbeiten (Humanuntersuchungen) sowie Ergebnisberichte von Konsensuskonferenzen. Erfahrungen an Tier-Kollektiven (meistens Hund und Pferd) wurden nicht berücksichtigt.
Bei der Bewertung der Studien wurden die allgemein gültigen biometrischen Anforderungen – wie zum Beispiel Eignung der Hauptzielkriterien für die Aussage, hinreichende Fallzahl, Repräsentativität der Studienpopulation, relevante Dosierungen, Signifikanz des Ergebnisses – berücksichtigt. Erforderlichenfalls musste sie jedoch auch den Besonderheiten der Fragestellung gerecht werden, in denen diese Bewertungskriterien nebensächlich werden mussten.Suchzeitraum und Suchbegriffe (keywords):
Gesucht wurde im Zeitraum 1950 - 2015 (Stand: 1.5.2015). Die dabei verwendeten Suchbegriffe waren in „title“ and „all fields“:
- „Surgical Site Infection“
- „Risk Factor“
- „Infection“
- „Reduction“
- „Postoperative“
Ergebnisse
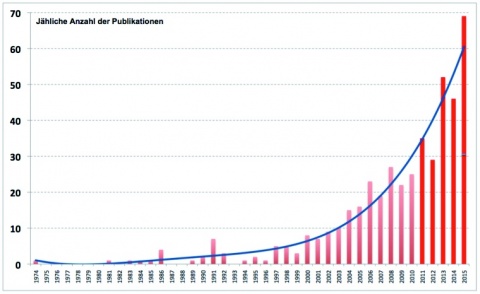
Die Literatur-Recherche mit den genannten Keywords fand als Ergebnis 1 044 Artikel aus den Jahren 1974 - 2015. Die Durchsicht zeigte, dass jedoch nur in 396 Artikeln das Thema Risikofaktoren einer postoperativen Wundinfektion diskutiert wurde. Hier fand sich eine erhebliche Zunahme der Veröffentlichungen in der jüngsten Vergangenheit (Abbildung 1). So wurden in den letzten zehn Jahren mehr als ¾ der Artikel des gesamten 40-jährigen Publikationsintervalls veröffentlicht – und in den hier zum Update ausgewählten fünf Jahren mehr als 50 % aller Publikationen. In diesen knapp 200 Artikeln wurden Erfahrungen bei der Behandlung von etwa 480 000 Patienten gesammelt.
Die Analyse der Artikel zeigt, dass in der Regel nur einzelne Operationsverfahren aus den verschiedenen Facharztkompetenzen des Fachgebietes Chirurgie untersucht wurden, beispielsweise:
Viszeralchirurgie:
Magenchirurgie, Colorectalresektion, laparoskopische Sigmaresektion.
Unfallchirurgie:
Frakturversorgung der unteren Extremität, Therapie der Beckenfraktur.
Orthopädische Chirurgie:
Hüftgelenk- und Kniegelenkersatz.
Auffallend ist, dass beispielsweise die Risikofaktoren der einzelnen „TOP 10“-Eingriffe jeder chirurgischen Facharztkompetenz nicht strukturiert wurden – was aus klinischer Sicht ja wünschenswert wäre. So liegen für die einzelnen Facharztkompetenzen valide Informationen immer nur für einzelne spezielle Beispieloperationen vor. Andererseits wird die Aussage mancher Analysen aber auch dadurch gemindert, dass verschiedene Eingriffe an einem Organ subsummiert werden (zum Beispiel Operationen am Magen). Limitierend für die Gesamtaussage ist auch, dass der Schweregrad der Infektion nicht immer exakt aufgeschlüsselt genannt wird (gemäß CDC-Guidelines: A1 = Postoperative oberflächliche Wundinfektion, A2 = Postoperative tiefe Wundinfektion, A3 = Infektion von Organen und Körperhöhlen im Operationsgebiet).
Als Hintergrundwissen wurden
- die Definition der postoperativen Infektion („surgical site infection“ – SSI; siehe Infokasten),
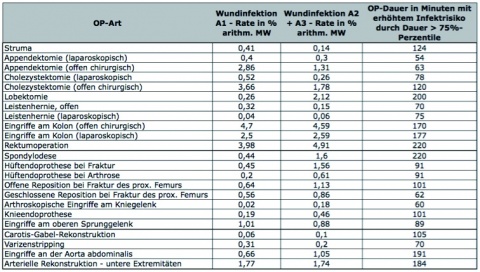
- die in der Bundesrepublik Deutschland aktuell (Referenzdaten 2013) verfügbaren beobachteten Infektionsraten für einzelne vom Nationalen Referenzzentrum (NRZ) für Surveillance von nosokomialen Infektionen ausgewählte Indikatoroperationen (Tabelle 1) und
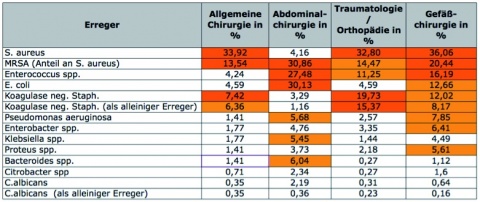
- die häufigsten Erreger (Tabelle 2)
zusammengestellt.
Im Jahre 1995 war in Abstimmung mit der Kommission Infektionsepidemiologie am Robert Koch-Institut (RKI) das NRZ erstmals benannt und durch das Bundesministerium für Gesundheit berufen worden.
Die Funktionen des NRZ für Surveillance von nosokomialen Infektionen werden durch das Institut für Hygiene und Umweltmedizin der Charité-Universitätsmedizin Berlin in Kooperation mit dem Institut für Umweltmedizin und Krankenhaushygiene des Universitätsklinikums Freiburg ausgeübt. Die Verwaltung der Nationalen Referenzzentren obliegt dem RKI (http://www.nrz-hygiene.de/nrz/vorstellung/).
Nachfolgend sollen aus der aktuellen Literatur die wichtigsten Risikofaktoren für eine postoperative Wundinfektion, eher stichwortartig herausgefiltert, dargestellt werden. In der Gesamtsicht können diese Risikofaktoren immer dem individuellen Patienten (zum Beispiel Diabetes), dem operativen Verfahren (zum Beispiel Eröffnen des Darmes) und strukturellen Gegebenheiten des Krankenhauses zugeordnet werden (zum Beispiel saisonale Häufigkeiten der Infektionen) [1].
Allgemeiner Teil
Reduzierter Ernährungsstatus
Der Ernährungsstatus ist heute mehr und mehr ein Thema im Zusammenhang mit der Genese von Wundinfektionen [2, 3]. Klare Empfehlungen werden jedoch bisher noch nicht formuliert. Die hilfreichste Arbeit unterstreicht die Möglichkeit einer Risiko-Stratifizierung für eine postoperative Infektion mittels eines Monitorings des perioperativen Se-rum-präalbumin-Spiegels [3].
Diabetes und Übergewicht
Das Vorliegen eines Diabetes mellitus und von erheblichem Übergewicht muss der Literatur zufolge eindeutig als Risikofaktor angesehen werden [4 - 6]. Die relevanten aktuellen Ergebnisse sind unten im „Speziellen Teil“ bei den einzelnen OP-Verfahren aufgeführt. Interessant ist eine Beobachtung im Rahmen der KHK-Chirurgie: Hier zeigte eine Autorengruppe, wie bedeutend der Glucosespiegel bei der Aufnahme auf der Intensivstation postoperativ war. Sie wiesen nach, dass eine weniger stringente intraoperative Führung des Blutzuckerspiegels mit einer Verdreifachung der Infektrate (von 2,2 % auf 6,9 %) einherging, woraus die Autoren folgerten, dass ein Blutglucosespiegel bei der elektiven Koronar-Arterien-Bypass-Operation von weniger als 8 mmol/L der Zielwert sein sollte [7].
Alter
Das Lebensalter des Patienten wird in aktuellen Arbeiten – multivariablen logistischen Regressionsanalysen zufolge – als unabhängiger Risikofaktor benannt, so zum Beispiel in der Magenchirurgie [8] (Patienten > 75 Jahre), identisch bei offenen Colorektaleingriffen [9] und in der Wirbelsäulenchirurgie [4].
Rauchen
Unsere Literaturrecherche bestätigt die bereits bestehenden Erkenntnisse in der Einschätzung des Rauchens als relevanter Risikofaktor für postoperative Infektionen [9 - 19]. Das relative Risiko, durch Rauchen eine postoperative Infektion zu erleiden, war bis zu 13,2-fach erhöht. Nur in einzelnen Untersuchungen zeigte sich nicht immer ein eindeutiger Zusammenhang zwischen Nikotinabusus und erhöhter postoperativer Infektrate.
MRSA-Kolonisation
In der elektiven orthopädischen Chirurgie sollten Patienten präoperativ über ihre (dann auch festzustellende) MRSA-Kolonisation informiert und über das erhöhte postoperative Infekt-Risiko aufgeklärt werden [20]. Bei größeren dermatologischen Eingriffen zeigte sich, dass die Infektrate bei nicht behandelten S.aureus-Trägern 11 % betrug, mit 4 % hoch signifikant niedriger in behandelten MRSA-Trägern sowie mit 3 % in den Nicht-MRSA Trägern lag. In der Gesamtsicht wird die -MRSA-Kolonisation des Nasen- und Rachenraums als bedeutender unabhängiger Risikofaktor für eine SSI angesehen (relative Risikoerhöhung 3- bis 11-fach) [21 - 24].
HIV
Es gibt bisher keinen Anhalt dafür, dass der Nachweis einer HIV-Infektion an sich als unabhängiger Faktor das SSI-Risiko erhöht [25, 26]. Hier sind weitere Studien erforderlich. Zu bedenken ist zudem, dass im Falle einer HIV-Infektion neben der direkt krankheits-assoziierten Immunkompromitierung auch andere ansonsten unabhängige Risikofaktoren für eine SSI vorliegen. So ist der „American Society of Anesthesiologists preoperative assessment score“ (ASA-Klassifikation) sowie der nutritive Status des Patienten in der Regel vermindert und relevante ungünstige Begleitfaktoren (Rauchen, Drogenabusus, ...) bestehen ebenfalls.
Präoperative Antibiotikaprophylaxe (PABP)
Die Erhöhung der SSI-Rate durch eine nicht durchgeführte präoperative Antibiotikaprophylaxe ist bei folgenden Operationen bestätigt:
- Appendektomie [27],
- Open Reduction & Internal Fixation (ORIF) in der Orthopädie und Unfallchirurgie mit erhöhten Infektrisiko (die PABP hat bei ORIF-Eingriffen in der Orthopädie und Unfallchirurgie mit niedrigem Infektrisiko keinen Nutzen) [28],
- Nierentransplantation [29],
- Sectio caesarea [30].
Der Effekt des exakten Timings der präoperativen Antibiotika-Prophylaxe darf nicht überbewertet werden [31]. Interessant ist die inhaltliche Zusammenführung zweier Aspekte des Themas Infektprophylaxe und Antibiotikaprophylaxe: Adipositas-Patienten zeigen eine verminderte Gewebe-Penetration des in der Regel gegebenen Cefoxitin mit der Folge einer meist inadäquaten Gewebekonzentrationen trotz schon erhöhter Dosis (2 g). Hier sind weitere Studien notwendig, um bei diesem Patientenkollektiv die erforderlichen Dosen festlegen zu können [32].
Dauer der Operation
Zahlreiche Autoren berechnen als unabhängiges Risiko eine überlange OP-Zeit [4, 19, 33 - 40]. Dieses Ergebnis wird dadurch unterstrichen, in dem die „OP-Dauer länger als die 75 %-Perzentile“ dieser OP neben der ASA-Klassifikation (ASA > 2) und der Wundkontaminationsklasse (> 2) die drei Faktoren sind, die vom NRZ für die Surveillance von nosokomialen Infektionen in das Surveillance-Programm aufgenommen wurden.
Drainagen
Der Nutzen intraabdomineller geschlossener Sogdrainagen kann nicht mit einer verminderten postoperativen Infektrate verbunden werden [41]. Gleiches gilt für den Hüftgelenksersatz [42]. Nach Kniegelenksersatz besteht eine erhöhte Infektrate durch Drainagen [43].
In der Mammachirurgie sollte eine exakte und kritische Indikationsstellung für das Einlegen einer Drainage bestehen [44]. Angaben zur erlaubten Dauer der Drainageninsertion sind nicht aktuell [45]. Die Darstellung, dass eine verlängerte Liegezeit einer Redondrainage mit einem erhöhten postoperativen Infektionsrisiko einhergeht, ist 40 Jahre alt und hat sich bisher nicht bestätigt.
Hygiene im OP
In einer kleinen Studie wird gezeigt, dass die Infektrate von Gelenkeingriffen nicht erhöht wird, wenn unmittelbar zuvor im gleichen Saal eine OP zur Therapie einer tiefen Infektsituation durchgeführt wurde [46]. Weitere Studien sind durch die Autoren gefordert worden.
Das Propionibacterium acnes ist ein zunehmend häufiger nachgewiesenes Pathogen bei SSI, besonders in Beziehung zu Gelenkersatzoperationen und Operationen an der Wirbelsäule (dieses ist in der NRZ-Zusammenstellung in Tabelle 2 noch nicht aufgeführt). Aufgrund seiner geringen Virulenz und Wachstumsverhalten können klinische Anzeichen für einen Infekt kaum erkennbar sein, so dass letztlich die Diagnosefindung eine Herausforderung darstellt [47].
Ergebnisse anderer Länder
Auffallend ist, dass gleiche Operationen in verschiedenen Ländern vollkommen divergente Infektionsraten zeigen. So folgt der Sectio caesarea in England eine postoperative Infektion in 9,6 % der Einriffe [48], während in der medizinisch relativ gut versorgten Provinz Guangzhou (China) beispielsweise die Rate mit 0,7 % angegeben wird [49]. Auch Über-Alle-Prozeduren-Hinweg-Infektraten sind stark unterschiedlich. So zeigt eine Arbeit aus dem Niger eine SSI-Rate von 25,2 % [50] und aus einem anderen Entwicklungsland 10,8 % [51], während in uns näher stehenden Ländern eine Rate von 1,0 - 1,8 % im Mittel angegeben wird [1, 52, 53].
Saisonale Häufigkeiten
Nur drei Arbeiten der gesamten Literatur gehen auf beobachtete saisonale Häufigkeiten postoperativer Infekte ein. Zwei Veröffentlichungen aus den USA zeigen, dass im August und September eine Häufung bestand (Herz- und Wirbelsäulenchirurgie) [54, 55]. Eine Arbeit aus Nigeria (allgemeines operatives Spektrum) zeigte allerdings gerade im August die geringste Infektrate und die höchste im März [50].
Spezieller Teil
Unfallchirurgie / Orthopädie
Aufgrund der Akutheit der Verletzung sind in der „Notfallsituation Unfallchirurgie“ viele Risikofaktoren präoperativ nicht beeinflussbar (Patienten bedingte Komorbiditäten wie Diabetes, Übergewicht, Herzinsuffizienz), was jedoch auch für die Chirurgie-abhängigen Faktoren (Anzahl der Operationen, Ort der Operation) gilt [56].
Untersuchte Tourniquetbinden zeigten einen erheblichen Kontaminationsgrad (Koagulase-negative staphylococci, Staphylococcus aureus, Bacillus, Pseudomonas aeruginosa, Acinetobacter baumanii, enterococci, enterobacteriae und Candida [57].
Für die Versorgung einer Pilonfraktur wird eine Infektrate von 5,88 % angegeben [39]. Als einziger unabhängiger Risikofaktor wurde die OP-Zeit berechnet. Der Versuch mit einer intraoperativen 80 %-FIO2-Beatmung[2] (und 2-stündigen Nachbeatmung) durch bessere Oxygenationsbedingungen bei Tibiaplateau-, Pilon- und Calcaneusfrakturen die Infektrate zu senken, führte im Vergleich zur Kontrollgruppe (30 %-FIO2-Beatmung) zu keinem signifikanten Benefit. Die Infektrate betrug in dieser Studie insgesamt 14 % [58]. Die Infektrate dieser durch höher energetische axiale Stauchungstraumata verursachten Frakturen wurden auch von Paryavi et al. 2013 untersucht. Die Autorengruppe zeigte, dass mit „C3“[3] klassifizierte Frakturen (odds ratio 5,4), eine ASA-Klassifikation > 3 (odds ratio 2,9) sowie ein body mass index (BMI) > 30 kg/m2 (odds ratio 3,5) unabhängige Risikofrakturen sind [59]. Die offiziell allgemein für die Chirurgie erarbeiteten NNIS System scores[4] waren den Autoren zufolge weniger prädiktiv für SSI-Raten in der Unfallchirurgie. Bei der Versorgung von Sprunggelenkfrakturen wurden als Risikofaktoren Rauchen (odds-ratio 3,7) und eine OP-Dauer > 90 min (odds ratio 2,5), was identisch mit der Einschätzung des NRZ für nosokomiale Infektionen ist [19]. Andere Autoren nennen weibliches Geschlecht und höheres Lebensalter als Risiko [60]. Die Anlage eines Gipses bereits im Operationssaal führte als unabhängiger Faktor zu einer Minderung der SSI-Rate [19].
Risikofaktoren in der Wirbelsäulenchirurgie sind: inadäquater Gebrauch von Antibiotika, die Therapie einer neuromuskulären Skoliose und ein verlängerter Krankenhausaufenthalt [61]. Unabhängige Risikofaktoren sind zudem: präoperative Steroidtherapie, spinales Tauma, männliches Geschlecht und eine OP-Zeit von > 3 Stunden [37]. Interessant ist die Beobachtung von Radcliff et al., die eine präoperative „in room time“ im OP-Saal von > 1 Stunde als weiteren unabhängigen Risikofaktor berechneten. Sie erkannten in ihrem großen Patientenkollektiv (n = 7 991) auch eine gehäufte Infektrate im August und September [55]. Interessant ist eine aktuelle Arbeit (2015), in der durch die Nutzung von Jod-imprägniertem Instrumentarium eine Senkung der Infektrate von 12,5 % auf 1,4 % genannt wird [62]. Wie in allen Bereichen der operativen Medizin zeigte sich der BMI auch in der Wirbelsäulenchirurgie für die Prädiktion der Infektrate als bedeutsam. Ein Anstieg von je fünf units im BMI war mit einem relativen Anstieg der Infektrate von 13 % verbunden (gepoolt mit Diabetes waren es 21 %) [63]. Wie differenziert man mit dem allgegenwärtigen Risikofaktor Körpergewicht umgehen muss, erkennt man durch die Analyse von Mehta et al. Sie konnten die Obesitas (body mass index > 30 kg/m2) nicht als signifikanten Risikofaktor nachweisen, allerdings die Dicke des subkutanen Fettgewebes im Bereich des OP-Gebietes bei Halswirbelsäulen-Fusionen [64]. Das Vorliegen eines Diabetes mellitus ist auch für die Wirbelsäulenchirurgie von Bedeutung. So zeigten Hikata et al., dass Patienten mit einem Diabetes eine gegenüber Gesunden weitaus höhere postoperative Infektrate hatten (16,7 % versus 3,2 %). Sie wiesen jedoch ganz besonders auf die herausragende Bedeutung der optimalen Glucosekonzentrations-Einstellung hin. So gaben sie für Patienten mit einem präoperativen HbA1c von < 7,0 % eine SSI-Rate von 0,0 % an, während bei Werten des HbA1c von ≥ 7,0 % die Infektrate bei 35,3 % lag. Daher fordern sie, vor der OP das HbA1c auf Werte von unter 7,0 % zu senken [65].
Auch in der Literatur zur Endoprothesenversorgung wird in zahlreichen Arbeiten auf die hier diskutierte Problematik eingegangen. Vielfach genannt ist die ausgeprägte Adipositas (BMI > 30 kg/m2) mit einer Adipositas bedingten SSI-RatenErhöhung auf 18 % (versus 2 % in der Kontrollgruppe) und im Falle von Revisionseingriffen auf 42 % (versus 11 %) [5]. Einer sehr interessanten Frage ging die Arbeitsgruppe von Inacio et al. (2014) nach. Sie untersuchten den Effekt der präoperativen Gewichtsreduktion vor dem Gelenkersatz auf die postoperative Infektrate und stellten ein 3,77-fach höheres Risiko für einen tiefen postoperativen Infekt fest [66]. Dieses Ergebnis sollte zumindest den Sinn der Aufforderung zur Gewichtsreduktion vor einer elektiven Gelenkersatzoperation in Frage stellen. Im Kniegelenk sind frühere Operationen, das männliche Geschlecht, verbliebenes Implantatmaterial sowie der BMI von großer Bedeutung [67]. Ein niedriger präoperativer Hämoglobinwert ist ein Risiko und sollte präoperativ ausgeglichen werden [68]. Das American Academy of Orthopaedic Surgery Patient Safety Committee geht vor allem von den Risikofaktoren Fettsucht, Anämie, Unter- und Fehlernährung sowie Diabetes aus [69]. Ein weiterer Risikofaktor ist das gleichzeitige operative Vorgehen auf beiden Seiten [70] und die vorherige Operationen am ipsilateralen Gelenk [71]. Die Arbeitsgruppe zeigte auch, dass eine Mindestzahl an Eingriffen des einzelnen Chirurgen oder des Hauses, der Gebrauch von antibiotikahaltigem Knochenzement, die Ausstattung des OP-Saals mit Laminar Air Flow und besondere Trainingsmaßnahmen zur Verbesserung der OP- Technik nicht mit dem Infekt-Risiko verbunden sind. Über die genannten Faktoren hinaus werden für die Hüftendoprothetik Erkrankungen des rheumatischen Formenkreises und Gerinnungsstörungen genannt [72].
Beckenring- und Acetabulumfrakturen führen zu tiefen Infektionen in 2,8 % der Fälle [73]. Noch vor einem BMI von > 30 kg/m2 ist die präoperative Angioembolization der wichtigste Risikofaktor (odds-ratio von 11) [73]. Auch die Kombination der Versorgung von Beckenring und Acetabulumfrakturen geht mit einem erhöhten Risiko einher [74]. Die Autoren empfehlen, dass die Embolisation der Arteria iliaca in jedem Fall vermieden werden muss.
In der muskuloskeletalen Tumor Chirurgie mit Infektraten zwischen 0,32 % und 12,2 % der Operationen von benignen und malignen Tumoren werden vier relevante Risikofaktoren genannt: Blutverlust bei der OP, die OP-Dauer, die präoperative Chemotherapie und die Implantation von künstlichen Materialien [34].
Allgemein- und Viszeralchirurgie
Allgemein haben „midline incisions“ über und unter dem Nabel vergleichsweise die höchste Prävalenz von Infektionen [75].
Bei den ventralen Hernien-Operationen sind als Prädiktoren für eine SSI ausgedehntere Weichgewebe-Dissektionen der Bauchwand, die Bildung von Hautlappen, ein ASA-Score von > 2 und ein BMI von > 40 kg/m2 zu nennen [76]. Auch bei diesen Patienten (vor allem bei „component separation ventral hernia repair“ mit einer SSI-Rate von 31 %) zeigt sich, dass differenziertere morphometrische Angaben wie die lokale Fettverteilung im OP-Gebiet (Ausmaß der subkutanen Fettschicht im OP-Gebiet, Körper-Umfang) von größerem prädiktiven Wert sind als der BMI [77]. Im Rahmen der Versorgung der inkarzerierten Hernie zeigte sich als häufigster Erreger E. coli. Ein Netz könne nach Feststellung der Autoren dann zur Hernienversorgung verwendet werden, wenn keine Darmresektion durchgeführt wurde, die klinischen Symptome weniger als 24 Stunden andauerten und die Flüssigkeit im Herniensack klar war [78].
Risikofaktor bei Ösophagus-Carcinom-OP für eine post-ope-ra-tive Wundinfektion ist eine erhöhte Blut-Glucose-Konzentra-tion am dritten postoperativen Tag [79].
Bei einer Hepatektomie und kleinerer Leberresektion fand man als unabhängige Faktoren die Hepatolithiasis, Zirrhose, intraoperative Bluttransfusion [80], wiederholte Lebereingriffe, eine Operationszeit von ≥ 280 min und die Gallengangsleckage [40]. Für die Pankreatikoduodenektomie wurde als unabhängiges Risiko für SSI das präoperative nutritive Defizit genannt [81].
Die meisten der viszeralchirurgische Operationen betreffenden Publikationen beschäftigen sich in diesem Zusammenhang mit den Kolorektaleingriffen. Die relevanten Risikofaktoren sind beim Notfalleingriff die Wundkontaminationsklasse III und IV, ein BMI ≥ 25 kg/m2, die ASA-Klasse ≥ 3, chronische Niereninsuffizienz (Serum Creatinin-Konzentration > 1,2 mg/dL), Blutverlust und die intraoperative Bluttransfusion [82]. Die Arbeitsgruppe empfiehlt vor diesem Hintergrund den primären Hautverschluss in der Notfallsituation nur bei lokaler, gering ausgedehnter Kontamination. Laparoskopische Colorektaleingriffe zeigen eine geringere Infektrate als offene Eingriffe [83]. Speziell bei Colitis ulcerosa Patienten ergab sich als einziger signifikanter Risikofaktor die Bewertung nach ASA-Klasse ≥ 3 [34].
Die meistgenannten Risikofaktoren waren [9, 83, 85]:
- Schwerste intraoperative Kontamination,
- Kontamination Klasse 3 - 4,
- BMI über 30 kg/m2
- ASA-Klasse 3 und 4,
- offene Kolorektal-Chirurgie,
- präoperativ geringer Hämatokrit,
- Nikotinabusus,
- Alter über 75 Jahre.
Positiv wirkte sich die Verwendung von Wundrand-Protektoren aus (odds ratio von 1,646) [83].
Wahre Worte sind nicht schön.
Schöne Worte sind nicht wahr.
Gute Menschen streiten nicht.
Jene, die streiten sind nicht gut.
Jene, die wissen sind nicht gelehrt.
Die Gelehrten wissen nicht.
Tao Te King, 81. Kapitel
Lao Tse (6. Jhdt v. Chr., Kaiserlicher Archivar,
älterer Zeitgenosse des Konfuzius)
Diskussion und Fazit für die Praxis
Eine auf alle Einzelheiten eingehende Diskussion der hier zusammengestellten Daten ist im Rahmen eines kleinen Beitrages unmöglich und wird der multifaktoriellen hochkomplexen Dynamik des postoperativen Infektgeschehens nicht gerecht. In der Gesamtsicht bestätigen sich die bereits in den Vorjahren publizierten und daher bekannten Risikofaktoren.
Ganz klar kristallisiert sich auch in der aktuellsten Literatur heraus, dass die Kombination zweier chirurgischer Eigenschaften, der alten chirurgischen Tugend entsprechend, sehr effektive Maßnahmen zur Infektvermeidung sind: Die schnell durchgeführte erfolgreiche Operation und ein geringer intraoperativer Blutverlust – und das kann nur durch einen hohen „case load“ erreicht werden.
Andererseits zeigt sich eine zunehmende Detailliertheit der Definition von Risikofaktoren (zum Beispiel das Ausmaß der subkutanen Fettschicht im OP-Bereich anstelle des BMI). Die durch das NRZ für die Surveillance von nosokomialen Infektionen gelebte Einschränkung auf die dort lediglich genannten drei Risikofaktoren (Kontaminationsklasse, OP-Dauer und ASA-Klassifikation) wird dem aktuellen Wissenstand nicht gerecht. Bei bestimmten Patientengruppen könnte das präoperative Wissen um das Vorliegen von Risikofaktoren zur präziseren Risikoeinschätzung führen. Hierfür erforderliche diagnostische Maßnahmen müssten dann standardisiert in die eigenen Routineabläufe aufgenommen werden (zum Beispiel Messung des Präalbumin-Serumspiegels, MRSA-Kolonisations-Prüfung bei allen Patienten?). Andere Fakten zeigen, dass eine präoperative Antibiotikaprophylaxe (PABP) nicht stereotyp bei allen Operationen gegeben werden muss. So sollte die PABP-Indikation individuell kritisch durchdacht sein (Keine Gabe bei einer an sich 0 %-Risiko-OP und Dosisanpassung bei Übergewichtigen sowie nutritiv schlecht perfundiertem OP-Areal).
In der Gesamtsicht kann man nur jeder Fachabteilung/Klinik empfehlen, ganz gezielt individuell an das eigene Patienten-spektrum, die jeweils häufigsten Operationen (z. B. „Top-10“-Liste) und die hausinternen Möglichkeiten der präoperativen Diagnostik sowie an die organisatorische Abläufen angepasst, einen klinikadaptierten SSI-Risiko-Score zu entwickeln, wie es bereits einige Autorengruppen machten [28, 34, 86 - 88]. Tatsächlich müssen in der Zukunft noch erhebliche Anstrengungen unternommen werden, um vor allem in Risikopatienten-Kollektiven eine spürbare Infektratenminderung zu erzielen [89, 90]. So zeigen sich beispielsweise in dem Hochrisiko-Patientenkollektiv mit einer offenen Fraktur vom Typ III (a - c) nach Gustilo-Anderson (schwerer Weichgewebeschaden, bleibender Weichgewebedefekt, arterielle Zusatzverletzung) im Vergleich mit den Infektraten der Jahre 1976 - 1994 mit 5 - 50 % auch heute noch (2008 - 2012) ähnlich hohe Infektraten von 1,8 - 45,7 % [91]. Diese unbefriedigende Situation besteht trotz veränderter Rettungsstruktur, frühzeitiger Schmerztherapie, optimaler Beatmung, optimal angepasster Antibiotikaprophylaxe und gewebeschonenderen Operationsverfahren mit Verwendung moderner Implantattechnologie. Sie kann naturgemäß auch nicht nur durch eine optimale Berücksichtigung der hier nun etwas detaillierter dargestellten Risikofaktoren verbessert werden, sondern erfordert auch weitere Maßnahmen der Infektprophylaxe, die sich heute bereits in der Literatur andeuten, jedoch noch keineswegs etabliert sind, wie z. B. im Sinne eines Brainstormings:
- Wundspülungen mit Antiseptika als Prophylaxe,
- Verwendung von Bakteriophagen,
- Einsatz antimikrobieller Peptide,
- Spülung der Wunden mit „Anti-quorum sensing“ Substanzen (als Maßnahme gegen den sich teilweise bereits frühzeitig entwickelnden Biofilm auch in akuten Wunden),
- Spülung der Wunden mit Licht über „Schwämmen“ aus Glasfasern zur Nutzung photodynamischer Effekte,
- Erlernen einer Kommunikation mit den die Wunde kolonisierenden Bakterien und mit den Erregern, die sich (als „Schläfer“) intrazellulär in körpereigenen Zellen vorübergehend „zur Ruhe legen“.
Hier stehen wir in vielerlei Hinsicht ganz am Anfang des medizinischen Wissens. Umso mehr müssen auch Anstrengungen des Sanitätsdienstes erfolgen, um zu einer positiven Entwicklung in der Behandlung der in der Regel ja besonders infektgefährdeten verwundeten Soldaten beizutragen. Und so kommen wir wieder zum Anfang diesen kleinen Beitrages. Unser chirurgischer Lehrer Heinz Gerngroß war der Überzeugung gewesen, dass
Wissen durch Forschung und akademisch kritisches Denken zukunftsfähig macht.
Wir sollten uns dieses Credo zu eigen machen und neben dem oben angesprochenen hohen täglichen „work-load“ in der Klinik eigene Forschungs-Strukturen mit entsprechenden Ressourcen realisieren. Nur so können wir den für uns relevanten wissenschaftlichen Fragen auch unter den heutigen, veränderten Bedingungen des Berufslebens nachgehen, zum Beispiel um Artikel wie diesen auch in der Zukunft zu erarbeiten und um unsere Ergebnisse sehr schnell in den klinischen Alltag leiten zu können. Nur hierdurch werden wir den Sanitätsdienst leistungsfähig erhalten und unserer Sorgfaltspflicht gegenüber dem Soldatenpatienten gerecht werden.
Literatur
- Saunders L, Perennec-Olivier M, Jarno P, et al. Improving prediction of surgical site infection risk with multilevel modeling. PloS one. 2014; 9: e95295.
- Lee JI, Kwon M, Roh JL, et al. Postoperative hypoalbuminemia as a risk factor for surgical site infection after oral cancer surgery. Oral diseases. 2015; 21: 178-184.
- Tempel Z, Grandhi R, Maserati M, et al. Prealbumin as a serum biomarker of impaired perioperative nutritional status and risk for surgical site infection after spine surgery. Journal of neurological surgery Part A, Central European neurosurgery. 2015; 76: 139-143.
- Dubory A, Giorgi H, Walter A, et al. Surgical-site infection in spinal injury: incidence and risk factors in a prospective cohort of 518 patients. European spine journal : official publication of the European Spine Society, the European Spinal Deformity Society, and the European Section of the Cervical Spine Research Society. 2015; 24: 543-554.
- Houdek MT, Wagner ER, Watts CD, et al. Morbid obesity: a significant risk factor for failure of two-stage revision total hip arthroplasty for infection. The Journal of bone and joint surgery American volume. 2015; 97: 326-332.
- Watts CD, Wagner ER, Houdek MT, et al. Morbid obesity: a significant risk factor for failure of two-stage revision total knee arthroplasty for infection. The Journal of bone and joint surgery American volume. 2014; 96: e154.
- Ng RR, Myat Oo A, Liu W, Tan TE, Ti LK and Chew ST. Changing glucose control target and risk of surgical site infection in a Southeast Asian population. The Journal of thoracic and cardiovascular surgery. 2015; 149: 323-328.
- Endo S, Tsujinaka T, Fujitani K, et al. Risk factors for superficial incisional surgical site infection after gastrectomy: analysis of patients enrolled in a prospective randomized trial comparing skin closure methods. Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association. 2015.
- Hedrick TL, Sawyer RG, Friel CM and Stukenborg GJ. A method for estimating the risk of surgical site infection in patients with abdominal colorectal procedures. Diseases of the colon and rectum. 2013; 56: 627-637.
- Angeles-Garay U, Morales-Marquez LI, Sandoval-Balanzarios MA, Velazquez-Garcia JA, Maldonado-Torres L and Mendez-Cano AF. [Risk factors related to surgical site infection in elective surgery]. Cirugia y cirujanos. 2014; 82: 48-62.
- Durand F, Berthelot P, Cazorla C, Farizon F and Lucht F. Smoking is a risk factor of organ/space surgical site infection in orthopaedic surgery with implant materials. International orthopaedics. 2013; 37: 723-727.
- Heal CF, Buettner PG and Drobetz H. Risk factors for surgical site infection after dermatological surgery. International journal of dermatology. 2012; 51: 796-803.
- Popeskou S, Christoforidis D, Ruffieux C and Demartines N. Wound infection after excision and primary midline closure for pilonidal disease: risk factor analysis to improve patient selection. World journal of surgery. 2011; 35: 206-211.
- Edmonston DL and Foulkes GD. Infection rate and risk factor analysis in an orthopaedic ambulatory surgical center. Journal of surgical orthopaedic advances. 2010; 19: 174-176.
- Miceli MH, Dong L, Grazziutti ML, et al. Iron overload is a major risk factor for severe infection after autologous stem cell transplantation: a study of 367 myeloma patients. Bone marrow transplantation. 2006; 37: 857-864.
- Luksamijarulkul P, Parikumsil N, Poomsuwan V and Konkeaw W. Nosocomial surgical site infection among Photharam Hospital patients with surgery: incidence, risk factors and development of risk screening form. Journal of the Medical Association of Thailand = Chotmaihet thangphaet. 2006; 89: 81-89.
- Haas JP, Evans AM, Preston KE and Larson EL. Risk factors for surgical site infection after cardiac surgery: the role of endogenous flora. Heart & lung : the journal of critical care. 2005; 34: 108-114.
- Sorensen LT, Horby J, Friis E, Pilsgaard B and Jorgensen T. Smoking as a risk factor for wound healing and infection in breast cancer surgery. European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 2002; 28: 815-820.
- Ovaska MT, Makinen TJ, Madanat R, et al. Risk factors for deep surgical site infection following operative treatment of ankle fractures. The Journal of bone and joint surgery American volume. 2013; 95: 348-353.
- Akhtar A, Kadir H and Chandran P. Surgical site infection risk following pre-operative MRSA detection in elective orthopaedic surgery. Journal of orthopaedics. 2014; 11: 117-120.
- Tai YJ, Borchard KL, Gunson TH, Smith HR and Vinciullo C. Nasal carriage of Staphylococcus aureus in patients undergoing Mohs micrographic surgery is an important risk factor for postoperative surgical site infection: a prospective randomised study. The Australasian journal of dermatology. 2013; 54: 109-114.
- Kalra L, Camacho F, Whitener CJ, et al. Risk of methicillin-resistant Staphylococcus aureus surgical site infection in patients with nasal MRSA colonization. American journal of infection control. 2013; 41: 1253-1257.
- Yano K, Minoda Y, Sakawa A, et al. Positive nasal culture of methicillin-resistant Staphylococcus aureus (MRSA) is a risk factor for surgical site infection in orthopedics. Acta orthopaedica. 2009; 80: 486-490.
- Munoz P, Hortal J, Giannella M, et al. Nasal carriage of S. aureus increases the risk of surgical site infection after major heart surgery. The Journal of hospital infection. 2008; 68: 25-31.
- Kigera JW, Straetemans M, Vuhaka SK, Nagel IM, Naddumba EK and Boer K. Is there an increased risk of post-operative surgical site infection after orthopaedic surgery in HIV patients? A systematic review and meta-analysis. PloS one. 2012; 7: e42254.
- Saraux A, Taelman H, Blanche P, et al. HIV infection as a risk factor for septic arthritis. British journal of rheumatology. 1997; 36: 333-337.
- Nystrom PO and Brote L. Postoperative wound infection after appendicectomy. Evaluation of infection risk with qualitative and quantitative incisional wound culture. Acta chirurgica Scandinavica. 1981; 147: 61-65.
- Xu SG, Mao ZG, Liu BS, Zhu HH and Pan HL. Evaluating the use of antibiotic prophylaxis during open reduction and internal fixation surgery in patients at low risk of surgical site infection. Injury. 2015; 46: 184-188.
- Freire MP, Antonopoulos IM, Piovesan AC, et al. Amikacin prophylaxis and risk factors for surgical site infection after kidney transplantation. Transplantation. 2015; 99: 521-257.
- Farret TC, Dalle J, da Silva Monteiro V, Riche CV and Antonello VS. Risk factors for surgical site infection following cesarean section in a Brazilian Women's Hospital: a case-control study. The Brazilian journal of infectious diseases : an official publication of the Brazilian Society of Infectious Diseases. 2015; 19: 113-117.
- Hawn MT, Richman JS, Vick CC, et al. Timing of surgical antibiotic prophylaxis and the risk of surgical site infection. JAMA surgery. 2013; 148: 649-657.
- Toma O, Suntrup P, Stefanescu A, London A, Mutch M and Kharasch E. Pharmacokinetics and tissue penetration of cefoxitin in obesity: implications for risk of surgical site infection. Anesthesia and analgesia. 2011; 113: 730-737.
- Tserenpuntsag B, Haley V, Van Antwerpen C, et al. Surgical site infection risk factors identified for patients undergoing colon procedures, New York State 2009-2010. Infection control and hospital epidemiology. 2014; 35: 1006-1012.
- Nagano S, Yokouchi M, Setoguchi T, et al. Analysis of surgical site infection after musculoskeletal tumor surgery: risk assessment using a new scoring system. Sarcoma. 2014; 2014: 645496.
- Jeong SJ, Ann HW, Kim JK, et al. Incidence and risk factors for surgical site infection after gastric surgery: a multicenter prospective cohort study. Infection & chemotherapy. 2013; 45: 422-430.
- Jen HJ, Wang KW, Huang SH and Chen YY. [Thyroidectomies: surgical site infection risk factors of using prophylactic antibiotics]. Hu li za zhi The journal of nursing. 2011; 58: 33-42.
- Ogihara S, Yamazaki T, Maruyama T, et al. Prospective multicenter surveillance and risk factor analysis of deep surgical site infection after posterior thoracic and/or lumbar spinal surgery in adults. Journal of orthopaedic science : official journal of the Japanese Orthopaedic Association. 2015; 20: 71-77.
- Meng F, Cao J and Meng X. Risk factors for surgical site infection following pediatric spinal deformity surgery: a systematic review and meta-analysis. Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2015; 31: 521-527.
- Liang Y, Fang Y, Tu CQ, Yao XY and Yang TF. [Analyzing risk factors for surgical site infection following Pilon fracture surgery]. Zhongguo Gu Shang. 2014; 27: 650-653.
- Sadamori H, Yagi T, Shinoura S, et al. Risk factors for organ/space surgical site infection after hepatectomy for hepatocellular carcinoma in 359 recent cases. Journal of hepato-biliary-pancreatic sciences. 2013; 20: 186-196.
- Mohseni S, Talving P, Kobayashi L, et al. Closed-suction drain placement at laparotomy in isolated solid organ injury is not associated with decreased risk of deep surgical site infection. The American surgeon. 2012; 78: 1187-1191.
- Dowsey MM and Choong PF. Obesity is a major risk factor for prosthetic infection after primary hip arthroplasty. Clinical orthopaedics and related research. 2008; 466: 153-158.
- Minnema B, Vearncombe M, Augustin A, Gollish J and Simor AE. Risk factors for surgical-site infection following primary total knee arthroplasty. Infection control and hospital epidemiology. 2004; 25: 477-480.
- Teija-Kaisa A, Eija M, Marja S and Outi L. Risk factors for surgical site infection in breast surgery. Journal of clinical nursing. 2013; 22: 948-57.
- Kaufner HK and Friedrich B. [Does prolonged insertion of the Redon drain increase the postoperative risk of infection?]. Der Chirurg; Zeitschrift fur alle Gebiete der operativen Medizen. 1974; 45: 137-138.
- Abolghasemian M, Sternheim A, Shakib A, Safir OA and Backstein D. Is arthroplasty immediately after an infected case a risk factor for infection? Clinical orthopaedics and related research. 2013; 471: 2253-2258.
- Bowler PG, Welsby S, Hogarth A and Towers V. Topical antimicrobial protection of postoperative surgical sites at risk of infection with Propionibacterium acnes: an in-vitro study. The Journal of hospital infection. 2013; 83: 232-237.
- Wloch C, Wilson J, Lamagni T, Harrington P, Charlett A and Sheridan E. Risk factors for surgical site infection following caesarean section in England: results from a multicentre cohort study. BJOG : an international journal of obstetrics and gynaecology. 2012; 119: 1324-1333.
- Gong SP, Guo HX, Zhou HZ, Chen L and Yu YH. Morbidity and risk factors for surgical site infection following cesarean section in Guangdong Province, China. The journal of obstetrics and gynaecology research. 2012; 38: 509-515.
- Nwankwo E and Edino S. Seasonal variation and risk factors associated with surgical site infection rate in Kano, Nigeria. Turkish journal of medical sciences. 2014; 44: 674-680.
- Alp E, Elmali F, Ersoy S, Kucuk C and Doganay M. Incidence and risk factors of surgical site infection in general surgery in a developing country. Surgery today. 2014; 44: 685-689.
- Ercole FF, Franco LM, Macieira TG, Wenceslau LC, de Resende HI and Chianca TC. Risk of surgical site infection in patients undergoing orthopedic surgery. Revista latino-americana de enfermagem. 2011; 19: 1362-1368.
- Ercole FF, Chianca TC, Duarte D, Starling CE and Carneiro M. Surgical site infection in patients submitted to orthopedic surgery: the NNIS risk index and risk prediction. Revista latino-americana de enfermagem. 2011; 19: 269-276.
- Hogle NJ, Cohen B, Hyman S, Larson E and Fowler DL. Incidence and risk factors for and the effect of a program to reduce the incidence of surgical site infection after cardiac surgery. Surgical infections. 2014; 15: 299-304.
- Radcliff KE, Rasouli MR, Neusner A, et al. Preoperative delay of more than 1 hour increases the risk of surgical site infection. Spine. 2013; 38: 1318-1323.
- Bachoura A, Guitton TG, Smith RM, Vrahas MS, Zurakowski D and Ring D. Infirmity and injury complexity are risk factors for surgical-site infection after operative fracture care. Clinical orthopaedics and related research. 2011; 469: 2621-2630.
- Sahu SK, Tudu B and Mall PK. Microbial colonisation of orthopaedic tourniquets: a potential risk for surgical site infection. Indian journal of medical microbiology. 2015; 33 Suppl: 115-118.
- Stall A, Paryavi E, Gupta R, Zadnik M, Hui E and O'Toole RV. Perioperative supplemental oxygen to reduce surgical site infection after open fixation of high-risk fractures: a randomized controlled pilot trial. The journal of trauma and acute care surgery. 2013; 75: 657-663.
- Paryavi E, Stall A, Gupta R, et al. Predictive model for surgical site infection risk after surgery for high-energy lower-extremity fractures: development of the risk of infection in orthopedic trauma surgery score. The journal of trauma and acute care surgery. 2013; 74: 1521-1527.
- Kelly EG, Cashman JP, Groarke PJ and Morris SF. Risk factors for surgical site infection following operative ankle fracture fixation. Irish journal of medical science. 2013; 182: 453-456.
- Subramanyam R, Schaffzin J, Cudilo EM, Rao MB and Varughese AM. Systematic review of risk factors for surgical site infection in pediatric scoliosis surgery. The spine journal : official journal of the North American Spine Society. 2015.
- Hayashi H, Murakami H, Demura S, et al. Surgical site infection after total en bloc spondylectomy: risk factors and the preventive new technology. The spine journal : official journal of the North American Spine Society. 2015; 15: 132-137.
- Abdallah DY, Jadaan MM and McCabe JP. Body mass index and risk of surgical site infection following spine surgery: a meta-analysis. European spine journal : official publication of the European Spine Society, the European Spinal Deformity Society, and the European Section of the Cervical Spine Research Society. 2013; 22: 2800-2809.
- Mehta AI, Babu R, Sharma R, et al. Thickness of subcutaneous fat as a risk factor for infection in cervical spine fusion surgery. The Journal of bone and joint surgery American volume. 2013; 95: 323-328.
- Hikata T, Iwanami A, Hosogane N, et al. High preoperative hemoglobin A1c is a risk factor for surgical site infection after posterior thoracic and lumbar spinal instrumentation surgery. Journal of orthopaedic science : official journal of the Japanese Orthopaedic Association. 2014; 19: 223-228.
- Inacio MC, Kritz-Silverstein D, Raman R, et al. The risk of surgical site infection and re-admission in obese patients undergoing total joint replacement who lose weight before surgery and keep it off post-operatively. The bone & joint journal. 2014; 96-B: 629-635.
- Suzuki G, Saito S, Ishii T, Motojima S, Tokuhashi Y and Ryu J. Previous fracture surgery is a major risk factor of infection after total knee arthroplasty. Knee surgery, sports traumatology, arthroscopy : official journal of the ESSKA. 2011; 19: 2040-2044.
- Rasouli MR, Restrepo C, Maltenfort MG, Purtill JJ and Parvizi J. Risk factors for surgical site infection following total joint arthroplasty. The Journal of bone and joint surgery American volume. 2014; 96: e158.
- Pruzansky JS, Bronson MJ, Grelsamer RP, Strauss E and Moucha CS. Prevalence of modifiable surgical site infection risk factors in hip and knee joint arthroplasty patients at an urban academic hospital. The Journal of arthroplasty. 2014; 29: 272-276.
- Namba RS, Inacio MC and Paxton EW. Risk factors associated with surgical site infection in 30,491 primary total hip replacements. The Journal of bone and joint surgery British volume. 2012; 94: 1330-1338.
- Berbari EF, Osmon DR, Lahr B, et al. The Mayo prosthetic joint infection risk score: implication for surgical site infection reporting and risk stratification. Infection control and hospital epidemiology. 2012; 33: 774-781.
- Bozic KJ, Lau E, Kurtz S, et al. Patient-related risk factors for periprosthetic joint infection and postoperative mortality following total hip arthroplasty in Medicare patients. The Journal of bone and joint surgery American volume. 2012; 94: 794-800.
- 7Sagi HC, Dziadosz D, Mir H, Virani N and Olson C. Obesity, leukocytosis, embolization, and injury severity increase the risk for deep postoperative wound infection after pelvic and acetabular surgery. Journal of orthopaedic trauma. 2013; 27: 6-10.
- Manson TT, Perdue PW, Pollak AN and O'Toole RV. Embolization of pelvic arterial injury is a risk factor for deep infection after acetabular fracture surgery. Journal of orthopaedic trauma. 2013; 27: 11-15.
- Motie MR, Ansari M and Nasrollahi HR. Assessment of surgical site infection risk factors at Imam Reza hospital, Mashhad, Iran between 2006 and 2011. Medical journal of the Islamic Republic of Iran. 2014; 28: 52.
- Berger RL, Li LT, Hicks SC, Davila JA, Kao LS and Liang MK. Development and validation of a risk-stratification score for surgical site occurrence and surgical site infection after open ventral hernia repair. Journal of the American College of Surgeons. 2013; 217: 974-982.
- Levi B, Zhang P, Lisiecki J, et al. Use of morphometric assessment of body composition to quantify risk of surgical-site infection in patients undergoing component separation ventral hernia repair. Plastic and reconstructive surgery. 2014; 133: 559e-66e.
- Yang L, Wang H, Liang X, et al. Bacteria in hernia sac: an important risk fact for surgical site infection after incarcerated hernia repair. Hernia : the journal of hernias and abdominal wall surgery. 2015; 19: 279-283.
- Ito N, Iwaya T, Ikeda K, et al. Hyperglycemia 3 days after esophageal cancer surgery is associated with an increased risk of postoperative infection. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2014; 18: 1547-1556.
- Yang T, Tu PA, Zhang H, et al. Risk factors of surgical site infection after hepatic resection. Infection control and hospital epidemiology. 2014; 35: 317-320.
- Shinkawa H, Takemura S, Uenishi T, et al. Nutritional risk index as an independent predictive factor for the development of surgical site infection after pancreaticoduodenectomy. Surgery today. 2013; 43: 276-283.
- Watanabe M, Suzuki H, Nomura S, et al. Risk factors for surgical site infection in emergency colorectal surgery: a retrospective analysis. Surgical infections. 2014; 15: 256-261.
- Han J, Wang Z, Wei G, et al. [Risk factors associated with incisional surgical site infection in colorectal cancer surgery with primary anastomosis]. Zhonghua wai ke za zhi [Chinese journal of surgery]. 2014; 52: 415-419.
- Araki T, Okita Y, Uchino M, et al. Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surgery today. 2014; 44: 1072-1078.
- Gervaz P, Bandiera-Clerc C, Buchs NC, et al. Scoring system to predict the risk of surgical-site infection after colorectal resection. The British journal of surgery. 2012; 99: 589-595.
- Watanabe M, Suzuki H, Nomura S, et al. Performance assessment of the risk index category for surgical site infection after colorectal surgery. Surgical infections. 2015; 16: 84-89.
- Kim JY, Khavanin N, Jordan SW, et al. Individualized risk of surgical-site infection: an application of the breast reconstruction risk assessment score. Plastic and reconstructive surgery. 2014; 134: 351e-62e.
- Young H, Knepper B, Moore EE, Johnson JL, Mehler P and Price CS. Surgical site infection after colon surgery: National Healthcare Safety Network risk factors and modeled rates compared with published risk factors and rates. Journal of the American College of Surgeons. 2012; 214: 852-859.
- Willy C. Breakthrough ideas leading to new futures: next steps. International wound journal. 2014; 11 Suppl 1: 1-2.
- Willy C. Breakthrough ideas leading to new futures: prologue. International wound journal. 2013; 10 Suppl 1: 1-2.
- Back DA, Scheuermann-Poley C and Willy C. Recommendations on negative pressure wound therapy with instillation and antimicrobial solutions - when, where and how to use: what does the evidence show? International wound journal. 2013; 10 Suppl 1: 32-42.
[1] Links zu den Recherche-Datenbanken bzw. deren deutschen -Web-sites: www.medline.de, www.pubmed.de, www.embase.com, www.cochrane.de
[2] FIO2 = inspiratorischer Sauerstoffanteil bei Beatmung.
[3] Von der Arbeitsgemeinschaft für Osteosynthesefragen erarbeitete Klassifizierung von Frakturen; siehe auch http://www.trauma.org/archive/ortho/aoclass.html
[4] NNIS = National Nosocomial Infections Surveillance (NNIS) System. Die Erfassung der postoperativen Wundinfektionen baut auf dem US-amerikanischen System zur Erfassung nosokomialer Infektionen (früher National Nosocomial Infections Surveillance NNIS, aktuell National Healthcare Safety Network NHSN) auf. Der NNIS Risiko-Index ermöglicht die Einteilung der Patienten in 4 Kategorien (0, 1, 2, 3) in Abhängigkeit ihres Risikos, eine postoperative Wundinfektion zu entwickeln. Dieser Index basiert auf 3 Parametern, denen jeweils der Wert 0 oder 1 zugeordnet wird. Siehe auch: http://www.cdc.gov/nhsn/PDFs/dataStat/NNIS_2004.pdf
Datum: 17.08.2015
Quelle: Wehrmedizinische Monatsschrift 2015/6-7