DAS TUMORSTROMA DES PANKREASKARZINOMS ALS ANGRIFFSPUNKT EINER STAMMZELLENBASIERTEN, CCL5-PROMOTER REGULIERTEN HSV-TK-SUIZIDTHEARAPIE
Targeting Tumour Stroma using a Stemcell based, CCL5 regulated HSV-TK Suicide Gene Therapy in a murine pancreatic Tumour Model
Aus der Chirurgischen Klinik und Poliklinik der LMU¹ am Klinikum Großhadern (Chefarzt: Prof. Dr. Dr. K.-W. Jauch), der Klinik für Unfallchirurgie und Orthopädie² (Ltd. Arzt: Oberstarzt Prof. Dr. B. Friemert) und der Klinik für Allgemein-, Viszeral- und Thoraxchirurgie³ (Ltd. Arzt: Oberstarzt PD. Dr. R. Schmidt) am Bundeswehrkrankenhaus Ulm (Chefarzt: Generalarzt Prof. Dr. Dr. E. Grunwald) und der Arbeitsgruppe Klinische Biochemie⁴, Medizinische Klinik und Poliklinik der LMU am Klinikum Innenstadt München (Chefarzt: Prof. Dr. M. Reincke)
Christoph Zischek¹-⁴, Hanno Niess¹, Benedikt Friemert², Roland Schmidt³, Peter Nelson⁴ und Christiane Bruns¹
WMM, 57. Jahrgang (Ausgabe 1/2013: S. 14-19)
Zusammenfassung
Hintergrund: Mesenchymale Stammzellen (MSC) werden aktiv in das Tumorstroma rekrutiert, wo sie zum Tumorwachstum und zur Metastasierung beitragen. Die vermehrte Produktion von CCL5 durch die mesenchymalen Stammzellen innerhalb des Tumorstromas spielt eine entscheidende Rolle in diesem Prozess.
Methoden: Murine MSC wurden genetisch so verändert, dass sie entweder Reportergene oder ein therapeutisches Suizidgen unter Kontrolle des CCL5-Promoters exprimierten. Diese Zellen wurden im Anschluss daran Mäusen mit wachsenden Pankreaskarzinomen intravenös verabreicht. Die Auswirkungen auf das Tumorwachstum und die Metastasierungsrate wurden anschließend untersucht. MSC wurden aus dem Knochenmark von C57BL/6 p53-/- Mäusen isoliert und mit dem rot fluoreszierenden Protein (RFP), dem grün fluoreszierendem Protein (eGFP) oder der Herpes simplex Virus-Thymidinkinase (HSV-TK) stabil transfiziert, wobei diese Gene unter CCL5-Promoter-Kontrolle gebracht wurden. Diese Zellen wurden über 3 Wochen hinweg einmal wöchentlich Mäusen intravenös verabreicht, die orthotope und syngene panc02 Pankreaskarzinome trugen. Humangewebe wurde von der Stiftung HTCR bezogen und auf CCL5-Expression hin untersucht.
Ergebnisse: Reportergensignale konnten mittels Fluoreszenzmikroskopie in den behandelten Tumoren nachgewiesen werden. In der HSV-TK-Therapiegruppe führte die intraperitoneale Gabe von Ganciclovir nach Stammzellgabe zu einer Halbierung des Tumorwachstums und zu einer Reduktion der Metastasierung. Anhand von humanem Pankreasnormalgewebe und Pankreastumorgewebe konnte eine vermehrte CCL5-Expression im Pankreaskarzinom nachgewiesen werden.
Schlussfolgerungen: Die aktive Migration von MSC in das Stroma von Pankreaskarzinomen und die konsekutive Aktivierung des CCL5-Promoters wurden durch die Reportergenkonstrukte nachgewiesen. Hieraus konnte durch den Einsatz einer stammzellbasierten Suizidgentherapie ein therapeutischer Erfolg mit Reduktion des Tumorwachstums und der Metastasierung erzielt werden. Schlagworte: Mesenchymale Stammzellen, Suizidgentherapie, Pankreaskarzinom, Tumorstroma, CCL5.
Summary
Background: Mesenchymal stem cells (MSC) are actively recruited to tumour stroma where they support tumor growth and metastases. Upregulation of a certain chemotactic cytokine (CCL5) by MSCs within the tumour stroma has been shown to play a central role in this process.
Methods: Murine MSCs were engineered to express reporter genes or a therapeutic gene under control of the CCL5 promoter and transferred into mice with growing pancreatic tumours. The effect on tumour growth and metastases was then evaluated. MSCs isolated from bone marrow of C57BL/6 p53-/- mice were stably transfected with the red or green fluorescent protein (RFP, eGFP) or the herpes simplex virus thymidine kinase (HSV-TK) gene driven by the CCL5 promoter. MSCs were intravenously applied once per week over 3 weeks to mice carrying orthotopic, syngeneic pancreatic panc02 tumours. Human tissue was obtained from the HTCR foundation and the CCL5 expression was then evaluated.
Results: eGFP and RFP signals driven by the CCL5 promoter were detected in treated pancreatic tumour samples. The treatment of the HSV-TK therapy group with the intraperitoneally given prodrug ganciclovir 5 – 7 days after stem cell application led to a 50 % reduction of primary pancreatic tumour growth and reduced liver metastases. The examination of human pancreatic adenocarcinomas showed enhanced expression of the chemokine CCL5 within the stromal compartment.
Conclusions: The active homing of MSCs into primary pancreatic tumour stroma and activation of the CCL5 promoter was verified using eGFP- and RFP-reporter genes. In the presence of ganciclovir, HSV-TK transfected MSCs led to a significant reduction of primary pancreatic tumour growth and incidence of metastases.
Keywords: Mesenchymal stem cells, suicide gene therapy, pancreatic cancer, tumour stroma, CCL5.
Einleitung
Maligne Zellen wachsen in einem komplexen zellulären und extrazellulären Umfeld, welches die Initiierung und Aufrechterhaltung des malignen Phänotyps bedeutend beeinflusst [1-3]. Tumoren bestehen zum einen aus den Tumorzellen selbst, zum anderen aus dem unterstützenden Stroma, das Fibroblasten, Endothelien, Perizyten, Lymphgefäße, ein mononukleäres Infiltrat und die Extrazellulärmatrix miteinschließt. Dieses Mikromilieu hat einen großen modulierenden Einfluss auf das Tumorwachstum, die Invasivität und das Metastasierungspotenzial. Der Einfluss dieser stromalen Zelltypen ist dabei von solch großer Bedeutung für das Überleben des Tumors, dass sie zu einem wichtigen Ziel einer chemotherapeutischen Intervention geworden sind [2, 4].
Mesenchymale Stammzellen (MSC) sind pluripotente Vorläuferzellen, die zur Aufrechterhaltung und Regeneration verschiedenster Gewebearten beitragen [5]. Trotz Knochenmarkabstammung können MSC ebenso in anderen Geweben gefunden werden, wo sie als eine lokale Quelle von Progenitorzellen dienen [6]. MSC sind an der Gewebeumstrukturierung nach Verletzungen oder im Rahmen chronischer Entzündung beteiligt. Geschädigtes Gewebe produziert spezifische endokrine Signale, die zur Mobilisierung von MSC und deren konsekutiven Rekrutierung in das geschädigte Gewebe führen. Tumoren werden vom Körper als chronische Wunden angesehen und folglich werden auch MSC rekrutiert [7, 8]. Innerhalb des Tumorstromas differenzieren die MSC zu verschiedenen Zelltypen aus, die unter anderem zur Tumorgefäßversorgung oder zu stromalen fibroblastenartigen Zellen beitragen [8, 9].
Karnoub et al. konnten für das Mammakarzinom zeigen, dass MSC in die Tumoren rekrutiert werden und dort zur Sekretion des CC-Chemokins CCL5 (RANTES) angeregt werden. CCL5 kann als Botenstoff wirken und ist mit einer gesteigerten Tumorvaskularisierung vergesellschaftet. Zusätzlich kann CCL5 zum Tumorwachstum und zur Metastasierung beitragen, zum einen durch autokrine Aktivierung des Tumors, zum anderen durch die Rekrutierung stromaler Zelltypen an den Ort primären Tumorwachstums [8, 10].
Wir und andere konnten in letzter Zeit zeigen, dass die CD34- Subpopulation von MSC-Vorläufern in wachsende Tumoren rekrutiert werden und dort zur Neoangiogenese durch Differenzierung in endotheliale Zellen oder Perizyten beitragen [6, 11]. Bemerkenswerterweise können diese und ähnliche direkte Effekte auch nach Injektion von MSC in die periphere Blutzirkulation nachgewiesen werden [12].
Ziel der Arbeit war es, diese Tumorbiologie auszunutzen, indem MSC genetisch so verändert wurden, dass sie das Suizidgen der Herpes simplex Virus-Thymidinkinase unter der Kontrolle des CCL5 Promoters exprimieren und somit eine induzierte HSV-TK-Genexpression durch stromale Aktivierung der MSC innerhalb des Tumors ermöglichen.
Die HSV-TK Gentherapie mit Gancicovir (Gcv) ist die Grundlage einer weit genutzten Strategie der Suizidgentherapie. Diese wirkt durch einen sogenannten “Bystander-Effect” bei dem nicht nur die mit dem Gen transfizierten Zellen absterben, sondern auch benachbarte Zellen in der Anwesenheit von Gcv [13, 14]. In dieser Arbeit zeigen wir, dass genetisch modifizierte Stammzellen als Vehikel für den Transport einer gewebespezifischen Gentherapie in Tumore dienen können und dass die HSV-TK Expression in den MSC durch den CCL5-Promoter gesteuert werden kann.
Methoden
Mesenchymale Stammzellen
Mesenchymale Stammzellen wurden aus dem Knochenmark von C57BL/6 Mäusen wie beschrieben isoliert [15]. CD34- MSC exprimieren CD73 und CD105, aber nicht die myelogenen Marker CD34, CD14, CD45, MHC II und sind daher schwer genauer zu definieren. Um die Isolation und Charakterisierung zu ermöglichen, wurden C57BL/6 Mäuse mit homozygoter p53 Deletion verwendet. Diese MSC Linien konnten leicht gezüchtet, geklont und transfiziert werden. Die Zellen wuchsen adhärent und durchgehend in der Zellkultur und behielten eine signifikante Pluripotenz. Nach dem Subklonieren wurden Einzelzellklone ausgewählt und charakterisiert. Die Zellen wurden entweder mit dem grün fluoreszierenden Protein (eGFP), dem rot fluoreszierenden Protein (RFP) oder der HSV-TK unter Kontrolle des CCL5-Promoters transfiziert. Die Sequenz des Promoters nutzte die -972bp der upstream region und die komplette 5’ nicht translatierte Region. Zusätzlich enthielten alle Vektoren das CMV-Promoter kontrollierte Bsr2 Blasticidin-Resistenzgen, um eine Selektion der erfolgreich transfizierten Zellen bei einer Blasticidinkonzentration von 5 µg/ml zu ermöglichen. Vor Injektion in die Mäuse wurden die Zellen von den Kulturflaschen abgelöst, zweimal mit Phosphatpufferlösung (PBS, pH 7,4) gewaschen und in PBS resuspendiert.
Orthotopes Pankreaskarzinommodell
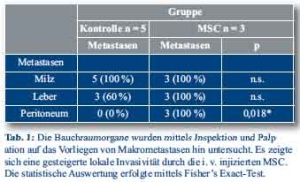
C57BL/6 und C57BL/6 p53-/- Mäuse wurden von Charles River (Sulzfeld, Deutschland) erworben. Alle Tierexperimente wurden nach Zustimmung der Tierschutzkommission des Freistaates Bayern durchgeführt. Zwei bis drei Monate alte C57BL/6 Mäuse mit einem Durchschnittsgewicht von ca. 20 g wurden für die Implantation von panc02-Pankreastumoren (syngene Zelllinie) verwendet. Die Mäuse wurden mit Ketamin (100 mg/kg Körpergewicht), Xylazin (5mg/kg Körpergewicht) und Atropin narkotisiert. Der operative Zugangsweg im Bereich der linken Flanke wurde rasiert und steril abgewaschen. Mit einer 1 cm langen Inzision über der linken Flanke wurde das Pankreas dargestellt. Mit einer kalibrierten Knopfdruck-Spritze (Hamilton Syringe Company, USA) und einer 30G Nadel wurden 150 000 panc02-Tumorzellen (gelöst in 40 µl PBS) subkapsulär in das Pankreas injiziert. Es wurde darauf geachtet, dass keine Tumorzellen intraperitoneal verteilt wurden. Hierzu wurde ein Q-Tip für 1 min nach der Nadelentfernung leicht auf die Injektionsstelle gepresst, als Erfolgszeichen bildete sich eine subkapsuläre Flüssigkeitsblase. Nach Injektion wurden das Peritoneum und die Haut mit Einzelknopfnähten mit Prolene 4-0 verschlossen. 2 Wochen nach dieser Operation entwickelten alle Mäuse palpable Tumore und wurden in die entsprechenden Gruppen randomisiert. Die Kontrollgruppe ohne Stammzellinjektionen (A, n=5) und die Stammzellgruppen p53-/- (B, n=3), CCL5Pro-TK (C, n=10), CCL5Pro-RFP (D, n=9) und CCL5Pro-eGFP (E, n=6). Alle Zellinjektionen erfolgten in der Dosierung 0,5x106 Zellen pro Woche über die dorsale Schwanzvene. Ganciclovir (Cymeven, Roche, Deutschland) wurde der Gruppe C in der Dosierung von 1,5 mg an den Tagen 5 bis 7 nach Stammzellgabe intraperitoneal verabreicht. Alle Mäuse wurden nach 3 Behandlungszyklen geopfert, die Tumore wurden reseziert und gewogen. Die statistische Auswertung erfolgte mit dem ungepaarten, zweiseitigen t-Test für unabhängige Stichproben. Metastasen wurden durch Inspektion und Palpation der Milz, Leber und des Peritoneums evaluiert.
Humangewebe
Für die Untersuchung der CCL5-Expression an humanem Pankreaskarzinomgewebe wurde bei der gemeinnützigen Stiftung HTCR (Human Tissue and Cell Research) die Bereitstellung von Gewebeproben humaner pankreatischer duktaler Adenokarzinome und korrespondierendem Normalgewebe von den gleichen Patienten beantragt. Die bewilligten Gewebeproben von 10 Patienten lagen in schockgefrorenem Zustand vor und waren nach Patientennummer und Gewebeart (Tumorgewebe, Normalgewebe) sortiert. Die Gewebeproben unterlagen der Zustimmung der Patienten und wurden entsprechend den Richtlinien der Stiftung verwendet [16].
Für die vollständigen und genauen Darstellungen der verwendeten Methoden sei auf entsprechende Quellen verwiesen [3, 17].
Ergebnisse
Rekrutierung von MSC in Pankreastumore
Um den Effekt von mesenchymalen Stammzellen auf murine Pankreaskarzinome zu untersuchen, wurden tumortragenden Mäusen MSC intravenös injiziert. Nach 3 Stammzellgaben im Abstand von je einer Woche wurden die Tiere geopfert und das Tumorwachstum und die Metastasierung evaluiert. Hierbei zeigte sich eine deutliche Zunahme des Tumorwachstums durch die systemische Gabe von MSC (p < 0,003, Student’s t-Test, Abb. 1A). Zudem kam es zu einer deutlichen Steigerung der Peritonealkarzinoserate (Tab. 1). In einem Mammakarzinommodell war das Cytokin Ccl5 für diese Effekte ursächlich, daher wurde die Ccl5-Expression im Tumorgewebe anhand der qRT-PCR auf Transkriptionsebene untersucht. Hierbei zeigte sich eine erhöhte Expression von Ccl5 in den Tumoren der Tiere, die MSC intravenös erhalten hatten (p<0,05, Mann-Whitney-U Test, Abb. 1B). In vorausgegangenen In vitro- und In-vivo-Experimenten konnte eine direkte Migration von MSC in Pankreastumor gezeigt werden [3].
MSC mit CCL5-Promoter regulierten Reportergenen zeigen im Tumorstroma eine Genexpression
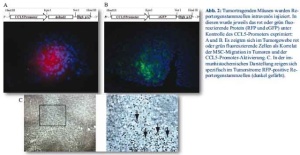
Der CCL5-Promoter ist in verschiedensten Geweben aktiv, im Allgemeinen im Rahmen von Gewebeschaden oder Gewebsstress [18], und wird bei der Rekrutierung von MSC in Pankreastumore induziert. Im nächsten Schritt untersuchten wir die Möglichkeit einer gezielteren Expression von Reportergenen im Tumorstroma unter Verwendung des CCL5-Promoters. Zu diesem Zweck wurden die p53-/- C57BL/6 MSC mit einem RFP oder eGFP Reportergen unter Kontrolle des CCL5-Promoters modifiziert. Die unmittelbare -972bp upstream und die komplette 5’ nicht translatierte Region bis zum Startpunkt der Translation wurden in einem Expressionsvektor vor die Reportergene RFP oder eGFP kloniert und stabil in MSC transfiziert. Die resultierenden CCL5-eGFP oder CCL5-RFP-MSC wurden dann in die periphere Zirkulation von Mäusen mit wachsenden Pankreastumoren alle 7 Tage für eine Gesamtdauer von 21 Tagen injiziert. Die Mäuse wurden anschließend geopfert und die Tumoren und das umgebende Gewebe nach einer RFP- oder eGFP-Reportergenexpression mittels Fluoreszenzmikroskopie und Immunhistochemie untersucht. Die Ergebnisse zeigten eine RFP- oder eGFP-Fluoreszenz in den wachsenden Tumoren (Abb. 2A und 2B). Um die räumliche Verteilung der RFP-Reportergenexpression besser darstellen zu können, wurden zudem formaldehydfixierte Gewebeproben mittels spezifischer Immunohistochemie angefärbt. RFP exprimierende MSC kamen dabei im gesamten Tumorstroma zur Darstellung (Abb. 2C). Leber und Thymus zeigten keine detektierbare RFP-Expression, wohingegen die Milz RFP-positive Zellen bot (Daten nicht gezeigt).
Therapeutischer Stammzelleinsatz gegen das Pankreaskarzinom
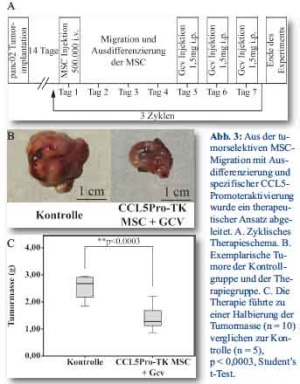
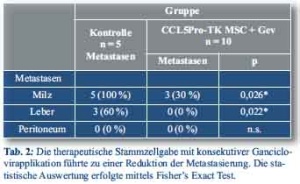
Der Transport eines therapeutischen Gens unter Nutzung des CCL5-Promoters wurde anschließend untersucht. Hierzu wurde das Gen der HSV-TK unter CCL5-Promoter-Kontrolle kloniert. Als therapeutisches Regime wurden 0,5x106 CCL5/HSV-TK MSC intravenös verabreicht. Den Zellen wurden 3 Tage zur Rekrutierung in das Tumorstroma, zur Ausdifferenzierung und zur konsekutiven Induktion des HSV-TK Gens gegeben, ehe eine weitere Behandlung erfolgte. Anschließend wurden den Mäusen für 3 Tage einmal täglich 1,5 mg Ganciclovir intraperitoneal verabreicht. Dieser Zyklus wurde insgesamt 3 mal durchgeführt. Nach 21 Tagen wurden die Tiere geopfert und das Tumorwachstum evaluiert (Abb. 3A). Es zeigte sich eine signifikante Verminderung des Tumorvolumens in Mäusen, welche die therapeutischen CCL5/HSV-TK-Stammzellen erhalten hatten im Vergleich zu den Kontrolltieren ohne jegliche Behandlung. Abbildung 3B zeigt repräsentative Tumoren, die nach Beendigung des Experimentes entnommen wurden. Die Tumorgewichte zeigten eine statistisch signifikante Abnahme im Vergleich zu den unbehandelten Kontrolltieren (p < 0,0003, Student’s t-Test, Abb. 3C). Als zusätzlicher Parameter wurde die Metastasierung in die Leber, Milz und das Peritoneum im Rahmen der Behandlung untersucht. Durch die HSV-TK-MSC-Behandlung mit konsekutiver Ganciclovirgabe konnte nicht nur eine signifikante Reduktion der Metastasierung in die Milz und Leber erreicht werden, sondern auch eine Senkung der Peritonealkarzinoserate erzielt werden (Tab. 2).
CCL5-Expression im humanen Pankreaskarzinom
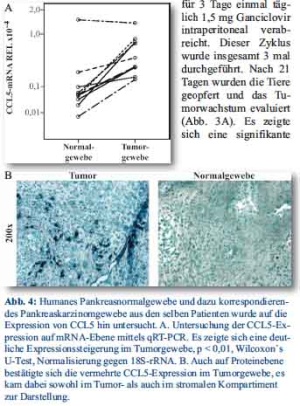
Um die CCL5-Expression im humanen Pankreaskarzinom zu evaluieren, wurden Pankreasnormal- und Pankreastumorgewebe über die allgemeinnützige Stiftung HTCR bezogen [16]. Bei dem Gewebe handelte es sich um Operationsresektate (n=10), die von jedem Patienten Tumorgewebe und korrespondierendes Normalgewebe enthielten, sodass eine direkte Untersuchung der CCL5-Regulation möglich war. Die CCL5-Expression auf mRNA-Ebene wurde mittels einer qRT-PCR mit CCL5-spezifischen Primern und Proben untersucht. Dabei zeigte sich eine signifikante Hochregulation der CCL5-Expression im Tumorgewebe, die von Faktor 2 bis 32 reichte (p<0,01, Wilcoxon U-Test, Abb. 4A). Um den Ort der Expression detektieren zu können, wurden Gewebeschnitte mit einem CCL5 spezifischen Antikörper angefärbt. Hierbei kam es zu einer CCL5-Anfärbung im stromalen Kompartiment der Pankreaskarzinome (Abb. 4B).
Diskussion
Mesenchymale Stammzellen werden aktiv in das Tumorstroma rekrutiert, wo sie auf vielseitige Art und Weise das Tumorwachstum fördern. So wirken sie als Vorläuferzellen für Tumorgefäße und fibroblastenartige Zellen, die sogenannten carcinoma-associated fibroblasts [9]. Der spezifische Einfluss von Tumor-assoziierten stromalen Zelltypen auf das Tumorwachstum und das Metastasierungspotenzial wurde bereits gezeigt. In einem Mammakarzinom-Modell konnte demonstriert werden, dass MSC innerhalb des Tumorstromas erhöhte Mengen des Cytokins CCL5 produzieren und damit zu einem erhöhten Auftreten von Lungenmetastasen führen [8].
Die CCL5 Sekretion wird außerdem in pankreatischen periazinären Myofibroblasten feinreguliert, was eine Rolle dieser Zellen in der Infiltration und Ansammlung von Entzündungszellen im Pankreas vermuten lässt. In Patienten, die an einem Pankreaskarzinom erkrankt sind, war eine Pankreatitis signifikant mit einem Polymorphismus des CCL5-Promoters vergesellschaftet [3]. Unsere Absicht war es, die Rolle von genetisch veränderten mesenchymalen Stammzellen als therapeutisches Vehikel für den selektiven Transport eines Suizidgenes in das Tumorstroma zu evaluieren, mit besonderer Beachtung des Effektes auf das Tumorwachstum und die Metastasierung.
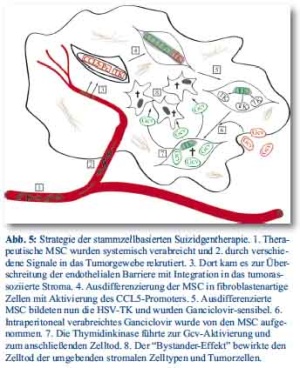
MSC wurden mit solchen Genkonstrukten stabil transifiziert, dass sie die HSV-TK unter Kontrolle des CCL5-Promoters für eine selektivere Suizidgenexpression innerhalb des Tumors exprimieren. Die Herpes simplex Virus-Thymidinkinase phophoryliert Ganciclovir, das anschließend ein Substrat für zelluläre Kinasen darstellt. Auf diese Weise entsteht das toxische Ganciclovir-Triphosphat, welches nicht nur die transfizierten TK+ Zellen abtötet, sondern auch umgebende Tumor- und Stromazellen durch den sogenannten Bystander-Effekt schädigt. Da solide Tumoren einen starken Migrationsreiz für zirkulierende Vorläuferzellen darstellen, führt die Kombination der MSC als Genvehikel und der gewebespezifischen Suizidgenexpression aufgrund des CCL5-Promoters sowohl zu einer hohen Effizienz als auch zu einem geringen Nebenwirkungsprofil der Therapie (Abb. 5).
Neue Therapieansätze des Pankreaskarzinoms aus der präklinischen Forschung konnten bisher das Patientenüberleben noch nicht signifikant verlängern. Zum Zeitpunkt der Diagnosestellung befinden sich lediglich 20 % der Pankreaskarzinom-Patienten in einem noch operablen Tumorstadium. 40 % der Patienten präsentieren sich in einem lokal fortgeschrittenen Stadium und weitere 40 % der Patienten tragen bereits Fernmetastasen, beides Irresektabilitätskriterien. In unserem Pankreaskarzinommodell konnten wir zeigen, dass mesenchymale Stammzellen eine wichtige Rolle für das Pankreaskarzinom einnehmen. Die Zellen suchen aktiv das Tumorstroma, wie wir durch Migrationsassays und die in vivo Injektion von Reportergen-Stammzellen zeigen konnten. Die systemisch verabreichten Zellen wurden vor allem innerhalb des Tumors entdeckt, jedoch waren sich auch in anderen Geweben wie der Haut, dem Darm und im sekundären Lymphgewebe auffindbar. Wie in den weiterführenden Reportgen-Experimenten gezeigt werden konnte, werden die genetisch veränderten Stammzellen in die gleichen Geweberäume integriert. Jedoch erfahren sie nicht die gleiche Ausdifferenzierung und Aktivierung, sodass sie das Reportergen unter CCL5-Promoter-Kontrolle nicht exprimierten. Aus diesem Grund eliminierte die Verwendung des CCL5-Promoters als regulatorisches Element der HSV-TK zum großen Teil die nichtspezifische Hintergrundexpression des Transgenes in anderen Organsystemen mit Ausnahme der Milz. Um diese Spezifität abermals zu erhöhen, könnte die CCL5-Gewebespezifität modifiziert werden, um eine selektive Expression eines therapeutischen Gens in einem genau definierten Mikromilieu zu kontrollieren.
Im therapeutischen Ansatz sind diese Zellen aufgrund der andauernden Reduktion der Tumorgröße und der reduzierten Peritonealkarzinoserate vielversprechend, insbesondere als Kombination einer auf den individuellen Patienten zugeschnittenen Stammzellen- und Suizidgentherapie. Autologe, aus dem Knochenmark abstammende, MSC könnten aus den entsprechenden Patienten isoliert werden und nach entsprechender In-vitro-Behandlung dem Patienten erneut intravenös verabreicht werden, ohne die Notwendigkeit einer Myeloablation oder einer Knochenmarktransplantation.
Die Stammzelltherapie und die Gentherapie wecken einiges an Hoffnung für die Entwicklung neuer Behandlungen für Erkrankungen. Doch bisher haben sich nur wenige Herangehensweisen, die auf diesen beiden Modalitäten basieren, in der Klinik etablieren können. Die Verbindung der Stammzelltherapie mit der selektiven Gentherapie vergrößert die therapeutischen Möglichkeiten zur Kontrolle des Tumorwachstums.
Als Grundvoraussetzung einer Gentherapie gilt die dauerhafte Produktion des gewünschten Genproduktes innerhalb des richtigen biologischen Kontextes unter Vermeidung von Nebenwirkungen [6]. Um dieses Ziel zu erreichen, müssen zum einen neue Strategien zur Modulation der Genexpression und zum anderen neue Methoden zum effizienten Gentransfer in Stammzellen gefunden werden. Die selektive Expressionskontrolle eines therapeutischen Gens durch ausdifferenzierende Stammzellen in einem bestimmten Mikromilieu ist eine neue Herangehensweise im Rahmen der Stammzelltherapie, die einiges für den klinischen Einsatz erwarten lässt.
Literatur
- Ahmed F, Steele JC, Herbert JM, Steven NM, Bicknell R,: Tumor stroma as a target in cancer. Curr Cancer Drug Targets 2008; 8(6): 447-453.
- Niess H, Bao Q, Conrad C et al.: Selective targeting of genetically engineered mesenchymal stem cells to tumor stroma microenvironments using tissue-specific suicide gene expression suppresses growth of hepatocellular carcinoma. Ann Surg 2005; 254(5): 767-774; discussion 774-775.
- Zischek C, Niess H, Ischenko I, et al.: Targeting tumor stroma using engineered mesenchymal stem cells reduces the growth of pancreatic carcinoma. Ann Surg 2009; 250(5): 747-753.
- Hall B, Andreeff Mand, Marini F: The participation of mesenchymal stem cells in tumor stroma formation and their application as targeted-gene delivery vehicles. Handb Exp Pharmacol 2007(180): 263-283.
- Pittenger MF, Mackay AM, Beck SC, et al.: Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284(5411): 143-147.
- Conrad C, Gupta R, Mohan H, et al.: Genetically engineered stem cells for therapeutic gene delivery. Curr Gene Ther 2007; 7(4): 249-260.
- Dvorak HF: Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N Engl J Med 1986; 315(26): 1650-1659.
- Karnoub AE, Dash AB, Vo AP, et al.: Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature 2007; 449(7162): 557-563.
- Mishra PJ, Glod J, Banerjee D: Mesenchymal stem cells: flip side of the coin. Cancer Res 2009; 69(4): 1255-1258.
- Azenshtein E, Luboshits G, Shina S, et al.: The CC chemokine RANTES in breast carcinoma progression: regulation of expression and potential mechanisms of promalignant activity. Cancer Res 2002 62(4): 1093-1102.
- Bexell D, Gunnarsson S, Tormin A, et al.: Bone marrow multipotent mesenchymal stroma cells act as pericyte-like migratory vehicles in experimental gliomas. Mol Ther 2009; 17(1): 183-190.
- Conrad C, Niess H, Huss R, et al.: Multipotent mesenchymal stem cells acquire a lymphendothelial phenotype and enhance lymphatic regeneration in vivo. Circulation 2009; 119(2): 281-289.
- Golumbek PT, Hamzeh FM, Jaffee EM, Levitsky H, Lietman PS, Pardoll DM: Herpes simplex-1 virus thymidine kinase gene is unable to completely eliminate live, nonimmunogenic tumor cell vaccines. J Immunother 1992; 12(4): 224-230.
- Mesnil M, Piccoli C, Tiraby G, Willecke, Yamasaki KH: Bystander killing of cancer cells by herpes simplex virus thymidine kinase gene is mediated by connexins. Proc Natl Acad Sci U S A 1996; 93(5): 1831-1835.
- Von Luttichau I, Notohamiprodjo M, Wechselberger A, et al.: Human adult CD34- progenitor cells functionally express the chemokine receptors CCR1, CCR4, CCR7, CXCR5, and CCR10 but not CXCR4. Stem Cells Dev 2005; 14(3): 329-336.
- Thasler WE, Weiss TS, Schillhorn K, Stoll PT, Irrgang B, Jauch KW: Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell Tissue Bank, 2003; 4(1): 49-56.
- Zischek C: Das Tumorstroma als Angriffspunkt einer stammzellbasierten CCL5-Promoter/HSV-TK Suizidgentherapie in einem murinen Pankreastumormodell.
- von Luettichau I, Nelson PJ, Pattison JM, et al.: RANTES chemokine expression in diseased and normal human tissues. Cytokine 1996; 8(1): 89-98.
Weitere Literaturhinweise bei den Verfassern.
Die vorliegende Arbeit wurde mit dem E.ON Kulturpreis Bayern 2012 ausgezeichnet (siehe auch S. 31).
Es besteht kein Interessenkonflikt. Diese Arbeit enthält Daten der Dissertation von C. Zischek.
Datum: 03.02.2013
Quelle: Wehrmedizinische Monatsschrift 2013/1