UNTERSUCHUNGEN ZUR ARZNEIMITTELSICHERHEIT DES EINZELVORRATES - NACHWEIS VON TETRAMETHYLHARNSTOFF IN LANGZEITGELAGERTEN PYRIDOSTIGMINBROMID-TABLETTEN
Aus der Abteilung IV Pharmazie (Abteilungsleiter: Oberstapotheker Dr. T. Zimmermann) des Zentralen Instituts des Sanitätsdienstes der Bundeswehr München (Leiter: Oberstapotheker K. Schad)
von Reinhard Bogan und Michael Loch
Zusammenfassung:
Hintergrund: Pyridostigminbromid-Tabletten sind Teil des Einsatzvorrates der Bundeswehr.
Bei der Untersuchung langzeitgelagerter Pyridostigminbromid- Tabletten wurde eine unbekannte Substanz detektiert. Nachfolgende Untersuchungen zeigten, dass es sich um ein Abbauprodukt des Wirkstoffs handelt. Der prozentuale Anteil dieses Abbauproduktes übersteigt die für neue Arzneimittel etablierten Grenzwerte der International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH).
Methoden: Um Erkenntnisse über die Herkunft der unbekannten Substanz zu erlangen, wurden Stressversuche mit Pyridostigminbromid- Tabletten sowie mit Wirkstoff und Matrix durchgeführt. Untersuchungen zur Identität und Gehalt des Abbauproduktes erfolgten mittels Umkehrphasen-Hochleistungsflüssigchromatographie (RP-HPLC) sowie Gaschromatographie- Massenspektrometrie (GC/MS).
Ergebnisse: Die Struktur der unbekannten Substanz wurde aufgeklärt und mit zwei unabhängigen Verfahren abgesichert. Es handelt sich um das bislang nicht beschriebene Abbauprodukt Tetramethylharnstoff (Tetramethlyurea TMU, C5H12N2O, CAS Nr. 632-22-4). TMU kann durch Hydrolyse, Decarboxylierung und nachfolgende Säureamidbildung aus Pyridostigminbromid entstehen. Aufgrund der vorliegenden Daten ist im hier nachgewiesenen Dosisbereich von keiner akut toxischen Wirkung für den Menschen auszugehen. TMU zeigte in höheren Dosen im Tierversuch nach peroraler Applikation teratogene Eigenschaften. Da im Bereich der Reproduktionstoxikologie auch stochastische Effekte zu berücksichtigen sind, bedarf das Risiko einer teratogenen Wirkung im hier für den Menschen relevanten Dosisbereich noch weiterer Abklärung und einer darauf aufbauenden Nutzen/Risiko-Abwägung.
Schlussfolgerungen: Eine risikoorientierte, dem Stand von Wissenschaft und Technik entsprechende, Untersuchung des Einsatzvorrates liefert Daten zu Abbauwegen und Abbauprodukten, über die oft keine vergleichbaren Erkenntnisse aus dem zivilen Bereich vorliegen. Damit wird die Arzneimittelsicherheit gewährleistet und es werden qualitätsassoziierte Risiken im Krisenfall ausgeschlossen. Die Bundeswehr kommt mit diesen aufwändigen Untersuchungs- und Qualifizierungsstrategien gesetzlichen Vorgaben und der Fürsorgepflicht gegenüber dem Soldaten nach.
Summary: Background: Pyridostigmine bromide tablets are part of the operational stock of the German Bundeswehr. During the analysis of pyridostigmine bromide tablets after long-time storage, an unknown substance was detected. Subsequent investigations showed that the latter is a degradation product of the active pharmaceutical ingredient (API). The percentage share of this degradation product exceeds the threshold values permitted by the International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) for new medicinal drugs.
Methods: In order to learn about the origin of the unknown substance, stress experiments were conducted with pyridostigmine bromide tablets as well as with the active pharmaceutical ingredient and the matrix. Investigations on the identity and content of the degradation product were made by means of reverse-phase high performance liquid chromatography (RP-HPLC) and gas chromatography-mass spectrometry (GC/MS).
Results: The structure of the unknown substance was elucidated and confirmed by means of two independent procedures. The substance identified is the degradation product tetramethylurea (TMU, C5H12N2O, CAS No. 632- 22-4), which has not been described so far. TMU may develop from pyrodistigmine bromide as a result of hydrolysis, decarboxylation and subsequent formation of acid amide. Current data do not suggest an acute toxic effect in humans for the here found dose range. Animal studies have shown that in higher doses, TMU exhibits teratogenic properties after oral application. Since in the field of reproduction toxicology, stochastic effects must also be considered, the risk of a teratogenic effect in the dose range relevant for human beings still requires further clarification, and a benefit/risk assessment needs to be made on the basis of the respective findings.
Conclusions: A risk-oriented investigation of the operational stock, reflecting the state of the art in science and technology, provides data on degradation paths and degradation products about which comparable findings are frequently lacking in the civilian sector. This serves to guarantee drug safety, and risks associated with quality are excluded in the event of a crisis. These investigation and qualification strategies enable the German Bundeswehr to comply with legal requirements and the obligation to provide care and welfare to the soldier.
1. Einführung
Die Bundeswehr untersucht regelmäßig die pharmazeutische Qualität auch der nicht routinemäßig in der Therapie angewandten, langzeitgelagerten Arzneimittel des Einsatzvorrates. Die Untersuchungsmethodik wird hierbei laufend dem aktuellen Stand von Wissenschaft und Technik angepasst, um die Arzneimittelsicherheit zu gewährleisten und qualitätsassoziierte Risiken im Krisenfall auszuschließen. Mit dieser Vorgehensweise kommt die Bundeswehr den arzneimittelrechtlichen Vorgaben nach und leistet einen Beitrag zum vorbeugenden Gesundheitsschutz.
Pyridostigminbromid-Tabletten sind Teil des Einsatzvorrates der Bundeswehr und werden bei entsprechender Bedrohungslage auf Befehl ausgegeben. Sie dienen der Vorbehandlung bei einer zu erwartenden oder nicht auszuschließenden Exposition mit Nervenkampfstoffen. Die Wirkung von Pyridostigmin beruht dabei auf einer reversiblen Hemmung der Acetylcholinesterase: Diese wird teilweise und zeitlich beschränkt der irreversiblen Hemmung durch Nervenkampfstoffe entzogen und behält damit ihre lebenserhaltende Funktion.
Bei der Untersuchung langzeitgelagerter Pyridostigminbromid-Tabletten wurde eine unbekannte Substanz detektiert. Da im zivilen Bereich Arzneimittel im Allgemeinen nicht über Jahrzehnte eingelagert werden, liegen für das Abbauverhalten von Pyridostigminbromid nach Langzeitlagerung nur wenige wissenschaftliche Erkenntnisse vor. Im Zuge der weiteren Untersuchungen konnte gezeigt werden, dass es sich bei der unbekannten Substanz um ein bisher in der Literatur für Pyridostigminbromid nicht beschriebenes Abbauprodukt handelt. Der Anteil dieses Abbauproduktes übersteigt die für neu zugelassene Arzneimittel etablierten Grenzwerte der International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). Deshalb wurden seitens der Bundeswehr weitere Untersuchungen zur Strukturaufklärung der zugrunde liegenden Substanz durchgeführt, um darauf aufbauend eine Aussage zur Unbedenklichkeit und damit zur weiteren Verwendbarkeit des Einsatzvorrates an Pyridostigminbromid- Tabletten treffen zu können. Diese Erkenntnisse sind wiederum Grundlage für die logistische Lagebewertung bezüglich der Arzneimittelbevorratung.
Die Untersuchungen zur Identifizierung eines neuen, bislang nicht beschriebenen, Abbauproduktes von Pyridostigminbromid sowie zu einer orientierenden toxikologischen Bewertung von Tetramethylharnstoff (TMU) werden im folgenden Beitrag vorgestellt.
2. Material und Methoden
2.1. Untersuchungsgegenstand
Gegenstand der hier vorgestellten Untersuchungen sind Pyridostigminbromid-Tabletten aus dem Herstellungsjahr 1988. Diese wurden unter den depotüblichen Bedingungen in einer Dreifachverpackung gelagert. Die Primärverpackung besteht aus einem PVC-Polyamid-/ Aluminium-Verbund-Tiefziehblister, die Sekundärverpackung aus einer nicht näher spezifizierten offenen Kunststoffhülle zum mechanischen Schutz sowie einer wasserdichten Aluminiumverbundfolie (Abb 1).
2.2 Gehalts- und Reinheitsbestimmung des Pyridostigminbromids, Quantifizierung des Tetramethylharnstoffs
Die Gehalts- und Reinheitsbestimmung des Wirkstoffs erfolgte mittels Umkehrphasen- Hochleistungsflüssigchromatographie (RPHPLC) gemäß der Monographie "Pyridostigminbromid" nach Ph.Eur. 6.0 [1]. Als stationäre Phase wurde die in der Monographie "Pyridostigmine Tablets" des Britischen Arzneibuchs (B.P.) 2008 beschriebene HPLCTrennsäule verwendet [2]. Da die Monographie der Ph.Eur. 6.0 [1] nicht auf die Quantifizierung unbekannter Abbauprodukte ausgelegt ist, wurde das verwendete Verfahren nach den Vorgaben der Official Medicines Control Laboratories (OMCL) [3] gemäß ICH Q2 [4] validiert.
2.3 Stresstest
Um grundlegende Informationen über die Herkunft der Verunreinigung zu erhalten, wurden Stresstests mit Pyridostigminbromid-Tabletten, Pyridostigminbromid-Wirkstoff, Tablettenmatrix sowie einer unverpressten Mischung aus Wirkstoff und Matrix durchgeführt. In wässrigen Lösungen wurde jeweils der Einfluss von Licht (pH 7; 1x105 lux; 12 h), des pH-Wertes (pH 2, pH 7, pH 11; 40 °C; 3 h) und oxidativer Bedingungen (Wasserstoffperoxid 30 %; 20 °C; 12 h) auf die Stabilität des Wirkstoffs bzw. der Matrix getestet. Die Untersuchung der Proben erfolgte mittels HPLC nach 2.2.
2.4 Nachweis von Tetramethylharnstoff (TMU)
Aufbauend auf der Arbeitshypothese, dass beim chemischen Abbau von Pyridostigminbromid sowohl TMU als auch Dimethylamin gebildet werden können, wurden beide Substanzen bei der chromatographischen und spektroskopischen Charakterisierung der unbekannten Substanz berücksichtigt (Retentionszeit und UV-Spektrum). Für die massenspektrometrische Strukturaufklärung des unbekannten Abbauproduktes wurde zunächst in einer modifizierten HPLCMethode die Fraktion des Abbauproduktes wiederholt aufgefangen und die erhaltene Lösung mittels Gaschromatographie-Massenspektrometrie (GC/MS) untersucht (Bedingungen: EI-MS, 70 eV. Massenbereich: m/z 50 - 550). Zusätzlich wurde ein unfraktionierter Gesamtauszug einer langzeitgelagerten Pyridostigminbromid- Tablette mit der GC/MS untersucht.
3. Ergebnisse
3.1 Methodenvalidierung zur Gehaltsbestimmung von TMU
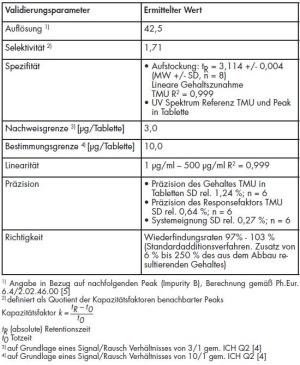
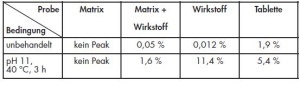
Die ermittelten Validierungsdaten zum Nachweis und zur Quantifizierung von TMU in Pyridostigminbromid-Tabletten sind in Tabelle 1 zusammengefasst. Die Verfahrenskenndaten wurden bis auf die Richtigkeit mit der Methode nach 2.2 bestimmt; die Richtigkeit wurde mittels Standardaddition ermittelt.
3.2. Gehaltsbestimmung von TMU in Pyridostigminbromid-Tabletten
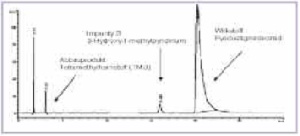
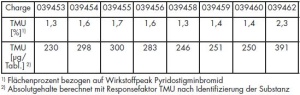
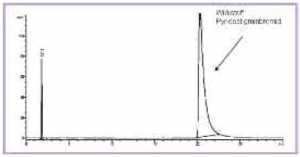
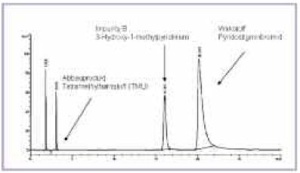
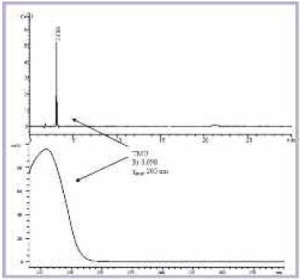
Abbildung 2 zeigt ein typisches HPLCChromatogramm einer Pyridostigminbromid- Tabletten des Einsatzvorrates. Bei einer Retentionszeit [tR] von 3,1 min ist TMU neben dem Wirkstoff-Peak bei 20 min und der Verunreinigung B deutlich zu erkennen. Bei der Untersuchung des Einsatzvorrates wurden TMU-Gehalte zwischen 230 und 391 µg pro Tablette bestimmt (Tab 2). Besonders auffällig war hierbei die Charge 039462, bei der ein Gehalt von 391 µg/Tablette ermittelt wurde.
3.3 Ergebnis der Stressversuche
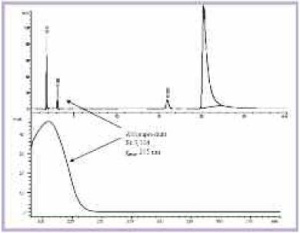
Bei der Langzeitlagerung von Arzneimitteln kann es durch Einflüsse von Temperatur, Licht, Feuchtigkeit oder ggf. auch der Verpackung zu Veränderungen des Arzneimittels kommen. Ziel der Stressversuche war es deshalb, gezielt Erkenntnisse darüber zu erlangen, ob die unbekannte Substanz lagerungsbedingt aus dem Wirkstoff, den Hilfsstoffen, der Matrix oder, bei Ausschluss der erstgenannten Optionen, aus einem Eintrag von außen, z. B. aus der Primärverpackung, stammt. Die verwendeten Hilfsstoffe konnten als Ursache der Veränderungen bereits nach den Stresstests ausgeschlossen werden, da keine Zusammenhänge zu dem unbekannten Peak im HPLC-Chromatogramm hergestellt werden konnten. Bei den wirkstoffhaltigen Zubereitungen zeigten sich unter dem Einfluss von Licht bzw. nach Zusatz eines Oxidationsmittels keine oder nur unspezifische Veränderungen im Chromatogramm. In alkalischer Lösung konnte sowohl bei dem reinen Wirkstoffansatz als auch bei der Wirkstoff-Matrix-Mischung erstmals der unbekannte Peak detektiert werden. Auch bei Verwendung der Pyridostigminbromid- Tabletten war eine deutliche Zunahme dieses Abbauproduktes zu erkennen (Abb 3a und b). Diese Versuche haben somit bewiesen, dass es sich bei der unbekannten Substanz um ein Abbauprodukt des Wirkstoffes handelt.
Die quantitative Bildung des Abbauproduktes TMU nach alkalischer Hydrolyse ist in Tabelle 3 dargestellt. In der Tablette konnte dabei bereits nach 3 Stunden ein Anstieg des TMU-Gehaltes von 1,9 % auf 5,4 % beobachtetet werden. Ein Vergleich der Zunahme der Konzentration von TMU im reinenWirkstoff mit derjenigen in der Mischung von Wirkstoff und Matrix sowie in der Tablette zeigt, dass die Matrix eine protektive Wirkung auf den Abbau hat. Die Zunahme von TMU erfolgt nach der für eine Hydrolyse typischen Reaktionskinetik erster Ordnung bzw. pseudo-erster Ordnung.
3.4 Identifizierung des Abbauproduktes
Die Retentionszeit und das UV-Spektrum der Referenzsubstanz TMU stimmen mit den chromatographischen Daten des Abbauproduktes überein (Abb 4a und 4b).
Dieser Befund wurde im Weiteren mittels GC/MS abgesichert: Zunächst wurde die unbekannte Substanz durch mehrmalige HPLC-Analyse einer Pyridostigminbromid- Tablette aufkonzentriert. Sowohl die mittels HPLC gewonnene Fraktion des Peaks als auch ein unfraktionierter Gesamtauszug der Tablette wurden nachfolgend massenspektrometrisch charakterisiert. Aus den erhaltenen Massenspektren der HPLC-Fraktion ergaben sich im Vergleich zu den MS-Bibliotheksspektren eindeutige Hinweise, dass es sich bei der unbekannten Substanz um TMU handelt. Im Gesamtauszug der Tablette wurde TMU eindeutig massenspektrometrisch nachgewiesen (Abb 5).
Tetramethylharnstoff liefert im Massenspektrum ein Molmassensignal bei m/z 116 und zwei Hauptfragmente bei m/z 72 (Dimethylcarbamoyl-Fragment) und m/z 44 (Dimethylamin-Fragment). Die GC-MS-Untersuchung liefert identische Massenspektren für das unbekannte Abbauprodukt, das Bibliotheksspektrum von Tetramethylharnstoff sowie für die Referenzsubstanz Tetramethylharnstoff. Damit wurde bewiesen, dass es sich bei der unbekannten Substanz in langzeitgelagerten Pyridostigminbromid- Tabletten um das Abbauprodukt Tetramethylharnstoff handelt.
3.5 Orientierende toxikologische Qualifizierung von Tetramethylharnstoff
Ein denkbarer hydrolytischer Abbau von TMU im Gastrointestinaltrakt wurde überprüft. Mittels des nach Identifizierung verfügbaren Responsefaktors von TMU wurden absolute Gehalte von TMU in langzeitgelagerten Pyridostigminbromid-Tabletten bestimmt und damit der relevante Dosisbereich einer peroralen Aufnahme ermittelt. Für eine orientierende toxikologische Qualifizierung von TMU wurden eine Recherche in der Fachdatenbank "Hazardous Substances Data Bank" mit den Suchbegriffen "tetramethylurea" und CAS Nr. "632-22-4" durchgeführt sowie Pubmed gelistete Primärliteratur und das Sicherheitsdatenblatt der Firma Merck gesichtet.
Für die toxikologische Bewertung von TMU wurde ein hydrolytischer Abbau im Gastrointestinaltrakt simuliert. TMU erwies sich dabei über 2 Stunden im pH-Bereich des Gastrointestinaltraktes als stabil. In den untersuchten langzeitgelagerten Pyridostigminbromid-Tabletten wurden Gehalte zwischen 230 µg und 391 µg pro Tablette gefunden. Der durchschnittliche Gehalt beträgt 281 +/- 51 µg TMU (MW +/- SD) pro Tablette. Danach liegt die Tagesdosis bei einer Standarddosierung von einer Tablette alle 8 Stunden zwischen 690 µg und 1 173 µg TMU. Dies entspricht einem Durchschnittswert von täglich 843 +/- 154 µg TMU (MW +/- SD). Unter protektiven Gesichtspunkten wurde für weitere toxikologische Betrachtungen der Maximalwert von gerundet täglich 1 200 µg TMU zugrunde gelegt. Dies entspricht einer Tagesdosis von 17 µg TMU/kg Körpergewicht (KG: 70 kg). Zur Toxizität von TMU liegen keine zugänglichen Humandaten vor. Das Sicherheitsmerkblatt der Firma Merck weist zwar mit dem Risikomerkmal (R-Satz) 22 auf eine perorale Giftigkeit hin [6], doch ist die akute perorale Toxizität im Tierversuch gering. Die LD50 (oral) beträgt für die Ratte 794 mg/kg KG [6]. 150 mg/kg intravenös über 5 Tage verursachten in Hund, Affe und Maus nur leichte Gewichtsverluste [7].
TMU gilt als teratogen. Das Sicherheitsdatenblatt weist für den Umgang mit der Substanz das Risiko Merkmal (R Satz) 61 „Kann das Kind im Mutterleib schädigen“ aus [6]. Nach Munley [8] wurde in einer Fütterungsstudie über 10 Tage mit 100 – 2 500 ppm TMU keine Teratogenität berichtet. Bei Ratten wurde bei einer peroralen Einzeldosis von 500 mg/kg KG, bei Mäusen von 1 000 mg/kg KG eine signifikante teratogene Wirkung festgestellt [9].
4. Diskussion
Im Einsatzvorrat der Bundeswehr befinden sich auch Pyridostigminbromid-Tabletten aus dem Herstellungsjahr 1988. Die Gewährleistung für dieses Arzneimittel endete 1996. Die Produktunterlagen des niederländischen Herstellers Duphar aus dem Jahr 1986 sehen eine spektralphotometrische Gehaltsbestimmung und eine dünnschichtchromatographische Reinheitsbestimmung vor. Diese Methoden eignen sich jedoch - wenn überhaupt - allenfalls sehr bedingt für eine stabilitätsindizierende Analytik. Mit einer dem aktuellen Stand von Wissenschaft und Technik angepassten Methodik wurde eine unbekannte Substanz in langzeitgelagerten Pyridostigminbromid-Tabletten detektiert. In Bezug auf unbekannte Abbauprodukte in neu zugelassenen Arzneimitteln gibt die ICH Guideline Q3B (Impurities in New Drug Products) für den hier relevanten Dosisbereich (maximale Tagesdosis MTD 10 mg - 100 mg) einen Grenzwert von 0,5 % bzw. maximal 200 µg vor (Qualification Threshold) [10]. Der ermittelte Gehalt von durchschnittlich 281 µg pro Tablette übersteigt bei einer Tagesdosis drei Tabletten diesen Wert um den Faktor 4. Legt man den Wert der ICH-Guideline Q3B auch hier zugrunde, so sind Daten zur Herkunft, Identität und Toxikologie der unbekannten Verunreinigung zwingend erforderlich, um eine wissenschaftlich abgesicherte Aussage zur weiteren Verwendbarkeit dieses Präparates des Einsatzvorrates treffen zu können.
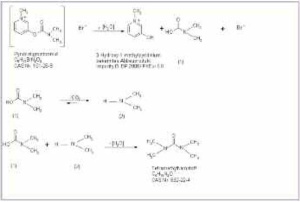
Aufbauend auf den Ergebnissen zur Stabilität des Wirkstoffs in alkalischer Lösung wird für den Abbau von Pyridostigminbromid und der Bildung von TMU folgende Hypothese aufgestellt (Abb 6): Der Abbau basiert auf einer primären Hydrolyse von Pyridostigminbromid zur Dimethylcarbamidsäure (1). Carbamidsäuren sind instabil und decarboxylieren spontan [11], in unserem Fall unter Bildung von Dimethylamin (2).
Sofern die Decarboxylierung der Dimethylcarbamidsäure nicht quantitativ erfolgt, kann aus dem entstandenen Dimethylamin und der noch vorhandenen Dimethylcarbamidsäure unter Wasserabspaltung das Diamid der Kohlensäure, der Tetramethylharnstoff, entstehen. Die analytischen Befunde stützen diese Hypothese. Durch zwei unabhängige Verfahren wurde TMU als Abbauprodukt von Pyridostigminbromid nachgewiesen. Die Bildung von TMU ist damit auch vom chemischen Mechanismus her nachvollziehbar.
Hier nicht berichtete Ergebnisse zeigen, dass TMU in geringer Konzentration auch bei wirkstoffgleichen, im Handel befindlichen Produkten auftritt. Die unter wehrpharmazeutischen Gesichtpunkten ermittelten Daten haben somit auch Relevanz für den zivilen Bereich, zumal davon auszugehen ist, dass derartige Untersuchungen dort nicht durchgeführt werden.
Die ICH-Guideline Q3B [10] empfiehlt ausdrücklich im Rahmen von Qualifizierungsstrategien die Reevaluierung der Werte auf Grundlage der nach Identifizierung zugänglichen Responsefaktoren. Mit dieser Vorgehensweise ergaben sich die angegebenen Absolutwerte für TMU. Die damit zugängliche Tagesdosis an TMU bildet, ungeachtet des Vorhandenseins eines wissenschaftlich begründeten Grenzwertes, die notwendige Grundlage für alle weiteren toxikologischen Abschätzungen.
Die zitierte Studie zur akuten Toxizität von TMU ist mit 5 Tagen intravenös mit der Einnahmedauer beim Menschen vergleichbar. Die systemische Verfügbarkeit ist im Tierversuch aufgrund der intravenösen Gabe höher als bei der peroralen Einnahme anzusetzen. Ein Dosisvergleich zeigt, dass die schwach akut toxischen Effekte im Tier mit einer Dosis von 150 mg/kg KG im Vergleich zur Belastung beim Menschen mit 17 µg/kg um etwa den Faktor 10 000 höher liegen. Für eine Speziesextrapolation ist die Einführung von Sicherheitsfaktoren notwendig. Diese liegen für akut toxische Effekte regelmäßig im Bereich von 100 [12]. Auch unter Berücksichtigung eines derartigen Sicherheitsfaktors ist daher davon auszugehen, dass TMU in dem hier relevanten Dosisbereich der langzeitgelagerten Pyridostigminbromid- Tabletten für den Menschen nicht akut toxisch ist.
Die zur Erzielung eines teratogenen Effektes im Tierversuch verwendeten Dosen liegen ebenfalls mehr als 10 000- fach über der bei vorgeschriebener Anwendung des Arzneimittels zu erwartenden Belastung. Da im Bereich der Reproduktionstoxikologie auch stochastische Effekte zu berücksichtigen sind, kann eine teratogene Wirkung dennoch nicht sicher ausgeschlossen werden. Das Risiko einer teratogenen Wirkung im für den Menschen relevanten Dosisbereich nach Einnahme von langzeitgelagerten Pyridostigminbromid- Tabletten bedarf daher noch weiterer toxikologischer Abklärung in Zusammenarbeit mit dem Institut für Pharmakologie und Toxikologie der Bundeswehr. Bis zur abschließenden Nutzen-Risiko- Abwägung (NRA) ist der Schutzeffekt der durch die Bundeswehr eingelagerten Pyridostigminbromid-Tabletten zur Vorbehandlung einer Phosphonsäureester- Intoxikation gegen ein potentielles Risiko teratogener Effekte des Abbauproduktes Tetramethylharnstoff anlassbezogen abzuwägen.
5. Schlussfolgerungen
Bei der Langzeitlagerung von Pyridostigminbromid- Tabletten entsteht Tetramethylharnstoff als bislang nicht beschriebenes Abbauprodukt des Wirkstoffs. Auf Basis der gesichteten Daten sind im für die Anwendung am Menschen relevanten Dosisbereich bei der Einnahme langzeitgelagerter Pyridostigminbromid- Tabletten akut toxische Wirkungen nicht zu erwarten; ein teratogenes Risiko bedarf weiterer Abklärung. Eine risikoorientierte, dem Stand von Wissenschaft und Technik entsprechende, Untersuchung des Einsatzvorrates liefert Daten zu Abbauwegen und Abbauprodukten, über die oft keine vergleichbaren Erkenntnisse aus dem zivilen Bereich vorliegen. Die Wehrpharmazie leistet damit einen wichtigen Beitrag zur Nutzen-Risiko- Bewertung des Einsatzvorrates und zur weiteren logistischen Lagebeurteilung auf diesem Gebiet. Gleichzeitig kommt die Bundeswehr mit diesen aufwändigen Untersuchungs- und Qualifizierungsstrategien gesetzlichen Vorgaben und der Fürsorgepflicht gegenüber dem Soldaten nach.
Literatur:
-
Europäisches Arzneibuch 6.0 Band 3. Stuttgart: Govi Verlag 2008; 3804 - 3806
-
British Pharmacopea Volume III. London: The Stationary Office 2008; 3035 3036
-
OMCL Quality Assurance Document PA/PH/OMCL (05) 47 DEF, Validation of Analytical Procedures 2005
-
International conference on harmonization of technical requirements for registration of pharmaceuticals for human use, ICH Harmonised Tripartide Guideline Q2, Validation of Analytical Procedures Text and Methodology 2005
-
Europäisches Arzneibuch 6.4 (4. Nachtrag). Stuttgart: Govi Verlag 2010; 5829 5837
-
Merck Sicherheitsdatenblatt gemäß EG Richtlinie 91/155/EWG Stand 10.11. 2006 für Tetramethylharnstoff zur Synthese
-
Dixon RL, Adamson RH, Ben M, Rall DP: Toxicity and pharmacology of an unusual solvent-tetramethylurea. Arch. Int. Pharmacodyn Ther 1966; 160: 333-341
-
Munley SM, O´Neill AJ, Tyler DL, Hurtt ME, Kennedy GL: Developmental toxicity study of tetramethylurea (TMU ) in rats. Drug. Chem Toxicol 2001; 24: 259-271
-
Teramoto S, Kaneda M, Aoyama H, Shirasu Y: Correlation between the molecular structure of N-Alkylureas and N-Alkylthioureas and their teratogenic properties. Teratology 1981; 23: 335-342
-
International conference on harmonization of technical requirements for registration of pharmaceuticals for human use, ICH Harmonised Tripartide Guideline Q3B, Impurities in new drug products 2006
-
Beyer H: Lehrbuch der organischen Chemie, 18. Auflage. Stuttgart: Hirzel Verlag 1976; 298-306
-
Edler L, Poirier K, Dourson M, et al.: Mathematical modelling and quantitative methods. Food and chemical toxicology 2002; 40: 283-326
Danksagung:
Frau Christiane Hochreiter danke ich für die ausgezeichnete, technische Unterstützung, Frau Nada Vujtovic-Ockenga für die versierte Durchführung der GC/MS Messungen.
Datum: 14.10.2010
Quelle: Wehrmedizinische Monatsschrift 2010/10