Die Abteilung Pharmazie - Zentrale Arzneimittel- und Medizinprodukteuntersuchung in der Bundeswehr
Aus der Abteilung Pharmazie (Abteilungsleiter: Oberstapotheker Dr. B. Klaubert) des Zentralen Institutes des Sanitätsdienstes der Bundeswehr München (Leiter: Oberstapotheker Dr. T. Zimmermann)
S. Jüttemeyer
Die Abteilung IV – Pharmazie des ZInstSanBw München ist die zentrale Arzneimittel- und Medizinprodukteuntersuchungsstelle der Bundeswehr. Ihr Auftrag ist es, die pharmazeutische Qualität der in der Bundeswehr genutzten und hergestellten Arzneimittel und Medizinprodukte sicherzustellen. Neben Proben aus der Herstellung der Bundeswehrapotheken werden die im Rahmen der amtlichen Arzneimittel- und Medizinprodukteüberwachung durch den Arzneimittelüberwachungsbeauftragten der Bundeswehr (AMÜBBw) gemäß § 65 Arzneimittelgesetz (AMG) bzw. § 26 Medizinproduktegesetz (MPG) entnommenen Proben untersucht und begutachtet.
Weiterhin werden nicht in Deutschland oder der Europäischen Union verfügbare und aus Nicht-EU-Ländern importierte Arzneimittel, wie z. B. das Malaria-Mittel Artesunat, vor der Abgabe an eine Sanitätseinrichtung gemäß § 76 AMG untersucht und so die pharmazeutische Qualität, Wirksamkeit und Unbedenklichkeit gewährleistet.
Ein weiterer Schwerpunkt der Abteilung Pharmazie liegt auf der Stabilitätsuntersuchung von Arzneimitteln, um die Verwendbarkeit langzeit- oder unter extremen klimatischen Bedingungen gelagerter Produkte abschätzen und Verfalldaten für selbst hergestellte Medikamente festlegen zu können. Den Ergebnissen der Laborgruppe Arzneimitteluntersuchung kommt dabei insbesondere bei zentral bewirtschafteten Arzneimitteln ohne Verfalldatum eine besondere Bedeutung zu, da diese die abschließende Qualitätsbeurteilung der Produkte vornimmt. Bedenkt man, dass Morphininjektionslösungen seit 25 Jahren ohne erkennbare Qualitätsverluste in den Depots gelagert werden, ist die Fähigkeit für die Arzneimittelbevorratung unerlässlich. Der folgende Beitrag berichtet über ausgewählte Teilbereiche und Projekte der Abteilung Pharmazie und gibt einen Einblick in die fachliche Kompetenz auf dem Gebiet der Arzneimittel- und Medizinprodukteuntersuchung.
Autoinjektoren – unverzichtbare Arzneimittel im weltweiten Einsatz
Die Verwendung von Autoinjektoren bietet bei Notfällen und eingeschränkten personellen Ressourcen erhebliche Vorteile gegenüber der Standardapplikation von Arzneistoffen. Insbesondere bei Massenanfällen von Verletzten und bei Einsatz von Kampfstoffen sind Autoinjektoren lebensrettend. Die im weltweiten Einsatz benötigten Autoinjektoren sind dabei nicht nur speziellen äußeren Einflüssen ausgesetzt, sondern sind auf dem zivilen Markt nicht bzw. nicht sicher vorhanden. Zur Behandlung von Nervenkampfstoffvergiftungen verfügt die Bundeswehr über einen Atropin-Autoinjektoren (AtroPen®) und einen Atropin-Obidoxim-Kombinationsautoinjektor (ATOX II ComboPen®). Zusätzlich findet der Morphin-Autoinjektor zur Behandlung akuter Schmerzzustände im Rahmen der Selbst-und-Kameraden-Hilfe Anwendung. Seit der Einführung des ersten Insulinpens im Jahr 1985 haben Autoinjektoren einen festen Platz in der Arzneimittelapplikation z. B. zur Behandlung lebensbedrohlicher anaphylaktischer Reaktionen bei Lebensmittel- oder Bienengiftallergien, jedoch finden sich die für militärische Einsätze notwendigen Kombinationen aus Arzneiform und Wirkstoffen nicht auf dem deutschen Arzneimittelmarkt. Nachdem der bisherige Vertragspartner für diese speziellen Arzneimittel aktuell nicht in der Lage ist, weder den ATOX II ComboPen® noch den Morphin-Autoinjektor zu liefern, war die eingeschränkte und nicht sichere Verfügbarkeit dieser aus wehrpharmazeutischer Sicht unentbehrlichen Notfallarzneimittel Grund für die Implementierung eines „Projektteams Autoinjektoren“ durch den Inspekteur des Sanitätsdienstes im Februar 2015. Basierend auf dem Bereichserlass D-1073/1 zur Herstellung von Sanitätsmaterial, befasst sich das Projektteam seither in enger Abstimmung mit dem Bundesamt für Ausrüstung, Informationstechnik und Nutzung der Bundeswehr mit der Erarbeitung der Ausschreibungsunterlagen, um die Eigenherstellung dieser spezifischen Arzneimittel am Bundeswehrkrankenhaus Ulm ab 2019 zu etablieren. Die Abteilung Pharmazie unterstützt dieses Projekt mit analytischen Beiträgen zur Charakterisierung möglicher Primärpackmittel, wie Glasspritzen, Kunststoffbauteile, Kleber oder Stopfen und zur Etablierung neuer Methoden der Wirkstoffcharakterisierung.
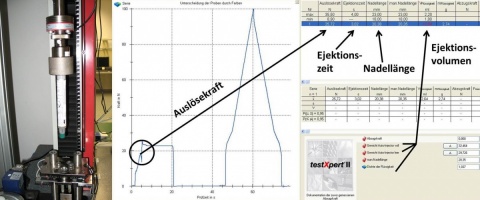
Im Rahmen einer in der Abteilung IV des ZInstSanBw München durchgeführten Bachelorarbeit wurde hierzu ein entscheidender Beitrag geliefert. Bei der Suche nach möglichen Primärpackmitteln, also Bestandteilen des Autoinjektors, die mit der Arzneistofflösung in direktem Kontakt stehen, wurden unterschiedlichste Materialien mit Hilfe einer eigens hierfür entwickelten gaschromatographischen Methode mit Detektion an einem IonTrap-Massenspektrometer (GC-IonTrap-MS) nach Stir Bar Sorptive Extraction (SBSE) auf ihr Extractables & Leachables (E&L) Profil hin untersucht. Extractables sind Substanzen, die bei Anwendung extremer Bedingungen wie erhöhter Temperatur oder erhöhter Lösungsmittelstärke aus dem Packmittel extrahiert werden können. Leachables sind Migrationsstoffe, die bei den im Arzneimittel vorherrschenden Bedingungen aus der Verpackung in die Zubereitung übergehen. Hierdurch konnten, unter anderem, geeignete Elastomerstopfen für die Verwendung in einem Autoinjektor charakterisiert und ausgewählt werden. Auch alternative Materialien zu Glas, wie z. B. Cyclic-Olefin-Polymer-Zylinder (COP), wurden untersucht. Weiterhin wurde in der Abteilung IV eine neue Rezeptur für einen Einkammer-Atropin-Obidoxim-Autoinjektor mit einem Füllvolumen von 1,5 ml entwickelt und erste Stabilitätsstudien durchgeführt, die bisher eine Stabilität der Lösung über mehr als sechs Monate nachweisen.
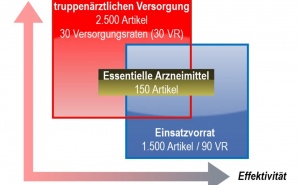
Sind unsere Arzneimittel im Einsatz sicher?
Die Applikation von Notfallarzneimitteln ist essentieller Bestandteil in der Primärversorgung verwundeter Soldaten im weltweiten Einsatz. Die Arzneimittel werden im Allgemeinen in parenteraler Darreichungsform in Rettungsmitteln und Sätzen zur Notfallversorgung vorgehalten und angewendet.
Für diese Arzneimittel wurden im Rahmen des Zulassungsverfahrens Stabilitätsdaten unter standardisierten Lagerungsbedingungen ermittelt, welche vornehmlich die Klimazonen I (kalt) und II (gemäßigt) abdecken. Diese genormten regulatorischen Bedingungen stimmen jedoch nicht mit den Szenarien überein, unter denen Arzneimittel im Einsatz gelagert und appliziert werden.
In der Folge muss die Entscheidung über die pharmazeutische Qualität und damit die Arzneimittelsicherheit der Medikamente durch den verantwortlichen SanStOffzApotheker bzw. behandelnden SanStOffzArzt vor Ort getroffen werden, ohne dass hierzu wissenschaftlich abgeleitete Daten vorliegen. Die Laborgruppe Pharmazeutische Forschung und Entwicklung erarbeitet daher Daten zur Stabilität von Arzneimitteln unter Einsatzbedingungen, um so die Sicherheit der Arzneimittelanwendung im Einsatz zu verbessern.
Basierend auf dem Arzneimittelvorrat und einsatzrelevanter Indikationen wurden 64 Produkte, meist parenterale Arzneimittel, zur Untersuchung ausgewählt. Diese Arzneimittel wurden in Zusammenarbeit mit der SanMatVersEinr sowie einer PiAusbKp unter den Bedingungen einer mobilen Ausbildungsmission in Westafrika über einen Zeitraum von insgesamt einem Jahr real exponiert. Temperatur und Feuchtigkeit der Arzneimittel wurden mittels Datenlogger kontinuierlich aufgezeichnet, um daraus die mittlere kinetische Temperatur zu ermitteln. Die mittlere kinetische Temperatur über einen definierten Zeitraum stellt diejenige Temperatur dar, welche dieselbe thermische Belastung für einen Wirkstoff darstellt wie verschiedene höhere und tiefere Temperaturen über denselben Zeitraum. Sie berücksichtigt dazu die sogenannte Arrhenius-Gleichung und stellt damit den relevanten Parameter für die thermische Belastung von Arzneimitteln dar.
Nach monatlichem Probenzug und Versand der im Einsatz exponierten Arzneimittel zum ZInstSanBw München erfolgte die Analytik mittels Hochdruckflüssigchromatograpie im Kombination mit einer hierzu neu etablierten Charged Aerosol Detektion (CAD). Das Messprinzip beruht dabei auf der Messung der Ladung an der Oberfläche des in ein Aerosol überführten Analyten. Es ermöglicht damit, auch Analyten ohne Chromophor zu erfassen und liefert im Idealfall einen strukturunabhängigen Response. Damit ist dieses Verfahren zur Erfassung und Quantifizierung von Abbauprozessen besonders geeignet.
Die detaillierten Ergebnisse und Erkenntnisse aus dem Sonderforschungsvorhaben werden im Jahr 2017 veröffentlicht. Nach dem derzeitigen Stand der Auswertungen konnte aber gezeigt werden, dass die untersuchten Arzneimittel bis auf wenigen Ausnahmen wie z. B. Norepinephrin, Dexamethason oder Suxamethonium stabil sind.
Dienstleister im Sinne der Qualitätssicherung
Ringversuche sind zu einem unentbehrlichen Instrument des Qualitätsmanagements, sowohl in Apotheken als auch in Laboren geworden. Eine regelmäßige Teilnahme an solchen Vergleichsuntersuchungen ist integraler Bestandteil der externen Qualitätskontrolle im Sinne der DIN 9001 oder der DIN EN ISO/EC 17025. Mit ihrer Hilfe ist eine Aussage über die Qualität, sei es von Rezepturen oder analytischen Ergebnissen, sowie über die Messgenauigkeit und Reproduzierbarkeit von Analysenergebnissen möglich.
Die Herstellung von Rezepturen ist eine wichtige Aufgabe der Bundeswehrapotheken. Die für den Patienten individuell angefertigten Arzneimittel, sind auf dessen Bedürfnisse zugeschnitten. Sie stellen eine wichtige Therapieoption im pharmazeutisch-medizinischen Bereich dar, um therapeutische Lücken die ggf. durch Fertigarzneimittel nicht abgedeckt werden können, zu schließen.
Zusätzlich zu den kommerziell angebotenen Rezepturringversuchen, führt die Abteilung IV seit 2011 verpflichtende bundeswehrinterne Vergleichsuntersuchungen für einsatzrelevante Arzneimittel durch. Gemäß Bereichsvorschrift C1-841/0-4007 werden diese im vierteljährlichen Turnus für alle Bundeswehrapotheken, inklusive der Einsatzapotheken, angeboten. Für die Ringversuche werden als Grundlage das Rezeptur-Portfolio des Deutschen Arzneimittel-Codex/ Neues Rezeptur-Formulariums (DAC/NRF) sowie Herstellungsvorschriften des Bundesverbandes Deutscher Krankenhausapotheken (ADKA) verwendet. Das Rezepturspektrum reicht dabei von festen Arzneiformen wie z. B. Berliner-Blau-Kapseln (Eisen(III)hexacyanoferrat) welche als Antidot bei Cäsium-oder Thallium-Vergiftungen verabreicht werden, bis zu steril hergestellter Chinindihydrochlorid-Lösung, die bei der Behandlung von Malaria-Erkrankungen Verwendung findet. Ein weiterer Schwerpunkt liegt zudem auf halbfesten Zubereitungen wie Salben, Cremes und Gelen, bei denen eine gleichmäßige Wirkstoffverteilung innerhalb des Abgabegefäßes von großer Wichtigkeit für den Therapieerfolg und die Arzneimittelsicherheit ist.
Nach Versand einer Musterverschreibung des herzustellenden Arzneimittels haben die Apotheken vier Wochen Zeit diese herzustellen und einzusenden. Die Ergebnisse werden abschließend statistisch ausgewertet und in Form eines Berichts anonymisiert veröffentlicht. Zusätzlich erhalten die teilnehmenden Apotheken ein individuelles Zertifikat über die erfolgreich absolvierten Prüfparameter.
Neben Parametern wie Aussehen und Beschaffenheit werden standardmäßig die Identität des eingesetzten Wirkstoffs und dessen Gehalt sowie bei halbfesten Zubereitungen dessen Verteilung im Herstellungsansatz untersucht. Ein weiterer Parameter, der in jedem Ringversuch überprüft wird, ist die Übereinstimmung der Kennzeichnung mit den Vorgaben des § 14 der Apothekenbetriebsordnung (ApBetrO). Weitere, von der jeweiligen Rezeptur und Arzneiform abhängige Parameter ergänzen das Untersuchungsspektrum.
Die Pflicht an Ringversuchen teilzunehmen gilt aber nicht nur für Apotheken gemäß § 2a ApBetrO, sondern auch für Labore die nach DIN EN ISO/EC 17025 akkreditiert sind. Damit wird gewährleistet, dass die Qualität der dort ermittelten Ergebnisse gesichert ist und somit der Nachweis der Kompetenz erbracht werden kann.
2016 hat die Abteilung IV des ZInstSanBw München als Pilot-Projekt einen externen Ringversuch für die deutschen Mitglieder des OMCL-Netzwerkes (Official Medicines Control Laboratories) angeboten. Dafür wurden Tabletten an sieben Landesuntersuchungsstellen versendet, die jeweils eine Prüfung der vom Europäischen Arzneibuch geforderten Parameter für feste Arzneiformen (Ph. Eur. 8.0 / 2.9.1- 2.9.8) durchzuführen hatten. Untersucht wurden hierbei Parameter wie Bruchfestigkeit und Friabilität, die nicht sehr häufig durch kommerzielle Ringversuchs-Anbieter abgefragt werden. Gerade für diese pharmazeutisch-technologischen Parameter sind solche Ringversuche aber essentiell, um zu ermitteln, wie groß die Streuung der Messergebnisse zwischen den Laboren ist, um dadurch die Qualität der Ergebnisse besser beurteilen zu können. Dies ist unabdingbar, um bei Untersuchungsergebnissen außerhalb der Spezifikation abschätzen zu können ob diese einen tatsächlichen Qualitätsmangel darstellen, durch einen Anwender-Fehler verursacht wurden oder auf den eingesetzten Gerätetyp zurückzuführen bzw. abhängig von den internen Geräte-Parametern sind.
Ein Beispiel für solch einen Parameter ist die Bruchfestigkeit einer Tablette, die eine Aussage über den Herstellungsprozess ermöglicht. Im Rahmen des durch das ZInstSanBw München Abteilung IV angebotenen Ringversuchs festgestellte starke Streuungen der Messwerte zwischen den teilnehmenden Laboren zeigten, dass die erhaltenen Ergebnisse abhängig vom Gerätetyp und den intern eingestellten Parametern sind.
Medizinprodukteuntersuchung: „Physikalische Pharmazie“
Natürlich gibt es keine „physikalische Pharmazie“ im Curriculum des Pharmaziestudiums. Gleichwohl beschränken sich die EVGSan nicht auf Arzneimittel, sondern umfassen u. a. auch die Medizinprodukte in ihrer ganzen Vielfalt. In der Abteilung IV werden viele nichtaktive Medizinprodukte und In-vitro-Diagnostika untersucht und beurteilt, ob die gemessenen Eigenschaften den Anforderungen entsprechen, die an das Medizinprodukt gestellt werden. Solche Anforderungen sind beispielsweise in DIN-Vorschriften, den Technischen Dokumentationen der Herstellerfirmen oder den Technischen Lieferbedingungen der Bundeswehr hinterlegt. Nur wenn diese und einige andere grundlegenden Anforderungen für das Medizinprodukt erfüllt sind, darf nach einem sogenannten Konformitätsbewertungsverfahren das CE-Kennzeichen vergeben werden, ohne das ein Medizinprodukt in Deutschland nicht verkehrsfähig ist.
Ein klassisches nichtaktives Medizinprodukt unterscheidet sich vom Arzneimittel dadurch, dass es seine Wirkung weder auf pharmakologische, noch metabolische, noch immunologische Weise entfaltet. Oftmals hängen seine Wirkung und die wesentlichen Merkmale von den physikalischen Eigenschaften ab – und damit schließt sich der Kreis zum eingangs unterbreiteten Statement.
Einen nicht unerheblichen Anteil am Arbeitsaufkommen in der Teileinheit Medizinprodukteuntersuchung nimmt darüber hinaus die Prüfung von Nähten siegelfähiger Folien ein. Diese finden überall dort Verwendung, wo mehrfach sterilisierbare Instrumente nach der Aufbereitung steril verpackt sein müssen. Die zumeist im Autoklaven zu sterilisierenden Werkzeuge werden dabei in spezielle Klarsichtbeutel und -schläuche aus porösen Materialien und Kunststoff-Verbundfolie eingebracht, versiegelt, und anschließend dem Temperatur- und Druckprogramm unterzogen, das die Abtötung von Keimen und Sporen gewährleistet. Der Verpackungsprozess muss nach DIN EN ISO 11607-2 validiert sein, was u. a. die regelmäßige, d.h. jährliche Prüfung der durch die Siegelgeräte produzierten Siegelnahtfolien beinhaltet. Die DIN EN 868-5 schreibt vor, dass eine Siegelnaht mindestens 6 mm breit sein muss, und die Kraft, die bei einem genau 15 mm breiten Prüfling benötigt wird, um die Naht durch Auseinanderziehen zu öffnen, an einer Stelle der Naht mindestens 1,5 N hoch zu sein hat. Die „Versagerquote“ lag in den Jahren 2010 bis 2015 durchschnittlich bei etwa 10 %. Mit der Aussonderung der Impulssiegelgeräte und Ersatz durch ein validierbares Modell, das die Anforderungen des Robert-Koch-Instituts erfüllt, beschränkt sich die Anzahl der Tests, bei denen die Kriterien nicht eingehalten wurden, auf absolute Ausnahmefälle (voraussichtlich < 1 % im Jahr 2016). Die Bereichsvorschrift C1-841/0-4003 „Zentrale Durchführung der Siegelnahtfestigkeitsprüfung von siegelfähigen Klarsichtbeuteln und -schläuchen“ regelt detailliert die Prüfung.
Wie wichtig die amtliche Überwachung von bereits auf dem Markt befindlichen Medizinprodukten ist, zeigen die Statistiken der vergangenen Jahre, bei denen die Beanstandungen kontinuierlich im niedrigen zweistelligen prozentualen Bereich verortet sind. Das Augenmerk richtet sich bei den zivilen Kollegialstellen in ihrer Gesamtheit nur rudimentär auf Medizinprodukte, sodass hier der Bundeswehr eine besondere Aufgabe im Kanon der medizinischen Überwachungslandschaft zukommt. Dies zeigt sich nicht zuletzt daran, dass die Laborgruppe Medizinprodukteuntersuchung immer wieder im Rahmen der Amtshilfe um Unterstützung gebeten wird. Trotzdem bemüht sich die Teileinheit in Zusammenarbeit mit dem AMÜBBw insbesondere um die Untersuchung wehrpharmazeutisch relevanter Artikel, wie beispielsweise dem Inhalt der „persönlichen Erste-Hilfe-Ausstattung“, um dort sicherzugehen, dass unseren Soldaten nur solches Material an die Hand gegeben wird, das den Anforderungen an ein zuverlässiges Medizinprodukt entspricht.
Güteprüfungen, die produktionsbegleitend die Qualität sichern, wie sie beispielsweise für das Brandwundenverbandpäckchen vorgesehen sind, Nachuntersuchungen, die für über das Verfalldatum hinaus langzeitgelagerte Medizinprodukte vorgesehen sind, wie z. B. bei Bifurkationsnadeln für Pockenimpfstoff und Untersuchungen von Verdachtsproben, die durch die zuständige Stelle im Kdo SanDstBw beauftragt werden, ergänzen das Spektrum der Teileinheit Medizinprodukteuntersuchung.
Anschrift für die Verfasser:
Oberstabsapotheker Dr. Sandra Jüttemeyer
Zentrales Institut des Sanitätsdienstes der Bundeswehr München
Abteilung IV - Pharmazie
Ingolstädter Landstraße 102
85748 Garching
E-Mail: [email protected]
Datum: 31.05.2017
Wehrmedizin und Wehrpharmazie 2017/01