„Wie sag ich’s meinem Kinde?“ – Fallbeispiele gut vertragener HIV-Postexpositionsprophylaxen im tropischen Einsatzgebiet-„How do I put it?“ - case reports on well tolerated HIV post-exposure prophylaxis on deployment in the tropics
Aus dem Fachbereich Tropenmedizin am Bernhard-Nocht-Institut (Leiterin: Oberfeldarzt Dr. D. Wiemer) des Bundeswehrkrankenhauses Hamburg (Chefarzt: Generalarzt Dr. J. Hoitz)
Zusammenfassung
Hintergrund: Aufgrund der schlechten Verträglichkeit von gegen HIV (humanes Immundefizienzvirus) wirksamen Arzneimitteln der ersten Generation herrscht bei vielen Sanitätsoffizieren die Auffassung, dass bei Erfordernis einer HIV-Postexpositionsprophylaxe (PEP) der betreffende Soldat zu repatriieren sei.
Die verbesserte Verträglichkeit der neuen Wirkstoffe relativiert jedoch diese Auffassung.
Falldarstellung: An zwei Beispielen von Soldaten, die im tropischen Afrika eingesetzt waren, wird die erfolgreiche Durchführung einer HIV-PEP nach sexueller Indikation im Einsatz beschrieben. Nennenswerte Nebenwirkungen traten nicht auf. In einem Fall konnte nach negativer Testung der Indexperson die PEP vorzeitig abgesetzt werden. Um die Anonymität der Betroffenen zu schützen, wurde auf Angaben zu Einsatzort und Nationalität verzichtet.
Diskussion/Fazit: Sowohl das Nebenwirkungsprofil moderner HIV-Arzneimittel, als auch ihre Kombinierbarkeit mit Medikamenten zur Malariaprophylaxe sind mit einer Verwendung im Einsatz vereinbar. Im Einverständnis mit dem Betroffenen und mit überschaubarem, in einer Role-2-Sanitätseinrichtung realisierbarem Überwachungsaufwand kann eine HIV-PEP entsprechend auch im Einsatz erfolgen.
Schlagwörter: HIV, Postexpositionsprophylaxe, Einsatz, Präexpositionsprophylaxe, Überwachung, sexuelle Exposition
Summary
Background: Based on considerable side effects of first-generation HIV (human immunodeficiency virus) drugs, many medical colleagues consider the need of HIV post-exposure prophylaxis (PEP) as a reason for repatriations of soldiers from deployment. However, improved tolerability of new drugs makes this consideration debatable.
Case report: Based on two case reports about soldiers on deployment in sub-Saharan Africa, successful application of HIV-PEP on deployment after sexual exposure is described. Relevant side effects were not observed. In one instance, HIV-PEP could be aborted after negative testing of the index person. Neither details on the deployments nor on the nationality are presented to protect the anonymity of the affected individuals.
Discussion/Conclusions: Both, the profile of side effects of modern HIV drugs as well as the option of combining them with the currently used anti-malarial drugs allow for the application of HIV-PEP on deployment. Prerequisites are the agreement of the affected one and the availability of a medical role 2 facility to ensure follow-up assessments.
Keywords: HIV, post-exposure prophylaxis, deployment, pre-exposure prophylaxis, follow-up, sexual exposition
„Jede Unwissenheit ist bedauerlich, aber Unwissenheit auf einem so wichtigen Gebiet wie der Sexualität ist eine ernste Gefahr.“
Bertrand Russel, Philosoph
Hintergrund
Die frühzeitig (2 - 24, spätestens aber 72 Stunden) nach ungeschütztem Sexualkontakt mit einem HIV-positiven Partner begonnene Postexpositionsprophylaxe (PEP) ist eine wichtige Maßnahme zum Schutz vor einer HIV-Infektion. Teils erhebliche Nebenwirkungen der zur PEP eingesetzten HIV-Arzneimittel der ersten Generation schränkten die Verwendungsfähigkeit der betroffenen Soldaten zum großen Teil so sehr ein, dass nahezu regelmäßig eine Repatriierung erfolgte. Diese Auffassung wird weiterhin vielfach vertreten, muss aber vor dem Hintergrund der besseren Verträglichkeit heute verfügbarer Präparate relativiert werden, wie die nachfolgenden Fallberichte zeigen.
Falldarstellungen
Fall 1: Erst mit Bacchus gefeiert, dann zwischen Venus und Aphrodite erwacht
Nach intensiver Beratung durch eine sehr resolute Paramedic, also eine medizinisch qualifizierte und auch als Dolmetscherin fungierende Vertrauensperson in nationaler disziplinarer Unterstellung, stellte sich ein Soldat in gutem Allgemein- und Ernährungszustand (ca. 180 cm, 100 kg, Bodybuilderstatur) in der truppenärztlichen Sprechstunde vor. Die Malaria-Chemoprophylaxe erfolgte mit Doxycyclin-Monohydrat 100 mg/Tag und war, nach Angaben des Betroffenen, regelmäßig eingenommen worden. Weitere Medikamenteneinnahmen wurden nicht angegeben.
Der Betroffene berichtete mit Zeichen offensichtlichen Schamgefühls, an einem abendlichen Trinkgelage mit Kameraden teilgenommen und dabei in überreichlichem Maße Alkohol konsumiert zu haben. Am nächsten Morgen sei er mit eingeschränkter Erinnerung zwischen zwei afrikanischen Sexarbeiterinnen erwacht. Die Kameraden hätten wohl zusammengelegt und sie ihm auf die Stube geschickt. Nun habe er große Angst, sich mit Geschlechtskrankheiten infiziert zu haben und bat um eine HIV-Postexpositionsprophylaxe (PEP). Wie er ferner unter Tränen berichtete, habe er große Angst, aus diesem Grund repatriiert zu werden, da er nicht nur massive dienstrechtliche, sondern auch soziale Implikationen fürchte. Die Sozialanamnese ergab, dass der Betroffene im Heimatland verheiratet ist und kleine Kinder erzieht. Die beiden Sexarbeiterinnen ließen sich nicht mehr auffinden, so dass bei ihnen ein HIV-Ausschluss zur Risikoabschätzung nicht möglich war.
Der Betroffene wurde intensiv über die Risiken und Nebenwirkungen einer HIV-PEP einschließlich der Bedeutung des „off-label“-Gebrauchs von HIV-Medikamenten und die eingeschränkten diagnostischen Möglichkeiten zum Monitoring in der sanitätsdienstlichen Role-2-Einrichtung aufgeklärt. Im Anschluss wurde eine PEP mit der in der Sanitätseinrichtung zu diesem Zwecke vorgehaltenen Kombination Tenofovir/Emtiricitabin (Truvada®) 245 mg/200 mg (1-0-0) und Raltegravir (Isentress®) 400 mg (1-0-1) mit einem geplanten Einnahmezeitraum von vier Wochen im Einsatz begonnen. Zu Beginn der Medikamenteneinnahme wurden ferner – im Sinne einer Nullprobe – ein im Einsatz verfügbares Routinelabor (inklusive Leber- und Nierenparameter) sowie Schnellteste auf Lues und HIV durchgeführt, die unauffällige Ergebnisse zeigten.
Der Betroffene stellte sich zur wöchentlichen Verlaufskontrolle vor. Die PEP wurde subjektiv gut vertragen und compliant eingenommen. Die Leber- und Nierenparameter blieben im Verlauf unauffällig. Nach drei Wochen wurde der Truppenarzt durch einen Kollegen abgelöst, und die Spur des Betroffenen verlor sich. Eine zu diesem Zeitpunkt als sehr frühe Verlaufskontrolle durchgeführte HIV-Schnelltestuntersuchung war negativ. Der Betroffene wurde aufgeklärt, dass der Test zu diesem Zeitpunkt noch nicht aussagekräftig sei und sich das diagnostische Fenster von HIV um den Zeitraum der HIV-PEP verlängert.
Fall 2: Von Verlangen und Kalkül
Ein Soldat stellte sich in der truppenärztlichen Sprechstunde in einer Role-1-Einrichtung im tropischen Afrika vor. Zur Malariaprophylaxe nahm er Doxycyclin-Monohydrat 100 mg/Tag compliant ein. Der Betroffene berichtete von ungeschütztem Geschlechtsverkehr mit einer Einheimischen, die er in einem Lokal kennengelernt habe. Er habe zwar eigentlich ein Kondom benutzen wollen, die afrikanische Partnerin habe dies aber mit der Begründung abgelehnt, dass sie „das so nicht möge“. In der Situation – seinem drängenden sexuellen Bedürfnis folgend – habe er ihrem Wunsch entsprochen, mache sich nun aber Gedanken um sexuell übertragbare Erkrankungen, insbesondere HIV. Er bat um einen HIV-PEP, eine Repatriierung sei für ihn dienstlich wie auch persönlich keine Option.
Nach ausführlicher Aufklärung wurde eine HIV-PEP mit Tenofovir/Emtiricitabin (Truvada®) 245 mg/200 mg
(1-0-0) und Raltegravir (Isentress®) 400 mg (1-0-1) begonnen. Leber- und Nierenparameter sowie Schnellteste auf Lues und HIV waren in der Erstuntersuchung zu Beginn der Medikamenteneinnahme unauffällig.
Sieben Tage nach Einleitung der PEP wurde die Sexualpartnerin des Betroffenen zur freiwilligen HIV-Testung in der truppenärztlichen Sprechstunde vorstellig. Da die Partnerin HIV-negativ getestet wurde und in der körperlichen Untersuchung unauffällig war, so dass sich kein Hinweis auf ein aktuelles Serokonversionsstadium fand, konnte der Soldat seine HIV-PEP mit ärztlichem Einverständnis nach sieben Einnahmetagen absetzen. Auf Rückfragen gab die Partnerin, die bereits ein Kind mit einem afrikanischen Partner hatte, an, sie habe bewusst auf das Kondom verzichtet. Grund sei, dass sie von dem Soldaten habe schwanger werden wollen, um auf diese Weise den schwierigen sozialen Verhältnissen in ihrem Land entkommen und nach Europa migrieren zu können. Hinweise auf professionelle Sexarbeit fanden sich nicht.
Diskussion
Sexuelles Expositionsrisiko im tropischen Einsatz
„Bereiten Sie Ihre jungen Soldaten auf den Kontakt mit aggressiven sexuellen Kulturen vor.“ Mit diesen eindringlichen Worten machte Dr. Gunther von Laer, damals Leiter des Ärztlichen Dienstes des Auswärtigen Amts, bereits im September 2003 während einer Fortbildung am Bundeswehrkrankenhaus -(BwKrhs) Berlin auf die Bedeutung der Prävention von sexuell übertragbaren Erkrankungen (STD) in tropischen Auslandseinsätzen aufmerksam. Schon 2006, im Rahmen von EUFOR RD Congo (European Union Force Demokratische Republik Kongo, Unterstützungsmission zur Sicherung der Wahlen), sollte sein mahnender Aufruf an Aktualität gewinnen, als sich am Strand von Gabun in großer Zahl europäisch-afrikanische Pärchen bildeten. Das Zusammentreffen mit einer Kultur, in der sexuelle Kontakte ungleich niederschwelliger realisierbar sind als im vergleichsweise konservativen West- und Mitteleuropa und in der die Grenzen zwischen konsensueller Sexualität und Sexarbeit teils fließend ineinander übergehen, stellte für unsere Soldaten eine nicht kleinzuredende Versuchung dar. Letztgenanntes Phänomen des fließenden Übergangs wird auch im aktuellen Fallbeispiel 2 deutlich, in dem – wie sich im Verlauf anamnestisch herausstellte – das Zustandekommen des Geschlechtsverkehrs weniger dem persönlichen Charme des Soldaten als vielmehr den Migrationshoffnungen der afrikanischen Partnerin für den Fall des erfolgreichen Zustandekommens einer Schwangerschaft zuzurechnen war.
Der Reiz sexueller Abenteuer jenseits des heimischen Umfelds ist hoch. Von einer britischen Urologieabteilung wurde 1995 dokumentiert, dass 25 % ihrer Patienten auf Auslandsreise sexuelle Beziehungen eingegangen seien. In zwei Drittel der Fälle kamen Kondome dabei nicht oder nur gelegentlich zum Einsatz [1]. Im Kontrast dazu berichten deutsche sexualmedizinische Ambulanzen seit den 70er-Jahren eine Verschiebung der Diagnosehäufigkeit weg von Orgasmusstörungen hin zur sogenannten Alibidimie – also zu sexueller Lustlosigkeit bei erhaltener Orgasmusfähigkeit – bei heterosexuellen Patienten. Betroffen sind etwa 60 % der weiblichen und bis zu 15 % der männlichen Patienten [2]. Auf Platz 1 der angegebenen Gründe für das Nachlassen der sexuellen Libido finden sich Monotonie, Langweile, Überdruss und Desinteresse in der sexuellen Beziehung mit dem gleichen Partner [3]. Dieser sexualmedizinische Exkurs macht deutlich, weshalb ein soziokulturelles Umfeld, in dem promiskuitive, vielgestaltige Sexualität nicht nur fantasiert wird, sondern real erlebbar ist – noch dazu in erheblicher räumlicher Distanz zu sozialen Kontrollinstanzen des Heimatlands wie Familie oder Freundeskreis – eine so erhebliche Anziehungskraft ausübt.
Ein Mehr an sexueller Freizügigkeit geht jedoch notwendigerweise auch mit einem erhöhten Übertragungsrisiko von STD einher. SING wies unlängst [4] zurecht darauf hin, dass zur Übertragung einer STD mindestens eine – serielle oder parallele – Dreierkonstellation erforderlich ist, da eine Person, um eine STD an einen Partner weitergeben zu können, diese erst von einem anderen erworben haben muss. Die größere heterosexuelle Freizügigkeit und Promiskuität im subsaharischen Afrika resultiert dort auch in einer größeren Bedeutung der Heterosexualität für die Epidemiologie von wenig infektiösen sexuell übertragbaren Erkrankungen wie HIV-Infektionen. Dies ist auch an der Geschlechtsverteilung ablesbar: Während in Europa etwa 30 % der HIV-Infizierten weiblich sind, handelt es sich im subsaharischen Afrika um mehr als 60 % [5].
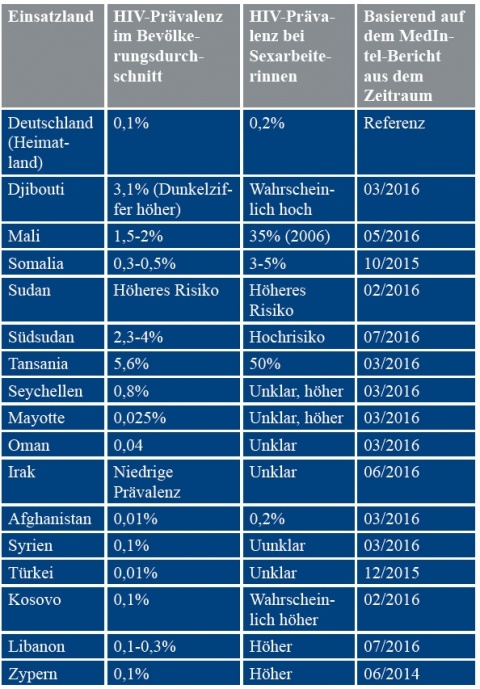
Professionelle Sexarbeit stellt im subsaharischen Afrika einen zusätzlichen Risikofaktor dar, so dass regionsabhängig, wie andernorts dargestellt [6], mit ein- bis zweistelligen prozentualen HIV-Prävalenzen gerechnet werden muss (zum Vergleich: 0,1 % in Deutschland). Die HIV-Prävalenz für Sexarbeiterinnen liegt dabei meist um ein Vielfaches höher als in der Normalbevölkerung. Der in Fall 1 geschilderte Kontakt mit zwei Sexarbeiterinnen ist daher, sofern tatsächlich ein ungeschützter Akt im trunkenen Zustand vollzogen werden konnte, als infektiologisch durchaus relevant einzustufen. Der Vollständigkeit halber sei erwähnt, dass sich der extreme Unterschied zwischen Durchschnittskollektiv und Sexarbeiterinnen in Deutschland nicht wiederfindet. Die KABP-Surv STI-Studie[1], die das Robert-Koch Institut (RKI) bei Sexarbeiterinnen in Deutschland in den Jahren 2010 – 2011 durchführte und deren Ergebnisse über die RKI-Homepage (www.rki.de) zugänglich sind, zeigte lediglich eine HIV-Prävalenz von 0,2 % bei Sexarbeiterinnen in Deutschland. Dies entspricht etwa dem Doppelten des Bundesdurchschnitts.
Angesichts der in Fall 1 demonstrierten hohen Hemmschwelle, nach sexuellen Risikokontakten ärztliche Hilfe in Anspruch zu nehmen, ist es wichtig, dass der Arzt als vertrauenswürdiger Ansprechpartner wahrgenommen wird, um bei realen oder vermeintlichen Risikosituationen umgehend kompetent beraten und ggf. notwendige medizinische Maßnahmen einleiten zu können.
HIV-Übertragungsrisiko durch sexuellen Kontakt
Das HIV-Übertragungsrisiko bei einmaligem sexuellen Kontakt zwischen serodiskordanten, sonst aber gesunden Partnern ist epidemiologischen Erfassungen [7] zufolge gering. Es finden sich geringfügige Unterschiede, die sexuelle Praktik betreffend (Tabelle 1).
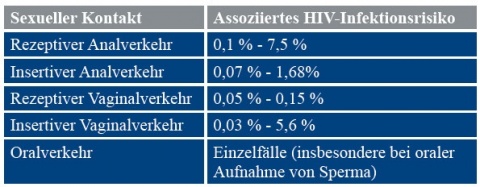
Selbst mit erhöhtem Risiko von Kontaktblutungen einhergehende, in Regionen Ostafrikas verbreitete Sexualpraktiken wie „dry sex“, wobei mit dem Ziel der Erhöhung der Friktion bei der Penetration die weibliche Scheide vor dem Verkehr mit Stoff oder Papier ausgetrocknet oder aber durch parallel eingeführte Objekte verengt und ausgetrocknet wird, erhöhen die HIV-Übertragungswahrscheinlichkeit nur gering bis moderat mit einer Odds ratio unter 1,5 [8].
Allerdings wird das HIV-Übertragungsrisiko durch zeitgleich vorhandene andere Geschlechtskrankheiten um den Faktor 2,5 bis 18 erhöht [7, 9], bei mäßig erhöhter HIV-Viruslast (> 2500 Kopien pro ml) um den Faktor 10 bis 30 und im Serokonversionsstadium, also bei frischer HIV-Infektion, sogar um den Faktor 10 bis 100 [7]. Die größte Übertragungswahrscheinlichkeit im Verlauf einer HIV-Infektion besteht, bedingt durch die dann sehr hohe Viruslast, im Serokonversionsstadium sowie in der Phase des Übergangs zum AIDS (erworbene Immunschwäche)-Stadium [10].
Prävention
Gemäß den oben geschilderten Überlegungen, dass STD-Übertragungen mindestens eine Dreierkonstellation voraussetzen, könnten Abstinenz oder Treue die sexuelle Ausbreitung effektiv unterbinden. Metaanalysen zu Studien sogenannter „Abstinence only“-Präventionsprogramme [11, 12] haben jedoch gezeigt, dass dieser Ansatz kontraproduktiv ist, weil er die Bedürfnisse der Menschen ignoriert und somit keine Adhärenz befördert. Im Gegenteil, in einer der Studien zum „Abstinence only“-Ansatz hatten sich die relativen Risiken für ungewollte Schwangerschaften auf 2,35 und für den Erwerb von STD auf 2,73 gegenüber dem Vergleichskollektiv mehr als verdoppelt. SING zitiert in seiner Arbeit [4] dazu das überaus treffende Bonmot des ehemaligen US Surgeon Generals Dr. Jocelyn Elders: „We know the vows of abstinence break far more easily than latex condoms“.
In der Tat haben Metaanalysen gezeigt, dass Kondome das per se schon geringe Risiko der HIV-Transmission um durchschnittlich weitere 80 % reduzieren, was – jenseits der Abstinenz und Treue – derzeit den besten Schutz darstellt, der angeboten werden kann [13]. Wie SING in seiner Übersicht darstellte, ist selbst bei beschädigtem Kondom noch eine Schutzwirkung gegen die Übertragung von STD zu erwarten: Im Vergleich zum Nichtgebrauch des Kondoms liegt das relative Risiko von STD-Übertragungen bei geplatztem Kondom bei 0,006, bei sichtbarem Leck bei 0,000 008 und bei unsichtbarem Leck bei lediglich 0,000 000 04 [4]. Dennoch sollten Kondome zur Sicherheit aus Deutschland importiert werden, wo eine kontrollierte Qualität sichergestellt ist, und wo diese gegenüber schädigenden Einflüssen, wie Reibung, Austrocknung und fetthaltigen Gleitcremes, nicht exponiert werden.
Wie die oben dargestellten Kasuistiken belegen, gibt es jedoch vielerlei Gründe, aus denen Kondome in der Praxis dennoch weggelassen werden. In solchen Fällen kann expositionsabhängig die medikamentöse HIV-PEP indiziert sein.
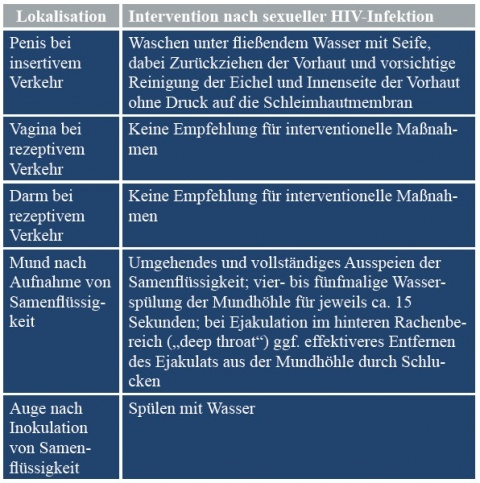
Neben der PEP sieht die deutsch-österreichische Leitlinie [14] Sofortmaßnahmen nach sexueller HIV-Exposition vor, die im Folgenden zusammengefasst sind (Tabelle 2).
Wenngleich das Ziel der Erregerlastreduktion, die durch solche Handlungsempfehlungen angestrebt wird, naheliegt, erscheint die Relevanz solcher Handlungsempfehlungen für die Praxis eher fraglich. Da beim konsensuellen ungeschützten Verkehr meist nicht von einer HIV-Infektion des Partners als unmittelbar wahrscheinlich ausgegangen wird, ist die Phase der Sorge um eine potenzielle HIV-Exposition – wie im Fall 1 dargestellt – erst nach Abklingen des dionysischen Rauschs zu erwarten. Dann ist es für Sofortmaßnahmen jedoch bereits sehr spät. In Fällen sexueller Gewalt dagegen ist zweifelhaft, ob das potenziell unter Schock stehende Gewaltopfer zu solch koordinierten Handlungen fähig ist. Falls entsprechende Interventionen geduldet werden, käme hier dem erstversorgenden medizinischen Personal ggf. eine unterstützende Funktion zu, wobei angesichts des forensischen Aspekts Überlegungen des Infektionsschutzes mit denen der Spurensicherung konkurrieren. Da für rezeptive Sexualpraktiken, die Opfer sexueller Gewalt typischerweise zu erdulden haben, sowieso keine evidenzgesicherten Sofortmaßnahmen bei zu erwartender HIV-Exposition zur Verfügung stehen, steht die im Folgenden geschilderten HIV-PEP im Vordergrund.
HIV-PEP-Indikationen nach sexueller Exposition
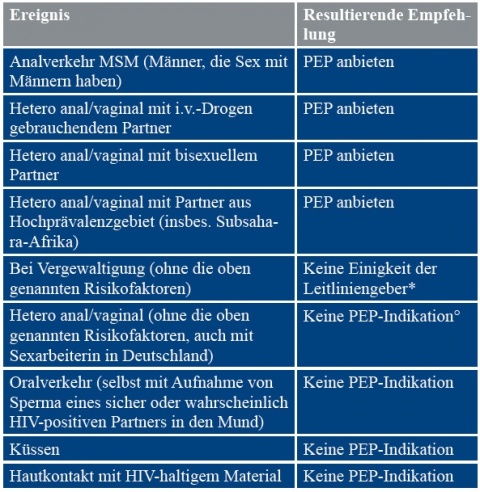
Die 2013 veröffentlichte, aktuelle deutsch-österreichische Leitlinie zur postexpositionellen Prophylaxe der HIV-Infektion [14] beschreibt eine differenzierte Indikationslage für die HIV-PEP nach sexueller Exposition. Bei bekanntem positivem HIV-Status eines Partners und ungeschütztem vaginalem oder analem Verkehr richtet sich die Empfehlungslage nach der Viruslast: Bei Viruslast > 1 000 Kopien/ml ist die PEP zu empfehlen und bei Viruslast von 50 - 1 000 Kopien/ml anzubieten, während eine erfolgreiche Virussuppression unter Behandlung mit Viruslast < 50 Kopien/ml keine PEP-Indikation darstellt.
Kenntnis des HIV-Status des Partners stellt bei sexuellen Gelegenheitskontakten jedoch eher die Ausnahme denn die Regel dar. Bei unklarem HIV-Status des Partners bei ungeschütztem Verkehr ist die Empfehlungslage ungleich komplexer. In Tabelle 3 sind die Indikationen für die PEP nach sexueller Exposition in Deutschland oder Österreich und bei unklarem HIV-Status des Partners zusammengefasst.
In den oben geschilderten Fällen begründete sich die PEP-Indikation mit dem vaginalen Verkehr mit Partnerinnen aus dem Hochprävalenzgebiet Subsahara-Afrika. Im Fall 1 kann jedoch mit Recht in Frage gestellt werden, ob der Zustand des offenbar stark alkoholisierten Soldaten überhaupt noch einen übertragungswirksamen Geschlechtsverkehr mit den beiden Sexarbeiterinnen zuließ. Hier wurde im Zweifel für die Patientensicherheit entschieden, da aufgrund der vermutlich alkoholbedingten Erinnerungslücke des Betroffenen ein Risikokontakt auch nicht ausgeschlossen werden konnte.
Im Fall des zweiten Betroffenen gelang, wenn auch mit sieben Tagen
Wie in den Fallstudien dargestellt, ist es wichtig, dass über die „off-label“-Applikation der Arzneimittel aufgeklärt und dies auch dokumentiert wird. Wenngleich die Indikation durch die seit 2013 gültigen Leitlinien [14] gesichert ist, sind die Substanzen dennoch formal für diese Indikation nicht zugelassen.
Basierend auf MEDINTEL-Auswertungen sind in Tabelle 4 die HIV-Prävalenzen in wichtigen Missions- und Einsatzgebieten der Bundeswehr dargestellt und liefern so einen groben Anhaltspunkt zur Abschätzung der lokalen Expositionsrisiken. Bedingt durch die meist lückenhafte und unzuverlässige Surveillance in Krisengebieten sind solche Daten jedoch nur als grobe Nährungswerte anzusehen.
HIV-PEP nach deutsch-österreichischer Leitlinie – wirklich anwendbar für die Tropen?
Basierend auf einer 20 Jahre alten Fall-Kontrollstudie zur HIV-PEP-Wirksamkeit, die seinerzeit noch Zidovudin (Retrovir®) gegen keine Medikamentenapplikation bei perkutaner Exposition verglich [15], wird die Wirksamkeit auf etwa 80 % geschätzt. Neuere placebokontrollierte Studien sucht man vergeblich, da ein solcher Studienansatz als ethisch nicht mehr vertretbar angesehen wird. Zur tatsächlichen Wirksamkeit neuer Substanzkombinationen zur HIV-PEP kann entsprechend keine evidenzbasierte Aussage getroffen werden. Auch die Konvention, die HIV-PEP-Applikation auf vier Wochen zu terminieren, ist letztlich eine Expertenmeinung. Aus diesem Grund sieht die Leitlinie für Fälle sehr massiver Exposition (z. B. Exposition durch Transfusion von infizierten Blutprodukten) oder später HIV-PEP-Initiierung (> 36 Stunden postexpositionell) die Option vor, den Applikationszeitraum an den Einzelfall angepasst zu verlängern [14].
Wie in Fall 2 dargelegt ist es richtig und wichtig, im Zweifel frühzeitig mit der PEP zu beginnen [16], da eine Wirksamkeit nur bei Initiierung innerhalb von 72 Stunden, besser noch innerhalb von 2 Stunden, zu erwarten ist [14]. Im letztgenannten Fall besteht die Chance, Wirkstoff noch vor Integration von HIV in die menschliche Zelle, die in Zellkultur zwischen 30 Minuten und wenigen Stunden in Anspruch nimmt [17], an den Wirkort zu bekommen.
Notwendige Voraussetzung für die PEP-Wirksamkeit ist ferner der Einsatz von Substanzen, gegen die das potenziell übertragene Virus keine Resistenzen aufweist. Während in Europa unter Bedingungen viruslastkontrollierter antiretroviraler Therapie (ART) resistente Viren bei Neuinfektionen vergleichsweise selten sind [18], ist dies im subsaharischen Afrika, wo die ART vielfach ohne regelmäßige Viruslastkontrolle und somit „blind“ ausgebracht wird, keineswegs anzunehmen. Eine aktuelle Studie aus dem westafrikanischen Togo [19] zeigte exemplarisch, dass nach lediglich vierjähriger „blinder“ ART 88 % der HIV--Patienten eine Zweiklassenresistenz gegen nukleosidische/nukleotidische Reverse-Transkriptase-Inhibitoren (NRTI) und nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) aufwiesen. Hier ist anzumerken, dass die Standard-PEP der Bundeswehr in Auslandseinsätzen bis zur Leitlinienänderung 2013 aus den beiden NRTI Zidovudin und Lamivudin (Combivir®) sowie dem NNTRI Efavirenz (Sustiva®) bestand, so dass hier ein hohes Versagensrisiko zu befürchten gewesen wäre. Eine Anregung für zukünftige Einsätze wäre die Eruierung der lokalen HIV-Resistenzlage durch die MEDINTEL-Fähigkeit des Sanitätsdienstes der Bundeswehr und eine resistenzangepasste Empfehlung zur einsatzspezifischen Zusammensetzung der HIV-PEP, ggf. ergänzt durch aktive Surveillance, basierend auf Resistenztestung in lokal akquirierten Proben, falls keine belastbaren Daten verfügbar sind.
Die von der deutsch-österreichischen Leitlinie [14] als Standard-PEP für Deutschland und Österreich empfohlene Kombination aus den beiden besser verträglichen NRTI Tenofovir/Emtiricitabin (Truvada®) und dem Integrasehemmer Raltegravir (Isentress®) wurde primär aufgrund der guten Verträglichkeit [20] ausgewählt. Da insbesondere der noch vergleichsweise neue und entsprechend kostspielige Integrasehemmer Raltegravir in „blinden“ ART-Schemata im subsaharischen Afrika keine bedeutsame Rolle spielt, ist hier eine noch bestehende Wirksamkeit der die Viruslast schnell senkenden Integrasehemmer wahrscheinlich. Nichtsdestotrotz bleibt in Anbetracht der Konsequenzen einer HIV-Infektion und hoher erwarteter Raten virologischer Resistenz im subsaharischen Afrika [19, 21, 22] eine auf reinen Mutmaßungen basierende Wirksamkeitsabschätzung unbefriedigend. Für Situationen bekannter oder erwarteter Resistenz sieht auch die Leitlinie [14] die Option des Abweichens von der Standard-PEP vor. Eine solche Option sollte nach Möglichkeit mit infektiologisch versierten Experten diskutiert werden.
Verträglichkeit der Standard-PEP und einsatzbedingte Arzneimittelinteraktionsrisiken
Die aktuelle Standard-PEP Truvada®/Isentress® zeichnet sich durch eine studienbelegte gute Verträglichkeit [20] aus, die auch ein wesentlicher Grund für die in den geschilderten Fällen getroffene Entscheidung zur PEP-Applikation im Einsatz war. Die in der erwähnten Studie geschilderten Nebenwirkungen waren generell mild und selbstlimitierend, nebenwirkungsbedingte PEP-Abbrüche wurden nicht beobachtet. Im Detail beschränkten sich die beobachteten Nebenwirkungen auf Symptomkonstellationen, die im Vergleich zu den Konsequenzen einer HIV-Infektionen eher als Befindlichkeitsstörungen einzustufen sind, wie Übelkeit und Erbrechen (27 %), Durchfall (21 %), Kopfschmerz (15 %), Abgeschlagenheit (14 %), gastrointestinale Symptome (Schmerzen, Blähung, Flatulenz) (16 %) sowie Myalgien und Arthralgien (8 %). Schwerwiegende Truvada®-Nebenwirkungen, die auch zur Umstellung führen sollten, wie CK-Erhöhungen, Nephrotoxizität und Pankreatitis [14], sind selten und bei kurzfristigen Einnahmen im Rahmen einer PEP kaum zu erwarten. Die Raltegravir-assoziierte Hepatoxizität ist meist kontrollierbar [14].
Bei tropischen Einsätzen mit Notwendigkeit einer Malaria-Prophylaxe grundsätzlich zu beachten ist die potenzielle Interaktion mit den zur Prophylaxe eingesetzten Malaria-Medikamenten (Tabelle 5).
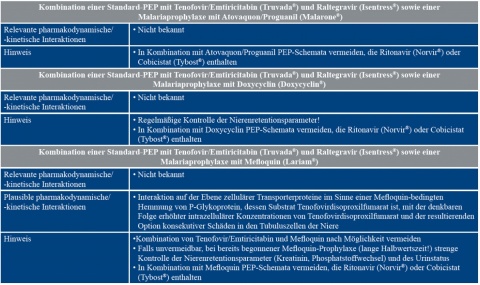
Die in der Tabelle 5 empfohlenen Kontrolluntersuchungen lassen sich auch mit den eingeschränkten diagnostischen Optionen in Role-2-Sanitätseinrichtungen problemlos umsetzen, wie auch in Fall 1 dargestellt. In Fall 2 wurden keine Folgeuntersuchungen nötig, da die PEP bereits nach wenigen Tagen bei mit großer Wahrscheinlichkeit nichtbestehender HIV-Infektion der Sexualpartnerin abgesetzt werden konnte. In den geschilderten Fällen erfolgte die Malariaprophylaxe mit Doxycyclin, was die Kontrolle unter PEP vergleichsweise einfach macht. Sollten Betroffene dagegen das mit einem höheren Interaktionsrisiko behaftete Mefloquin zur Malariaprophylaxe nutzen, kann eine Umstellung erwogen werden, wobei jedoch die langsame Eliminationskinetik mit assoziiert langer Halbwertszeit von Mefloquin im Körper zu beachten ist.

Die Empfehlung zur Vermeidung von Boostern, wie Ritonavir und Cobicistat, in Kombination mit allen Medikamenten der Malariaprophylaxe wird relevant, wenn bei bekannter oder vermuteter Resistenz auf die mit einer hohen Resistenzbarriere assoziierten geboosterten Proteasehemmer zurückgegriffen werden soll. Ein Beispiel wäre Ritonavir-geboostertes Lopinavir (Kaletra®), das von der Leitlinie [14] als Ersatz für das die Plazentaschranke durchdringende Isentress vorgesehen ist. Da Schwangere zum Schutz des ungeborenen Lebens jedoch per se aus dem Einsatz repatriiert werden, ist dies ein für Militäreinsätze meist weniger relevantes Problem. Tabelle 6 gibt einen Überblick über die Substanzen, die zur Anwendung in der HIV-PEP eine Rolle spielen oder spielten.
Nicht eingegangen werden kann hier auf Interaktionen mit weiterer Begleit- oder „Life style“-Medikation, die im Einzelfall ggf. zu beachten sind. Zu nennen wären hier beispielsweise muskelaufbauende Substanzen, deren Einnahme von dem Soldaten im Fall 1 trotz der geschilderten „Bodybuilder-Figur“ verneint wurde. Sofern möglich, sollte eine solche Begleitmedikation pausiert bzw. abgesetzt werden, wobei dem Betroffenen die übergeordnete Bedeutung der Wirksamkeit der antiretroviralen Medikation in der Nutzen-Risiko-Abwägung auseinanderzusetzen ist.
Ein Blick in die Glaskugel – PrEP und Malariaprophylaxe?
In jüngster Zeit wird verstärkt die Option der sogenannten Präexpositionsprophylaxe (PrEP) als kosteneffiziente Präventionsmöglichkeit für Personen mit riskantem Sexualverhalten diskutiert, für die eine Kondombenutzung aus „life-style“-Erwägungen keine Option darstellt. In der kürzlich publizierten -IPERGAY[2]-Studie zur „PrEP on demand“ konnte eine sowohl signifikante als auch quantitativ relevante Reduktion des sexuellen HIV-Transmissionsrisikos demonstriert werden [23]. Zum Einsatz kommt dabei Truvada®, das – wie andernorts ausführlich dargestellt [24] – in hohen Konzentrationen in Genitalsekreten angereichert wird. Als PrEP-on-demand werden 2 Tabletten Truvada® 2 - 24 Stunden vor dem erwarteten sexuellen Risikokontakt mit einer Mahlzeit aufgenommen, eine weitere Tablette 24 Stunden nach dieser initialen „loading dose“ und eine vierte Tablette weitere 24 Stunden später. Mit vier Tabletten Truvada®, was einem finanziellen Gegenwert von etwas mehr als 100,- Euro entspricht, der mit dem kurz bevorstehenden Ablauf des Patents drastisch fallen dürfte, kann somit ein nicht absolut sicherer, aber dennoch erheblicher Schutz vor der HIV-Übertragung erreicht werden. Die im Rahmen der IPERGAY-Studie beobachteten wenigen Durchbruchinfektionen waren meist mit insuffizienten Medikamentenspiegeln, also mangelnder Compliance, und nur in Ausnahmefällen mit echtem virologischen Versagen assoziiert [23].
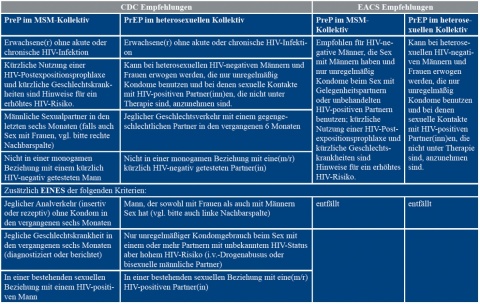
Wenngleich die PrEP in den Leitlinien von CDC[3] und EACS[4] bereits für Risikokollektive (Tabelle 7) empfohlen wird, ist eine Kostenübernahme durch die Krankenkassen bisher nicht gewährleistet, so dass diese Option vorerst ein „Luxus“ für den wirtschaftlich bessergestellten Libertin bleibt. Eine Evaluation für die deutschen Leitlinien ist aufgrund der nachgewiesenen Kosteneffizienz für Risikogruppen [25] als Prophylaxemaßnahme jedoch zu erwarten und könnte sich in naher Zukunft auch auf Finanzierungsentscheidungen der Krankenkassen auswirken. Sollten sich die Kassen für eine Bezahlung der PrEP auf Basis begründeter Einzelfälle entscheiden, wird auch der Sanitätsdienst zu dieser Frage Position beziehen müssen. Auch unabhängig von der der Hürde „Kostenübernahme durch die gesetzlichen Krankenkassen“ könnte bzw. sollte sich der Sanitätsdienst zum Thema HIV-PrEP positionieren. Ein Kombinierbarkeit einer Truvada®-basierten PrEP mit der derzeit üblichen Malariaprophylaxe wäre grundsätzlich gegeben.
Soziale und ethische Implikationen
Wie im Fall 1 dargestellt, hat eine HIV-PEP-bedingte Repatriierung für den Betroffenen potenziell Konsequenzen, die über dienstrechtliche Aspekte deutlich hinausgehen können. So artikulierte der betroffene Soldat erhebliche Ängste um den Erhalt seiner Familie, sollte seine Gattin von den Umständen einer solcherart verfrühten Rückkehr aus dem Einsatz erfahren. Ähnlich wie STD-Präventionsprogramme trotz gegensätzlicher Evidenz [11 - 12] vielfach nicht zur Kenntnis nehmen, dass Abstinenzkonzepte nicht der menschlichen Lebensrealität entsprechen, gilt dies analog für konservative Ehe- und Beziehungsmodelle unserer Gesellschaft. Die aufgrund solcher Konventionen erzwungene Tabuisierung ihrer Bedürfnisse lässt Betroffenen dann nur die Option der Lüge. Alternative, offene Beziehungsmodelle, wie das vom deutschen Sexualaufklärer OSWALD KOLLE vorgestellte Konzept der „sozialen Treue“ im Kontrast zur „sexuellen Treue“ („Leben 2034: Die Zukunft der Sexualität“, Körber-Forum Hamburg, 25.03.2009) sind bisher auf wenig gesellschaftliche Akzeptanz gestoßen, wenngleich sie gerade für Menschen mit häufigen Auswärtstätigkeiten die Lebensrealität treffender abbilden dürften.
Als Beispiel für gelebte Kameradschaft und Menschlichkeit lobend hervorzuheben ist das Engagement der Paramedic im Fall 1, die den Betroffenen fast gegen seinen Willen zur postexpositionellen Versorgung truppenärztlich vorstellte. Dies ist keinesfalls selbstverständlich. Denn wenngleich konsensuelle Sexualität zwischen zwei oder mehr einwilligungsfähigen Erwachsenen innerhalb der rechtlichen Rahmenbedingungen grundsätzlich deren Privatangelegenheit ist, ist dennoch bei Nichtbeteiligten mit negativen Gefühlen, wie Eifersucht und Neid, zu rechnen. Das Problem der individuell unterschiedlichen Teilhabe an sexueller Interaktion mit dem, im negativen Fall, assoziierten Gefühl des Zurückgewiesenseins und Versagens wurde von dem französischen Skandalschriftsteller Michel Houellebecq in seinem Werk „Ausweitung der Kampfzone“ satirisch pointiert.
Ärztliche Ethik sollte sich jedoch die vier Grundsätze „Patientenautonomie“, „Benefizienz“, „Non-Malefizienz“ und „Gerechtigkeit“ zur Richtschnur wählen [26]. Entsprechend darf die Repatriierung als Personalmaßnahme niemals zugleich quasi im Sinne einer „Disziplinierung“ gebraucht werden. Diesem Grundsatz folgend wurde in den geschilderten Fällen nach Möglichkeiten gesucht, den Betroffenen eine zweckmäßige Versorgung im Einsatz angedeihen zu lassen.
Schlussendlich sollte nicht außer Acht gelassen werden, dass sich die Bundeswehr von einer Armee der Landesverteidigung in eine Einsatzarmee transformiert. Dies bedeutet, dass der – teils längerfristige – Auslandseinsatz für Soldaten auch perspektivisch eher die Regel als die Ausnahme darstellen wird. Vom Soldaten wird dabei einerseits abgefordert, einen mehr als unwesentlichen Anteil seines Lebens unter Einsatzbedingungen mit Gefährdung von Leib und Leben zu verbringen. Dabei erscheint es inkonsequent und noch dazu im Widerspruch zu früheren epidemiologischen Daten [11, 12], zu erwarten, dass er diese relevanten Anteile seines Lebens in Abstinenz zubringen und dabei – in zuversichtlicher Hoffnung auf ein unsicheres Irgendwann – auf Sexualität als wesentliches glück- und sinnstiftendes Element des menschlichen Lebens verzichten wird.
Eine medizinische Evidenz für eine Diskriminierung zwischen einer „gesunden monogamen“ und einer „ungesunden promiskuitiven“ Sexualität gibt es nicht, sofern sexuell übertragbare Erkrankungen mit teils chronischen Verläufen und unerwünschte Schwangerschaften mit ihren psychosozialen Implikationen durch geeignete Präventivmaßnahmen verhindert oder in ihrer Konsequenz abgemildert werden. Eine solch wertende Diskriminierung aufgrund von sexueller Orientierung verbietet sich zudem nach dem Gleichbehandlungsgesetz, mit dem seit 1.07.2004 das EU-Recht im Sinne einer Umsetzung der Antidiskriminierungsrichtlichinien der EU angepasst wurde.
Es ist der Freiheit und Eigenverantwortlichkeit des Individuums anheimgestellt, wie es innerhalb der gesetzlichen Rahmenbedingungen – auch im Einsatz – seine sexuellen Bedürfnisse auslebt. Für die Medizin ergibt sich nach den oben genannten Grundsätzen „Patientenautonomie“ und „Benefizienz“ dabei eine wertneutral beratende Position. Der aus der hippokratischen Tradition erwachsende Grundsatz „Primum nihil nocere“ (erstens nicht schaden) kann hier als Richtschnur dienen, um in der Beratung eine Balance zu finden, die einerseits sowohl auf die individuellen Bedürfnisse des Betroffenen eingeht und seine Freiheiten respektiert, als auch dem Betroffenen – von der Position des überlegenen professionellen Wissens – damit verbundene Risiken aufzeigt und auf individueller Basis nach gangbar erscheinenden Wegen sucht, solche Risiken nach Möglichkeit zu minimieren. Entsprechende ärztliche Sachkenntnis ist dafür eine wichtige Voraussetzung.
Ferner ist und bleibt es unzweifelhaft und vorrangig die Aufgabe des Sanitätspersonals, die Einsatzfähigkeit der Soldaten sicherzustellen, d. h. zu stärken (Prävention; auch anlassbezogene, bedürfnisentsprechende Beratung), zu erhalten (dies könnte u. a. auch die Einführung und Anwendung der PrEP bedeuten) und/oder wiederherzustellen (dies bedeutet die Anwendung der PEP nach aktuellem Standard). Die Umsetzung dieses Auftrages entspricht nicht nur den Grundsätzen der ärztlichen Ethik, sondern auch dem Fürsorgeverständnis des Dienstherrn, zur Erfüllung des Auftrages alles für die Gesunderhaltung der eingesetzten Soldaten zu tun.
Schlussfolgerungen
Zusammenfassend kann festgehalten werden, dass die aktuell in den Einsätzen zur Verfügung stehende HIV-Standard-PEP sich durch gute Verträglichkeit auszeichnet [20] und zudem – mit überschaubaren Laborkontrollen – mit den im Einsatz üblichen Arzneimitteln der Malariaprophylaxe kombinierbar ist. Die etwas schlechtere Kombinierbarkeit mit dem derzeit vom deutschen Markt verschwindenden Mefloquin (Lariam®) bestätigt die derzeitige Praxis, diese Substanz nicht mehr als Mittel der ersten Wahl für die Malariaprophylaxe einzusetzen. Eine über die Malariaprophylaxe hinausgehende Co-Medikation ist parallel zur HIV-PEP jedoch – nach Möglichkeit – zu vermeiden, da die Arzneimittelinteraktionen bei Polypharmazie zunehmend unüberschaubar werden. Die Applikation der HIV-PEP auch im Einsatz ist also grundsätzlich möglich, wie es von NATO-Partnern bereits praktiziert wird (Tabelle 8), setzt aber selbstverständlich das Einverständnis des Betroffenen in ein solches Vorgehen voraus. Ferner ist das handlungssichere Erkennen der Notwendigkeit der PEP-Applikation, also die korrekte ärztliche Indikationsstellung, eine Grundvoraussetzung.
Die Bereitstellung von MEDINTEL-Informationen zur HIV-Resistenzlage in Einsatzgebieten, auf deren Basis die HIV-PEP-Kombination resistenzadaptiert kalkuliert angepasst werden kann, ist perspektivisch wünschenswert.

Darüber hinaus ist es den Autoren ein Anliegen, ein ärztliches Selbstbild zu propagieren, das den Arzt als vertrauenswürdigen und niederschwellig erreichbaren Berater auch in eventuell mit Scham und Peinlichkeit verbundenen Lebenslagen definiert und ihn den ihm Anvertrauten vorrangig mit Rat und Hilfe, erforderlichenfalls aber auch mit mahnend erhobenem Zeigefinger zur Seite stehen lässt. So kann insbesondere sichergestellt werden, dass – beispielsweise bei Bedarf einer HIV-PEP [14] – ggf. zeitkritische medizinische Maßnahmen umgehend eingeleitet werden können.
Neben der fachlichen Kompetenz und Handlungssicherheit des Behandlers erfordert eine Gesprächssituation, die für den Betroffenen potenziell mit Scham- und Schuldgefühlen sowie Angst vor moralischer oder gar realer Sanktionierung verbunden ist, ein hohes Maß an Empathie. Nur so kann der Betroffene umfassend und zielführend ärztlich geleitet werden. Hier besteht insbesondere in der medizinischen Ausbildung Verbesserungsbedarf, dem von den Fachgesellschaften bisher nur zögerlich (z. B. durch den Workshop: „Let’s talk about sex (für Medizinstudierende)“ auf dem 13. Kongress für Infektionskrankheiten und Tropenmedizin (KIT, 2016 in Würzburg)) Rechnung getragen wird. Eine entsprechende Befähigung auf der Klaviatur emotionaler Grau- und Zwischentöne wäre auch für medizinisches Personal in Auslandseinsätzen hochgradig wünschenswert. Dies gilt umso mehr, da im Einsatzkontext der Grundsatz der freien Arztwahl per se nicht gewährleistet werden kann.
Kernaussagen
- Ungeschützte sexuelle Kontakte im tropischen, subsaharischen Afrika sind mit einem erhöhten Risiko der Infektion mit Erregern sexuell übertragbarer Erkrankungen (STD) einschließlich des humanen Immundefizienzvirus (HIV) assoziiert.
- Im Falle infektionsrelevanter heterosexueller Kontakte (vaginaler oder analer Verkehr) mit Partnern mit unklarem HIV-Status aus tropischen HIV-Hochendemiegebieten ist die HIV-PEP (Postexpositionsprophylaxe) anzubieten, bei ebensolchen MSM (Männer, die Sex mit Männern haben)-Kontakten zu empfehlen.
- Die Standard-HIV-PEP, bestehend aus Tenofovir/Emtricitabin (Truvada®) und Raltegravir (Isentress®), zeichnet sich durch akzeptable Verträglichkeit aus und ist mit den in tropischen Bundeswehreinsätzen eingesetzten Medikamenten zur Malariaprophylaxe mit vertretbarem Überwachungsaufwand kombinierbar.
- Nach sorgfältiger Aufklärung über die „off-label“-Applikation und unter der Voraussetzung der diagnostischen Möglichkeiten einer Role-2-Sanitätseinrichtung für die Verlaufskontrolle, ist die HIV-PEP-Applikation auch unter tropischen Einsatzbedingungen und ohne obligate Einleitung einer Repatriierung medizinisch vertretbar.
- Die Bereitstellung von Surveillancedaten zur HIV-Resistenzlage in den Einsatzgebieten durch MEDINTEL und bei Fehlen verlässlicher Daten ggf. auch ihre laborgestützte Generierung bereits im Rahmen der Einsatz-/Missionsplanung wären wünschenswert, um die einzusetzende HIV-PEP basierend auf den Resistenzdaten einsatzadaptiert anpassen zu können.
Danksagung
Die Autoren danken Herrn Priv.-Doz. Dr. Nils von Hentig (Sachsenhäuser Praxis für Allgemeinmedizin Kiana Darab-Kaboly/Nils von Hentig) für die Recherche der zu erwartenden Interaktionsmuster zwischen der HIV-PEP, basierend auf Tenofovir/Emtricitabin und Raltegravir, mit den zur Malariaprophylaxe eingesetzten Substanzen Atovaquon/Proguanil, Doxycyclin und Mefloquin.
Interessenkonflikt
Die Autoren erklären, dass kein Interessenkonflikt im Sinne der Richtlinien des International Committee of Medical Journal Editors besteht.
Literatur
1. Hawkes S, Hart GJ, Bletsoe E, Shergold C, Johnson AM: Risk behaviour and STD acquisition in genitourinary clinic attenders who have travelled. Genitourin Med 1995; 71: 351 - 354.
2. Hauch M: Lust auf Dissens. Heterosexualität in der De/Re/Konstruktion. In: Dannecker M, Reiche R (Hg.). Sexualität und Gesellschaft. Festschrift für Volkmar Sigusch. Campus Verlag GmbH Frankfurt/Main 2000; 217 - 218.
3. Bräutigam W: Sexualmedizin im Grundriß. Ein Einführung in Klinik, Theorie und Therapie der sexuellen Konflikte und Störungen. Georg Thieme Verlag Stuttgart 1977; 214.
4. Sing A: Zur Epidemiologie von sexuell übertragbaren Erkrankungen: der Beitrag der Sozialen Netzwerk-Analyse zu einem komplexen Feld. Mikrobiologe 2011; 21: 150 - 159.
5. Piot P, Carael M: Global Perspectives on Human Immunodeficiency Virus Infection and Acquired Immunodeficiency Syndrome. In: Mandell GL, Bennett JE, Dolin R. Principles and Practice of Infectious Diseases. Seventh edition. Churchill Livingstone Elsevier Philadelphia 2010; 1620.
6. Frickmann H, Sturm D, Finke EJ: Infektionsrisiken durch Fremdgewebseinsprengung und sexuelle Gewalt im asymmetrischen Konflikt. Wehrmed Mschr 2014; 58: 2 - 9.
7. Arastéh K, Arendt G, Bader A et al.: Postexpositionelle Prophylaxe der HIV-Infektion. Deutsch-Österreichische Empfehlungen. Aktualisierung 2007; 4 - 42.
8. Low N, Chersich MF, Schmidlin K at al.: Intravaginal practices, bacterial vaginosis, and HIV infection in women: individual participant data meta-analysis. PLoS Med 2011; 8: e1000416.
9. Kissinger P, Adamski A: Trichomoniasis and HIV interactions: a review. Sex Transm Infect 2013; 89: 426 - 33.
10. Wawer MJ, Gray RH, Sewankambo NK, Serwadda D, et al.: Rates of HIV-1 transmission per coital act, by stage of HIV-1 infection, in Rakai, Uganda. J Infect Dis 2005; 191: 1403 - 1409.
11. Underhill K, Montgomery P, Operario D: Sexual abstinence only programmes to prevent HIV infection in high income countries: systematic review. BMJ 2007; 335: 248.
12. Underhill K, Operario D, Montgomery P: Abstinence-only programs for HIV infection prevention in high-income countries (Review). Cochrane Database Syst Rev 2007; 4: CD005421.
13. Weller S, Davis K: Condom effectiveness in reducing heterosexual HIV transmission. Cochrane Database Syst Rev 2001; 3: CD003255.
14. Audebert F, Behrens G, Bogner J, et al.: Deutsch-Österreichische Leitlinien zur postexpositionellen Prophylaxe der HIV-Infektion. 2013; 2 - 26-
15. Cardo DM, Culver DH, Ciesielski CA, et al.: A case-control study of HIV seroconversion in health care workers after percutaneous exposure. Centers for Disease Control and Prevention Needlestick Surveillance Group. N Engl J Med 1997; 337: 1485 - 1490.
16. Schmiedel S, Hertling S, Degen O, et al.: Postexpositionsprophylaxe bei Gewaltopfern – Das „Hamburger Modell“ als Beispiel für eine interdisziplinäre Verzahnung zur Betreuung von Gewaltopfern. Hamburger Ärzteblatt 2009; 1: 35 - 36.
17. Srivastava KK, Fernandez-Larsson R, Zinkus DM, Robinson HL: Human immunodeficiency virus type 1 NL4-3 replication in four T-cell lines: rate and efficiency of entry, a major determinant of permissiveness. J Virol 1991; 65: 3900 - 3902.
18. Hofstra LM, Sauvageot N, Albert J, et al.: SPREAD Program. Transmission of HIV Drug Resistance and the Predicted Effect on Current First-line Regimens in Europe. Clin Infect Dis 2016; 62: 655 - 663.
19. Salou M, Dagnra AY, Butel C, et al.: High rates of virological failure and drug resistance in perinatally HIV-1-infected children and adolescents receiving lifelong antiretroviral therapy in routine clinics in Togo. JIAS 2016; 19: 20683.
20. Mayer KH, Mimiaga MJ, Gelman M, Grasso C: Raltegravir, tenofovir DF, and emtricitabine for postexposure prophylaxis to prevent the sexual transmission of HIV: safety, tolerability, and adherence. J Acquir Immune Defic Syndr 2012; 59: 354 - 359.
21. The TenoRes Study Group. Global epidemiology of drug resistance after failure of WHO recommended first-line regimens for adult HIV-1 infection: a multicentre retrospective cohort study. Lancet Infect Dis 2016; 16: 565 - 575.
22. Kasang C, Kalluvya S, Majinge C, et al. HIV drug resistance (HIVDR) in antiretroviral therapy-naïve patients in Tanzania not eligible for WHO threshold HIVDR survey is dramatically high. PLoS One 2011; 6: e23091.
23. Molina JM, Capitant C, Spire B, et al.: ANRS IPERGAY Study Group. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med 2015; 373: 2237 - 2246.
24. Frickmann H, Picolin KH, Wiemer D, Potinius M, Hagen RM: Prä-Expositionsprophylaxe (PrEP) gegen HIV – aktueller Forschungsstand und mögliche Relevanz für den Einsatz. Wehrmed Mschr 2012; 56: 15 - 20.
25. Ouellet E, Durand M, Guertin JR, LeLorier J, Tremblay CL: Cost effectiveness of ‘on demand’ HIV pre-exposure prophylaxis for non-injection drug-using men who have sex with men in Canada. Can J Infect Dis Med Microbiol 2015; 26: 23 - 29.
26. Vollmuth R. Beware of the “Slippery Slope”. Healthcare Professionals between Medical Ethics and Military Duties. Medical Corps International Forum 2016; 2016: 2: 35 - 37.
Manuskriptdaten:
Eingereicht: 27.07.2016
Revidierte Fassung angenommen: 05.09.2016
Zitierweise:
Maaßen W, Gottwald C, Frickmann F: „Wie sag ich’s meinem Kinde?“ – Fallbeispiele gut vertragener HIV-Postexpositionsprophylaxen im tropischen Einsatzgebiet. Wehrmedizinische Monatsschrift 2016; 60(12): 366 - 375.
Citation:
Maassen W, Gottwald C, Frickmann F: „How do I put it?“ - case reports on well tolerated HIV post-exposure prophylaxis on deployment in the tropics. Wehrmedizinische Monatsschrift 2016; 60(12): 366 - 375.
Für die Verfasser:
Oberfeldarzt Priv.-Doz. Dr. Hagen Frickmann
Fachbereich Tropenmedizin am Bernhard-Nocht-Institut, Bundeswehrkrankenhaus Hamburg
Bernhard-Nocht-Straße 74, 20359 HAMBURG
E-Mail: [email protected]
Eine englische Version des Textes finden Sie hier.
An english version of this article you will find here.
Datum: 24.01.2017
Quelle: Wehrmedizinische Monatsschrift 2016/12