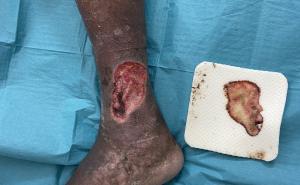
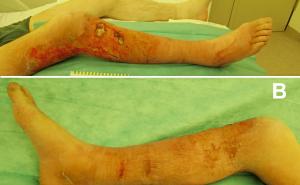
Hyaluronsäure-Wirkstoffkombinationen:
Die Allzweck-Waffen in der lokalen Wundbehandlung
Dr. C. von Schroeder
Das medizinische Anwendungsspektrum von Hyaluronsäure (auch: Sodium Hyaluronate, Hyaluronan) ist inzwischen sehr breit. Sie wird wird in den meisten Fällen zur Heilungsbeschleunigung verwendet und ist aus dem gegenwärtigen Wirkstoff-Repertoire der Mediziner nicht mehr wegzudenken. Neben der lokalen Wundversorgung wird Hyaluronsäure vor allem noch in der Orthopädie, der Augenheilkunde und der ästhetischen Medizin sehr erfolgreich eingesetzt. In Arzneimitteln fungiert sie zumeist als Trägermedium für andere Wirkstoffe.
Besonders der topische Einsatz von hyaluronsäurehaltigen Produkten erweist sich bei komplexen, akuten und chronischen Wunden als sehr wirkungsvoll, da diese positiv steuernd in die komplexen Heilungsprozesse eingreifen können.
Denn eine der wichtigen Eigenschaften von Hyaluronsäure besteht darin, eine große Anzahl von Wassermolekülen zu binden und dadurch die Feuchtigkeitsversorgung der Haut und des Bindegewebes sicherzustellen. Eine wichtige Funktion erfüllt die Anwesenheit von Hyaluronsäure zudem bei der Zelldifferenzierung, -proliferation und -migration während der gesamten Geweberegeneration und Gewebeentwicklung.
Inzwischen ist die Evidenzlage sehr eindeutig: In einer kürzlich veröffentlichten, prospektiven, multizentrischen, randomisierten, kontrollierten, doppelt verblindeten Studie mit 168 Patienten konnten bei Ulcus Cruris signifikant bessere Abheilungsraten bei den mit Hyaluronsäure behandelten Patienten im Vergleich zur Kontrollgruppe konstatiert werden [1]. Diversen weiteren Studien zufolge reduziert Hyaluronsäure den Biofilm [2], hat einen beschleunigenden, positiven Effekt auf die Wundheilung sowie das Potential Schmerzen zu reduzieren [3] und die Narbenbildung [4] zu optimieren. Sie sorgt insgesamt für höhere Abheilungsraten und deutlich kürzere Heildauern. Wissenschaftlich belegbar konnte Hyaluronsäure bei den nachfolgenden Indikationen sehr gute klinische Resultate erzielen:
- Postoperative Wunden [5]
- Militärischen Schuss- und Shrapnell-Wunden [6]
- Hautgeschwüre [7]
- Dekubitalulcera [8]
- Diabetisches Fußsyndrom (DFS) [9]
- Unterdruck-Wundtherapie [10]
- Entzündliche Tattoo-Wunden [11]
- Komplizierte Vernarbungswunden [12]
- Entnahmestelle bei Spalthauttransplantationen [13]
- Verbrennungswunden [14].
Weiterhin eignet sie sich ideal zur Wundtherapie nach Resektionen bzw. Amputationen oder bei postoperativen Nahtinsuffizienzen. Da es sich bei Hyaluronsäure um eine natürlichen, körpereigenen Bestandteil handelt, sind bei oraler, topischer und injizierender Applikation bisher keine signifikanten, unerwünschten Nebenwirkungen oder Gegenreaktionen festgehalten worden.
Die am Markt verfügbaren hyaluronsäurehaltigen Produkte sind für die Anwender in unterschiedlichen Darreichungsformen wie Granulat, Creme, Membran, Spray, Wundauflagen bzw. viskoses Fluid erhältlich. Klassisch wurde natives Hyaluron früher aus tierischem Gewebe extrahiert; inzwischen wird es nur noch durch mikrobielle Fermentation hergestellt. Die damit verbundene Vereinfachung der Herstellung sowie die Verfügbarkeit in größeren Mengen sind ursächlich dafür, dass moderne Wundversorgungsprodukte mit hochkonzentrierter Hyaluronsäure zu einem akzeptablen Preisleistungsverhältnis angeboten, zunehmend häufiger nachgefragt und – auch bei großflächigen Wunden – viel öfter eingesetzt werden können. Für den Arzt ist der Preis ein nicht unerheblicher Aspekt in Hinblick auf kostenbewusste Verordnungen bzw. die Einhaltung des Wirtschaftlichkeitsgebots.
Für einen universellen, wundphasenübergreifenden Einsatz eignen sich vor allem Produkte der neuesten Generation, die neben der Hyaluronsäure über einen zusätzlichen, synergetischen Wirkkomplex verfügen. Ein additives Antiseptikum (z.B. Octenidin, Jod) gestattet bei diesen Wirkstoffkombinationen einen vielseitigen, deutlich frühen sowie wundphasenübergreifenden Einsatz, selbst bei noch infizierten Wunden. Neben den bereits genannten Vorteilen machen am Ende auch die sehr einfache Handhabung und die wenigen, notwendigen Wechselintervalle sie zu sehr effektiven und effizienten Medizinprodukten, so dass diese - bei adäquater Indikation - zurecht als sogenannte Allzweckwaffe in der lokalen Wundbehandlung bezeichnet werden können.
Literaturverzeichnis
1 Mikosinski J. et al. (2021): Efficacy and Safety of a Hyaluronic Acid-Containing Gauze Pad in the Treatment of Chronic Venous or Mixed-Origin Leg Ulcers: A Prospective, Multicenter, Randomized Controlled Trial. Wounds. 2021 Jun;33(6):147-157 Abstract
2 Romanò C. L. et al. (2017): Hyaluronic Acid and Its Composites as a Local Antimicrobial/Antiadhesive Barrier. J Bone Jt Infect. 2017 Jan 1;2(1):63-72. Abstract
Sobotka L. et al. (2018): The effect of new self-adherent antimicrobial wound dressing on biofilm in comparison with established silver dressing. EWMA 2018 Krakow, Poland 9 – 11 May 2018, EP290. Abstract
3 Hermans J. (2019): The effectiveness of high molecular weight hyaluronic acid for knee osteoarthritis in patients in the working age: a randomised controlled trial. BMC Musculoskeletal Disorders (2019) 20:196 Abstract
Yıldırım S. et al. (2018): Effect of topically applied hyaluronic acid on pain and palatal epithelial wound healing: An examiner-masked, randomized, controlled clinical trial. J Periodontol. 2018 Jan;89(1):36-45. Abstract
4 Alsaedy S.J. et al. (2017): The Efficacy of Topical Hyaluronic Acid Serum in Acne Scar Patients Treated with Fractional CO2 Laser. American Journal of Dermatology and Venereology 2017, 6(2): 17-24. Abstract
Faga A. et al. (2013): Hyaluronic acid three-dimensional scaffold for surgical revision of retracting scars: a human experimental study. Int Wound J. 2013 Jun;10(3):329-35. Abstract
5 Mahedia M. et al. (2016): Clinical Evaluation of Hyaluronic Acid Sponge with Zinc versus Placebo for Scar Reduction after Breast Surgery. Plast Reconstr Surg Glob Open. 2016 Jul 11;4(7):e791 Abstract
Voinchet V. et al. (2006): Efficacy and safety of hyaluronic acid in the management of acute wounds. Am J Clin Dermatol. 2006;7(6):353-7. Abstract
6 Oberreiter M. et al. (2021): The efficacy of hyaluronic acid in combination with an antiseptic - experience from acute military-based wound care. Worldwide Military Medicine ALMANAC 06/2021 Abstract
7 Humbert P. et al. (2013): Efficacy and safety of a gauze pad containing hyaluronic acid in treatment of leg ulcers of venous or mixed origin: a double-blind, randomised, controlled trial. Int Wound J. 2013 Apr;10(2):159-66 Abstract
Motolese A. et al. (2013): Interaction between a regenerative matrix and wound bed in nonhealing ulcers: results with 16 cases. Biomed Res Int. 2013:849321. Abstract
8 Ozgultekin A. et al. 2017: Comparison of hyaluronic acid containing products with wet dressing for severe decubitus ulcers. EP343, EWMA Congress 2017, Amsterdam, The Netherlands, 3–5 May 2017 Abstract
9 Hwang Y. et al. (2016): Hyaluronic Acid Dressing in the Treatment of Diabetic Foot Ulcer: A Prospective, Randomized, Placebo-Controlled, Single-Center Study. Foot & Ankle Orthopaedics 2016; 1:1 Abstract
10Cetinkaya O.A. et al. (2020): Treatment of hard-to-heal leg ulcers with hyaluronic acid, sodium alginate and negative pressure wound therapy. J Wound Care. 2020 Jul 2;29(7):419-423. Abstract
Sobotka L. et al. (2014): The combination of hyaluronate-iodine complex and negative pressure therapy on non-healing diabetic wounds. EWMA 2014, 14-16 May 2014, Madrid, Spain, P280. Abstract
11 Fioramonti P. et al. (2012): A Successful Collagenase and Hyaluronic Acid Topical Use Combined with Antibiotic Therapy in the Treatment of Ulcerative Lesions Arising on Tattoo. Case Rep Med. 2012; 2012:253492 Abstract
12 Cassuto D., Vinshtok Y. (2020): Treatment of Scar Contracture with Intralesional Jet-Assisted Injection of Hyaluronic acid. J Dermatol Res Ther 2020, 6:094 Abstract
Cassino R., Hussein A. (2019): A topical treatment (gel & cream) to achieve smooth and elastic scars in second and third degree burns. EWMA 2019 Gothenburg, Sweden 5 - 7 June 2019, EP089 Abstract
13 Landi A. et al. (2014): Hyaluronic acid scaffold for skin defects in congenital syndactyly release surgery: a novel technique based on the regenerative model. J Hand Surg Eur Vol. 2014 Nov;39(9):994-1000 Abstract
Onesti M. G. et al. (2014): Long-term in vivo assessment of bioengineered skin substitutes: a clinical study Int Wound J. 2016 Apr;13(2):198-203. Abstract
14 Costagliola M., Agrosì M. (2005): Second-degree burns: a comparative, multicenter, randomized trial of hyaluronic acid plus silver sulfadiazine vs. silver sulfadiazine alone. Curr Med Res Opin. 2005 Aug;21(8):1235-40. Abstract
Kamden A.F. et al. (2021): Assessment of care protocol using hyaluronic acid dressing in Second-Degree skin burns in children. Burns Open (2021) 118-124 Abstract
Voigt J., Driver V.R. (2012): Hyaluronic acid derivatives and their healing effect on burns, epithelial surgical wounds, and chronic wounds: A systematic review and meta‐analysis of randomized controlled trials. Abstract
Wehrmedizin und Wehrpharmazie 3/2021
Dr. med. Claus von Schroeder
Facharzt für Allgemeinmedizin
Im Hagen 15
29549 Bad Bevensen