VOM OBDUKTIONSSAAL ZUM NEXT GENERATION SEQUENCING (NGS): NEUE SCHWERPUNKTE UND FÄHIGKEITSENTWICKLUNGEN AN DEN INSTITUTEN FÜR PATHOLOGIE DER BUNDESWEHRKRANKENHÄUSER ULM UND KOBLENZ
From Autopsy Theatre to Next Generation Sequencing (NGS): New Focus and Facilities evolving in the Institutes for Pathology at the German Armed Forces Hospitals Ulm and Koblenz
Aus den Instituten für Pathologie und Molekularpathologie (Leiter: Oberstarzt Dr. K. Kraft / Oberstarzt Dr. T. Göller) des Bundeswehrkrankenhauses Ulm¹ (Chefarzt: Generalarzt Dr. A. Kalinowski) und des Bundeswehrzentralkrankenhauses Koblenz²(Chefarzt: Generalarzt Dr. M. Zallet)
Konrad Steinestel¹, Alexander Ammon², Vincent Umathum¹, Adrian Sailer¹, Klaus Kraft¹, Erich Sieber², Thomas Göller², Ingo Engels² und Annette Arndt¹
WMM, 59. Jahrgang (Ausgabe 1/2015; S. 14-20)
Zusammenfassung Hintergrund: Das Fachgebiet Pathologie als zentrales Schnittstellenfach der modernen Medizin unterliegt derzeit einem tiefgreifenden Wandel.
Die klassischen morphologischen Techniken, welche in der über 150-jährigen Geschichte dieses Faches entwickelt und stets weiter verbessert wurden – Obduktion, makroskopische und mikroskopische Begutachtung sowie (Immun-)Histochemie – haben nach wie vor einen zentralen Stellenwert bei der Identifikation und Bewertung von pathologischen Gewebeveränderungen als Grundlage von Gesundheitsstörungen. In den letzten Jahren entwickelte sich darauf aufbauend jedoch ein breites Spektrum neuer, insbesondere molekularbiologischer Methoden, die zur Identifikation von pathologischen Veränderungen zusätzlich auch weitergehende Aussagen über deren biologische Eigenschaften, über Genese und Prognose von Erkrankungen sowie die Sensitivität gegenüber gezielten Therapien erlauben.
Zielsetzung und Resultate: Diese Arbeit soll einen Überblick über dieses neue Fähigkeitsspektrum innerhalb des Fachgebietes Pathologie am Beispiel bereits etablierter molekularpathologischer Verfahren an den Instituten für Pathologie der Bundeswehrkrankenhäuser Ulm und Koblenz geben. Darüber hinaus soll die klinische Bedeutung der hierbei gewonnenen Informationen an einem ausgewählten Erkrankungsspektrum exemplarisch dargestellt werden. Am Ende der Übersicht werden in einem kurzen Ausblick die zukünftigen Entwicklungen innerhalb des Fachgebiets skizziert und die zentrale Rolle einer umfassenden feingeweblichen Diagnostik aus einer Hand innerhalb der Bundeswehr dargestellt.
Schlagworte: Gewebebasierte Diagnostik, Molekularpathologie, Personalisierte Medizin, Next Generation Sequencing
Summary
Background: Diagnostic pathology is a core subject in modern medicine. Classical morphology-based techniques, such as autopsy, macro- and microscopic evaluation as well as (immuno-) histochemistry, developed and improved over the last 150 years, are still of high importance for the identification and assessment of tissue alterations forming the underlying basis of clinical symptoms. However, over the last years, a broad spectrum of new methodical approaches evolved from and upon these basic techniques and - beyond identification of pathological tissue alterations - allows gaining of additional information regarding biological properties, pathogenesis and prognosis of disease as well as sensitivity to targeted therapies.
Aim and Results: In this overview, new possibilities in diagnostic pathology by using the example of established molecular diagnostic testing at the Institutes of Pathology of the Armed Forces Hospitals in Ulm and Koblenz are depicted. Furthermore, the clinical relevance of the obtained information from a representative disease spectrum in clinical context will be demonstrated; finally, we outline the evolution which is still ongoing in our field and underline the central role of comprehensive tissue-based diagnostics from one source within the German Army medical system.
Keywords: Tissue-based diagnostics, molecular pathology, personalized medicine, next generation sequencing
Einführung
„Darum haben verdiente Männer es oft genug ausgesprochen, dass wir bei dem anatomisch-pathologisch Ueberlieferten nicht stehen bleiben dürfen, sondern auf anderm Wege das Gegebene zu erweitern sei. (…) Und wenn man vielleicht noch oft aus schlecht und gut Beobachtetem unbesonnene Theorien ziehen wird, so wird gewiss endlich eine bessere Methode siegen und über Krankheitserscheinungen ein neues Licht verbreitet werden, an denen die Pathologen früherer Jahrhunderte sich vergebens durch Erklärungen abgemüht.“ (Gottlieb Gluge (1812 - 1898) im Vorwort zu „Anatomisch-Mikroskopische Untersuchungen zur Allgemeinen und Speziellen Pathologie“ (Vol. I; 1839) [1])
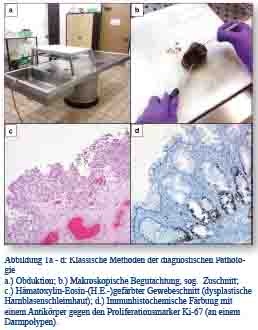
Die Pathologie (von griech. παθολογία; aus πάθος páthos – Krankheit und λόγος lógos - Lehre) ist die Lehre von den krankhaften Veränderungen der Organe und Organsysteme und den morphologischen Korrelaten dieser Veränderungen auf makroskopischer und mikroskopischer Ebene. Bereits im Laufe des letzten Jahrhunderts wandelte sich die Bedeutung des Faches wesentlich; aus einer reinen Grundlagenwissenschaft, welche im Wesentlichen im Rahmen von Obduktionen erhobene krankhafte Abweichungen beschrieb, entwickelte sich seit den 1960er Jahren ein medizinisches Fachgebiet, das klinisch tätigen Kollegen Diagnosen anhand von Probenmaterial lebender Patienten zur Verfügung stellt [2, 3]. Hierbei handelt es sich um Operationspräparate, Biopsien, Zellabstriche und -aspirate oder Körperflüssigkeiten wie Blut oder Urin. Neben der Obduktion, die auch heute noch eine wichtige Rolle bei der Feststellung der Todesursache, der Überprüfung von Diagnosen und damit der Qualitätssicherung spielt, beinhaltet das eingesetzte Methodenspektrum die Analyse von Gewebeschnitten mittels Histochemie und Immununhistochemie [4, 5] (Abbildung 1a - d).
Individuell auf den Patienten abgestimmte Aussagen bezüglich Prognose und Therapiemöglichkeit z. B. von Tumorerkrankungen basierten bislang jedoch hauptsächlich auf statistischen Vergleichen zur Tumorausbreitung, zum Proliferationsindex oder der Gefäßinvasion.
Molekulare Diagnostik in der Pathologie
Die Molekularpathologie, deren Verbreitung innerhalb der letzten 10 bis 15 Jahre rasant zugenommen hat, erweitert das Spektrum der diagnostischen Pathologie erheblich [6]. Im Kontext von Infektionskrankheiten spielen Techniken der PCR1 nicht nur eine essentielle Rolle bei der Identifizierung und Subtypisierung von erregerspezifischen DNA-Sequenzen direkt aus Gewebematerial, sondern es können auch rasch resistenzvermittelnde Mutationen der Erreger gegen Antiinfektiva identifiziert werden. Für die Tumordiagnostik sind durch den Einsatz molekularbiologischer Methoden ebenfalls Aussagen über spezifische Alterationen innerhalb krankhafter Veränderungen möglich, welche nicht nur eine genauere Entitätszuordnung, sondern auch eine individuelle Prognose über das Ansprechen auf spezifische (zielgerichtete) Therapien erlauben (personalisierte Medizin).
Um dieser neuen Entwicklung und einem maximalen Qualitätsanspruch in der Patientenversorgung gerecht zu werden, hat die Bundeswehr an den Instituten für Pathologie der Bundeswehrkrankenhäuser (BwKrhs) Ulm und Koblenz neben einer für diese Tätigkeit unerlässlichen großzügigen Geräteausstattung jeweils eine Stelle für einen Wissenschaftsoffizier als Spezialist/ in für die Molekularpathologie geschaffen. Diese/r wird unterstützt durch militärisches und/oder ziviles Assistenzpersonal (medizinisch/biologisch-technische Assistent/in). Den routinemäßigen Ablauf einer molekularpathologischen Analyse an entnommenem Gewebematerial illustriert schematisch Abbildung 2. Im Folgenden soll an ausgesuchten Beispielen aus unserer täglichen Praxis der Einsatz molekularbiologischer Methoden in der Pathologie näher erläutert werden.
Molekulare Erregerdiagnostik
Helicobacter pylori
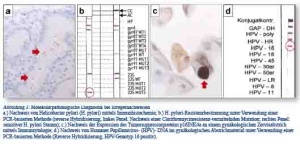
Die kausale Rolle des Bakteriums Helicobacter pylori für die Magenschleimhautentzündung (Typ-B Gastritis) wurde im Wesentlichen durch die wegweisenden Arbeiten von Marshall und Warren in den 1980er Jahren belegt (Nobelpreis für Medizin 2005) [7, 8]. Der Erreger erzeugt eine persistierende, chronische bis floride Entzündungsreaktion der Magenschleimhaut. Die Freisetzung von reaktiven Sauerstoffradikalen und Stickstoffverbindungen im Rahmen dieser Entzündungsreaktion hat eine mutagene Wirkung, was auf längere Sicht die Entstehung von Magenkrebs fördern kann [9]. Eine Eradikation von H. pylori ist daher in vielen Fällen indiziert, wird aber durch eine zunehmende Resistenzlage gegenüber den gängigen Antiinfektiva erschwert [10, 11]. So liegt in Mitteleuropa (Erwachsene) bei 18,7 % der H. pylori-Infektionen eine Resistenz gegen Clarithromycin, bei 18,6 % eine Resistenz gegen Levofloxacin sowie bei 43,8 % eine Resistenz gegen Metronidazol vor [11]. Bei histologischem Nachweis stäbchenförmiger Mikroorganismen (Abbildung 3a) wird daher an unseren Instituten nach Extraktion gesamtgenomischer DNA mittels PCR eine spezifische Vervielfältigung bestimmter Bereiche der bakteriellen DNA vorgenommen. Die anschließende Auswertung erfolgt über ein Verfahren, das als reverse Hybridisierung bezeichnet wird (Abbildung 3b; HelicoType DR Testkit, Hain Lifesciences, Nehren, DE). Mit dem verwendeten Testsystem können bestimmte resistenzvermittelnde Mutationen der bakteriellen Gyrase (gyrA, vermittelt Chinolonresistenz) sowie des 23S-RNA-Gens (vermittelt Clarithromycinresistenz) nachgewiesen und somit frühzeitig potentielle Therapieversager ermittelt werden.
Humane Papillomviren (HPV)
Bei der Entstehung von Plattenepithelkarzinomen der Cervix uteri spielen persistierende Infektionen mit Humanen Papillomviren (HPV) der Hochrisikogruppe (u. a. HPV-16 u. -18) eine entscheidende Rolle; für seine diesbezüglichen Arbeiten in den 1980er Jahren erhielt Harald zur Hausen im Jahre 2008 den Nobelpreis für Medizin [12, 13]. In den letzten Jahren ist darüber hinaus ein deutlicher Anstieg in der Inzidenz HPV-assoziierter Plattenepithelkarzinome der Kopf- Hals- Region zu verzeichnen [14] – ein Trend, der auch durch Untersuchungen am Patientengut der Bundeswehrkrankenhäuser Ulm und Koblenz bestätigt werden konnte. So zeigt beispielsweise eine Untersuchung von Maier et al. aus dem Jahre 2013 den Nachweis von Erbgut des Hochrisikostammes HPV-16 in 37,5 % der untersuchten Tonsillenkarzinome [15]. Dies ist von besonderem Interesse, da sich Hinweise auf eine prognostische und möglicherweise auch therapeutische Relevanz der virusassoziierten Tumorgenese mehren [14]. An unseren Instituten werden sowohl Tumorpräparate der Kopf-Hals-Region als auch gynäkologische Abstrichpräparate der Cervix uteri bei Erfüllung spezifischer histo- bzw. zellmorphologischer Kriterien auf eine Expression des Tumorsuppressorproteins p16INK4a untersucht, welches in den genannten Lokalisationen als Surrogatmarker für eine virusassoziierte Tumorgenese gilt (Abbildung 3c) [16, 17]. Bei Expression des Proteins erfolgt nach DNA-Extraktion und PCR – ähnlich der geschilderten H. pylori-Diagnostik – mittels reverser Hybridisierung der Nachweis des Virusgenoms bei gleichzeitiger Subtypisierung bestimmter diagnostisch relevanter HPV-Genotypen (Abbildung 3d; HPV typing kit, AID Diagnostika, Strassberg, DE). Darüber hinaus wird dieses Testsystem an unseren Instituten für eine HPV-basierte Risikogruppierung bei potentiellen Vorläuferläsionen, beispielsweise bei penilen oder zervikalen Kondylomen, eingesetzt. Diese sind häufig mit HPV-Infektionen der sogenannten Niedrigrisikogruppe wie Genotypen 6 oder 11 assoziiert, die jedoch im Unterschied zu HPV-Genotypen der Hochrisikogruppe nur ein geringes Entartungspotential besitzen [18].
Molekulare Diagnostik bei Tumorerkrankungen
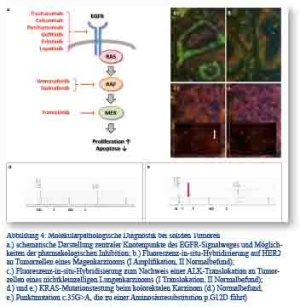
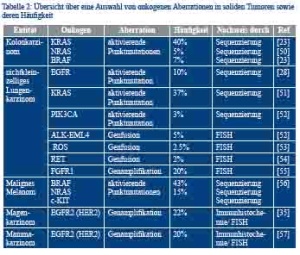
Die Entstehung sowie das unkontrollierte Wachstum zahlreicher solider Tumoren wird durch die Aktivierung proliferationsfördernder und apoptosehemmender Signalwege innerhalb der Tumorzelle verursacht; dies kann durch chromosomale Aberrationen, wie beispielsweise Genamplifikationen oder Gentranslokationen, aber auch durch verschiedene Mutationen oder epigenetische Modifikationen des Erbguts einer Zelle ausgelöst werden. Ein Beispiel für einen solchen aktivierenden Signalweg ist der „epidermal growth factor receptor (EGFR)-Pathway“ [19]. Abbildung 4a stellt schematisch die Hierarchie der Signalentstehung in diesem Signalweg dar und zeigt einige der für die Signalweiterleitung zuständigen Schlüsselproteine. Tabelle 2 fasst häufige Alterationen sogenannter Onkogene zusammen. Diese konnten in Krebszellen verschiedener Tumorentitäten identifiziert werden und erhöhen die Aktivität der zentral in die Signalweiterleitung eingebundenen Proteine. Der Nachweis von tumorspezifischen Veränderungen ist von besonderem klinischem Interesse, da einige der durch die jeweiligen Onkogene kodierten Proteine mögliche Zielstrukturen antineoplastischer Therapien darstellen.
Kolorektales Karzinom
Das kolorektale Karzinom ist weltweit die zweithäufigste Tumorerkrankung bei Frauen sowie die dritthäufigste Tumorerkrankung bei Männern [20]. Liegen zum Zeitpunkt der Diagnosestellung bereits nicht resektable Metastasen vor, beträgt das mediane Überleben je nach Patientenalter bei Diagnose zwischen 5 und 15 Monaten [21]. In dieser Situation kann eine gezielte Hemmung der EGFR-Signalaktivität im Tumorgewebe das Überleben signifikant verlängern; dies setzt allerdings eine bestehende Abhängigkeit der Signalaktivität von einer Ligandenbindung an den EGF-Rezeptor voraus (Abbildung 4a) [21]. Aktivierende Mutationen in den RAS-Genen, wie sie in über 50 % der kolorektalen Karzinome vorkommen (Tabelle 2) [22], entkoppeln die Signalaktivität vom übergeordneten Rezeptor und die Hemmung des Rezeptors führt zu keinem zusätzlichen Überlebensvorteil. Für aktivierende BRAF-Mutationen (7 % der Fälle [23]) ist der Effekt auf die Wirksamkeit der EGFR- Blockade unklar, allerdings scheinen BRAF-mutierte Kolonkarzinome unter bestimmten Voraussetzungen einen aggressiveren Verlauf zu zeigen [24]. Eine kombinierte KRAS-/ BRAF-Mutationsanalyse von 117 kolorektalen Karzinomen am Einsendegut des BwKrhs Ulm konnte die Häufigkeitsangaben aus der nationalen und internationalen Literatur bestätigen und fand Eingang in die Behandlungspläne der betroffenen Patienten [25]. Da es sich bei den beschriebenen genetischen Veränderungen um somatische und tumorspezifische Mutationen handelt, die zudem in geringsten Probenmengen sicher detektiert werden müssen, ist es wichtig, eine ausreichend spezifische und sensitive Methode für den Mutationsnachweis anzuwenden. In den molekularpathologischen Labors der BwKrhs Ulm und Koblenz werden zur Bestimmung des RAS-/ BRAF-Mutationsstatus die Mutationsfoci („hotspots“) mittels PCR amplifiziert und die Basenabfolge der vervielfachten Genabschnitte auf das Vorliegen von Mutationen untersucht. Die hierfür unter anderem von uns eingesetzte Pyrosequenzierung ermöglicht die Detektion von noch 5 % mutierten Allelen, was eine sichere Mutationsbestimmung auch in Proben mit unter 10 % Tumorgehalt ermöglicht [26] (therascreen KRAS/NRAS/ BRAF Pyro Kits, Qiagen, Hilden, DE; Abbildung 2 sowie 4d und 4e).
Nichtkleinzelliges Lungenkarzinom (NSCLC)
Die Fünf-Jahres-Überlebensrate unter konventioneller Therapie beim NSCLC (Operation, Chemotherapie, Strahlentherapie), eine der häufigsten Krebsarten weltweit, verharrte in den letzten Jahrzehnten auf einem relativ niedrigen Stand (2008: 15 %) [27]. Der EGF-Rezeptor-Signalweg spielt auch bei der Tumorgenese und Progression des NSCLC eine entscheidende Rolle; in 10 % der Fälle liegen aktivierende Mutationen der Kinasedomäne (Exone 18 - 21) des EGFR-Gens vor, welche die Signalaktivität des Rezeptors erhöhen [28]. Zudem können Genamplifikationen des Rezeptors auftreten [29]. Zusätzliche onkogene Aberrationen im NSCLC betreffen beispielsweise aktivierende Punktmutationen in KRAS (Abbildung 4a) oder chromosomale Rearrangements, die zur Bildung von proliferationsfördernden Fusionsgenen führen (beispielsweise ALK-, RET- oder ROS-Translokationen) [30]. An den Instituten für Pathologie der BwKrhs Ulm und Koblenz können die genannten Aberrationen mithilfe unterschiedlicher Analyseverfahren wie beispielsweise dem Einsatz von Sequenzier- und qPCR-Techniken (Mutationsnachweis im KRAS- bzw. EGFR-Gen) bzw. Fluoreszenz-in-situ-Hybridisierung (FISH, ALK-Rearrangements, Abbildung 4c I und II) nachgewiesen werden. Diese Analysen ermöglichen den Einsatz von gezielten Therapeutika, wie Gefitinib, Erlotinib oder Crizotinib, bei Patienten mit EGFR-Mutation-positiven bzw. ALK-Translokation- positiven Tumoren (Abbildung 4c I) [29].
Malignes Melanom
Das fortgeschrittene Melanom ist mit einer äußerst schlechten Prognose behaftet. Im Jahre 2010 lag die mediane Überlebenszeit nach Diagnosestellung im Stadium IV zwischen 8 und 18 Monaten [31]. 2011 konnte gezeigt werden, dass in bis zu 60 % der Fälle, in denen im Tumorgewebe eine aktivierende BRAF-Mutation vorliegt, durch die Gabe des BRAF-Inhibitors Vemurafenib (bzw. Dabrafenib) ein signifikanter Überlebensvorteil erzielt werden kann (Gesamtüberleben nach 6 Monaten: 84 % im Vergleich zu 64 % in der konventionell mit Dacarbazine behandelten Kontrollgruppe) [32]. Eine rasche Bestimmung des BRAF-Mutationsstatus ist bei Patienten mit fortgeschrittenem Melanom daher von hoher klinischer Relevanz und wird durch die Institute für Pathologie der Bundeswehrkrankenhäuser Ulm und Koblenz routinemäßig durchgeführt. Leider konnte mittlerweile ebenfalls gezeigt werden, dass es in einem Teil der Fälle im Therapieverlauf zu einer Resistenz gegen den BRAF-Inhibitor kommt. Aktuellen Studien zufolge ist ein solcher resistenzvermittelnder Mechanismus beispielsweise die Überaktivierung des (N)RAS-Signalweges, welche über alternative Signalrouten die Aktivität des EGFR-Signalweges sicherstellt (Abbildung 4a) [33]. Da diese Resistenzentwicklung durch das sekundäre Auftreten aktivierender NRAS-Mutationen getriggert wird, ist eine NRAS-Mutationstestung unter diesen Umständen ebenfalls von klinischer Bedeutung und wird durch die molekularpathologischen Labors beider Institute auf Wunsch durchgeführt.
Magenkarzinom
Weltweit gesehen steht das Magenkarzinom an vierter Stelle der Krebsinzidenz und an zweiter Stelle der krebsbedingten Todesursachen [20]. Die mediane Überlebensrate von Patienten mit nichtoperablen, rezidivierten oder metastasierten Tumoren beträgt unter konventioneller Chemotherapie 11,1 Monate [34]. Über 20 % der Magenkarzinome des intestinal differenzierten Subtyps zeigen eine Genamplifikation (Erhöhung der Anzahl an Genkopien) der Isoform 2 des EGF-Rezeptors (HER2; Tabelle 2) [35]. Da die Genamplifikation von HER2 auch zu einer Überexpression des Rezeptors auf Proteinebene führt, kann dieser mit einem blockierenden Antikörper (Trastuzumab) gezielt gehemmt werden, was die HER2-Signalaktivität innerhalb der Zelle und damit die zelluläre Proliferationsgeschwindigkeit verringert. Die Therapie mit Trastuzumab bei HER2-Genamplifikation führte in der 2010 publizierten ToGA-Studie zu einer signifikanten Erhöhung des Gesamtüberlebens (auf 13,8 Monate; 95 %-Konfidenzintervall: 12 - 16 Monate) [34]. Zur Feststellung einer HER2-Genamplifikation werden alle Magenkarzinomfälle der Bundeswehrkrankenhäuser Ulm und Koblenz, die mit einem HER2-Immunscore von 2+ bewertet wurden, leitliniengerecht einer FISH-Analyse unterzogen (Abbildung 4b I und II) [36]. Bei HER2-positivem Befund (Abbildung 4b I) kann der Patient einer Trastuzumab-Antikörpertherapie zugeführt werden.
Qualitätssicherung in der Molekularpathologie (QM)
Obwohl die Molekularpathologie eine vergleichsweise junge Disziplin in der pathologischen Routinediagnostik darstellt, sind bereits enorme Anstrengungen von der Deutschen Gesellschaft für Pathologie (http://www.dgp-berlin.de) hinsichtlich eines Aufbaus von externen Qualitätssicherungsmaßnahmen unternommen worden. In Anlehnung an die QM-Verfahren in der Immunhistochemie wurde bereits eine Vielzahl von Ringversuchen für molekularpathologische Nachweisverfahren etabliert; diese werden in regelmäßigem Rhythmus von der „Qualitätssicherungs-Initiative Pathologie“ (QuIP) für die molekularbiologisch tätigen pathologischen Institute angeboten. Zur Sicherung einer gleichbleibend hohen Qualität der Diagnostik nehmen beide Bundeswehrkrankenhäuser regelmäßig mit Erfolg an dieser externen Evaluation der Testqualität teil (Tabelle 3).
Blick in die Zukunft: Molekularpathologische Diagnostik unter Einsatz von Next Generation Sequencing (NGS)-Techniken
Bereits die wenigen hier dargestellten Beispiele aus der täglichen Praxis zeigen den Stellenwert, welchen molekularbiologische Analysen bereits heute in der pathologischen Routinediagnostik einnehmen. Es ist zu erahnen, dass die steigende Anzahl an neu identifizierten genetischen Veränderungen in bestimmten Tumorentitäten und die damit einhergehende Entwicklung zielgerichteter Therapeutika zu einer weiter zunehmenden Bedeutung dieser innovativen Diagnostik führen werden. Während beispielsweise bis vor kurzem das alleinige Ausschlusskriterium für die Antikörpertherapie beim metastasierten Darmkrebs das Vorliegen einer KRAS-Mutation war, muss seit kurzem auch der Mutationsstatus des homologen NRAS-Gens überprüft werden [23, 37]. Die zunehmende Anzahl der zu testenden Genloci bzw. Gene - bisher zumeist stufendiagnostisch durchgeführt - ist jedoch mit einem enormen Zeit- und Kostenaufwand verbunden und mit den bisher eingesetzten Methoden zeitnah kaum zu bewerkstelligen. Zudem steht für eine zunehmende Anzahl an Analysen nur eine begrenzte Menge an isolierter Patienten-DNA beispielsweise aus Stanzzylindern zur Verfügung. Einen möglichen Ausweg bieten hier Next Generation Sequencing (NGS)-Techniken, die eine massive Parallelsequenzierung und somit eine Erhöhung des Probendurchsatzes bei geringerem Zeitaufwand ermöglichen [38, 39]. Gleichzeitig bieten diese Methoden im Vergleich zur bisher häufig eingesetzten Sanger-Sequenzierung noch den Vorteil einer erhöhten Sensitivität. Dies verbessert zum einen signifikant das Input- Output-Verhältnis, d.h. das Verhältnis der durch die Größe der Gewebeprobe bzw. deren Tumorgehalt vorgegebenen Menge an Patienten-DNA zu gewonnenem Informationsgehalt. Zum anderen können mit diesen Methoden auch noch sehr niedrige Mutationsfrequenzen zuverlässig nachgewiesen werden [40]. Erste Tendenzen von NGS in der Routinediagnostik gehen daher zur zielgerichteten Resequenzierung sogenannter Tumorpanels, die eine parallele Sequenzierung von tumorspezifischen Kandidatengenen in einem Probendurchlauf erlauben. Durch die Beschränkung auf Panelsequenzierungen können sowohl entstehende Kosten als auch die generierte Menge an biomathematischen Daten pro Patient in vertretbaren Grenzen gehalten werden. Schließlich ermöglicht der Einsatz von NGS-Plattformen eine Vereinigung multipler genetischer und epigenetischer Nachweisverfahren auf einem System, während für die zuvor beschriebenen, heute im Einsatz befindlichen Methoden mehrere Detektionssysteme parallel vorgehalten und betrieben werden müssen.
Zusammenfassung und Ausblick
Zusammenfassend kann festgestellt werden, dass sich das Spektrum der klinischen Pathologie in den letzten Jahren signifikant erweitert hat. Ausgehend von einer oftmals rein beschreibenden Diagnostik, erlauben molekularbiologische Methoden heute eine genauere Entitätsbestimmung und Rückschlüsse auf die Genese von Gesundheitsstörungen; darüber hinaus liefern sie therapierelevante Informationen. Die Zunahme an spezialisierten, interdisziplinären Organkrebszentren – als Beispiel ist das bestehende Darmkrebszentrum am Bundeswehrkrankenhaus Ulm zu nennen – erfordert eine vorhandene molekularpathologische Expertise, da die Durchführung von Mutationsanalysen unter gegebenen klinischen Voraussetzungen in der entsprechenden S3-Leitlinie verankert ist [41, 42]. Dies gilt gleichermaßen für die S3-Leitlinien zum Lungenkarzinom [43] sowie zum malignen Melanom [44]. Dieser Entwicklung wurde durch den Aufbau eigener molekularpathologischer Abteilungen in den Instituten für Pathologie der BwKrhs Ulm und Koblenz Rechnung getragen. Um den zunehmenden qualitativen und quantitativen Anforderungen in der molekularpathologischen Diagnostik gerecht zu werden, ist es jedoch unabdingbar, mit den raschen Entwicklungen im Fachgebiet – Stichwort Next Generation Sequencing – Schritt zu halten und die Abteilungen entsprechend weiter zu entwickeln. Abschließend ist hervorzuheben, dass die Resultate der molekularen Diagnostik auch entscheidend zur wissenschaftlichen Profilierung beider akademischer Lehrkrankenhäuser beitragen; mehrere wissenschaftliche Originalarbeiten in angesehenen nationalen und internationalen wissenschaftlichen Fachzeitschriften mit Peer Review-System basierten wesentlich auf den hierbei gewonnenen Daten und erzielten beispielsweise alleine für das Bundeswehrkrankenhaus Ulm einen kumulativen Impact Factor (IF) von 22,8 innerhalb von zwei Jahren (06/2012 - 06/2014) [15, 25, 45 - 49]. Die beiden Institute für Pathologie der Bundeswehrkrankenhäuser in Ulm und Koblenz haben erfolgreich den Einstieg in die molekulare Diagnostik vollzogen. Es gilt nun, auf dem Erreichten in Zukunft auf gleichbleibend hohem Qualitätsniveau und gemäß dem jeweils aktuellen Stand von Wissenschaft und Technik weiter aufzubauen.
1 In Tabelle 1 sind die wichtigsten in diesem Artikel genutzten Abkürzungen aus der Molekularpathologie erklärt.
Literaturverzeichnis
- Gluge G: Anatomisch-mikroskopische Untersuchungen zur allgemeinen und speziellen Pathologie. Essmann; 1839.
- Rosai J: Guiding the surgeon‘s hand: the History of American Surgical Pathology. American Registry of Pathology; 1997.
- Gal AA: In Search of the Origins of Modern Surgical Pathology. Advances in Anatomic Pathology 2001, 8:1-13.
- Lang G: Geschichte der histologischen Technik. In Histotechnik. Springer Vienna; 2013: 415-429.
- Petros K, Wittekind C: Die Obduktion–ein Verfahren der Medizingeschichte? Medizinische Klinik-Intensivmedizin und Notfallmedizin 2014, 109:115-120.
- Dietel M, Denkert C, Hauptmann K, Anagnostopoulos I, Jöhrens K: Konzept der prädiktiven Molekularpathologie. Onkologe 2011, 17:437-452.
- Marshall BJ: The Campylobacter pylori Story. Scandinavian Journal of Gastroenterology 1988, 23:58-66.
- Mégraud F: A humble bacterium sweeps this year‘s Nobel Prize. Cell 2005, 123:975-976.
- Lee I: Critical pathogenic steps to high risk Helicobacter pylori gastritis and gastric carcinogenesis. World J Gastroenterol 2014, 20:6412-6419.
- Prinz C: Helicobacter pylori. Der Gastroenterologe 2010, 5:269- 278.
- Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y, Alarcon T: Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut 2013, 62:34-42.
- Schwarz E, Freese UK, Gissmann L, Mayer W, Roggenbuck B, Stremlau A, zur Hausen H: Structure and transcription of human papillomavirus sequences in cervical carcinoma cells. Nature 1985, 314:111-114.
- zur Hausen H: The search for infectious causes of human cancers: where and why (Nobel lecture). Angewandte Chemie International Edition 2009, 48:5798-5808.
- Marur S, D‘Souza G, Westra WH, Forastiere AA: HPV-associated head and neck cancer: a virus-related cancer epidemic. The Lancet Oncology 2010, 11:781-789.
- Maier M, Kraft K, Steinestel K, Schramm A, Lorenz K, Tisch M, Schwerer M, Maier H: Humane Papillomavirusinfektionen bei Plattenepithelkarzinomen des Kopf-und Halsbereichs. HNO 2013, 61:593-601.
- El-Naggar AK, Westra WH: p16 expression as a surrogate marker for HPV-related oropharyngeal carcinoma: A guide for interpretative relevance and consistency. Head & neck 2012, 34:459-461.
- Kalof AN, Cooper K: p16INK4a immunoexpression: surrogate marker of high-risk HPV and high-grade cervical intraepithelial neoplasia. Advances in anatomic pathology 2006, 13:190-194.
- Chaux A, Cubilla AL: Diagnostic problems in precancerous lesions and invasive carcinomas of the penis. In Seminars in diagnostic pathology. Elsevier; 2012: 72-82.
- Normanno N, De Luca A, Bianco C, Strizzi L, Mancino M, Maiello MR, Carotenuto A, De Feo G, Caponigro F, Salomon DS: Epidermal growth factor receptor (EGFR) signaling in cancer. Gene 2006, 366:2-16.
- Jemal A, Center MM, DeSantis C, Ward EM: Global Patterns of Cancer Incidence and Mortality Rates and Trends. Cancer Epidemiology Biomarkers & Prevention 2010, 19: 1893-1907.
- Mitry E, Rollot F, Jooste V, Guiu B, Lepage C, Ghiringhelli F, Faivre J, Bouvier AM: Improvement in survival of metastatic colorectal cancer: Are the benefits of clinical trials reproduced in population- based studies? European Journal of Cancer 2013, 49:2919-2925.
- Douillard JY, Oliner KS, Siena S, Tabernero J, Burkes R, Barugel M, Humblet Y, Bodoky G, Cunningham D, Jassem J, Rivera F, Kocakova I, Ruff P, Blasinska-Morawiec M, Smakal M, Canon JL, Rother M, Williams R, Rong A, Wiezorek J, Sidhu R, Patterson SD: Panitumumab- FOLFOX4 treatment and RAS mutations in colorectal cancer. The New England journal of medicine 2013, 369:1023-1034.
Interessenkonflikt: Die Verfasser erklären, dass keine Interessenkonflikte bestehen.
Bildquellennachweis: Abbildungen 1 - 4: eigene Abbildungen (K.S./ K.K./A.A., Institut für Pathologie und Molekularpathologie, Bundeswehrkrankenhaus Ulm)
Datum: 13.02.2015
Quelle: Wehrmedizinische Monatsschrift 2015/1