Vom Gefechtsfeld in die Klinik und zurück – neue Wege in der Lost-Forschung
Simon Lang¹, Yi-hua Jan², Kai Kehe³, Horst Thiermann¹, Jeffrey D. Laskin², Dirk Steinritz¹
¹Institut für Pharmakologie und Toxikologie der Bundeswehr, München
²Environmental & Occupational Health Institute, Rutgers University, Piscataway, NJ
³Sanitätsakademie der Bundeswehr, München
Einleitung

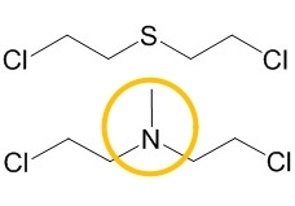
Schon 1919 fand man bei S-Lost exponierten Personen eine Beeinträchtigung der Blutzellbildung und das Auftreten von Leukozytopenien [2], woraus man u. a. schloss, dass S-Lost Zellen mit hoher Teilungsrate attackiert. Dies führte dazu, dass Lost und insbesondere dessen Stickstoffderivate vermehrt therapeutisch bei Tumorerkrankungen eingesetzt wurden und somit den Startpunkt einer effektiven pharmakologischen Chemotherapie begründeten [3]. V.a. in der klinischen Handhabung erwies sich die Substitution des zentralen Schwefelatoms in S-Lost durch ein Stickstoffatom als vorteilhaft (sog. N-Lost Derivate, Abbildung 1).
Das N-Lost Mechlorethamin zeigt die Ambivalenz alkylierender Hautkampstoffe: Die Substanz ist als „Mustine“ in den USA z. B. zur Therapie bei Morbus Hodgkin zugelassen und steht zugleich als chemischer Kampfstoff auf der Verbotsliste der OPCW [4]. Eine detailliertere Aufklärung der Wirkmechanismen von N-Lost hilft daher, die therapeutische Effektivität zu steigern und daraus mögliche Zielstrukturen für den medizinischen C-Schutz abzuleiten. In einem Kooperationsprojekt des InstPharmToxBw mit der Rutgers State University of New Jersey wurden die Effekte von N-Lost in den verschiedenen Phasen des Zellzyklus untersucht.
Material und Methoden
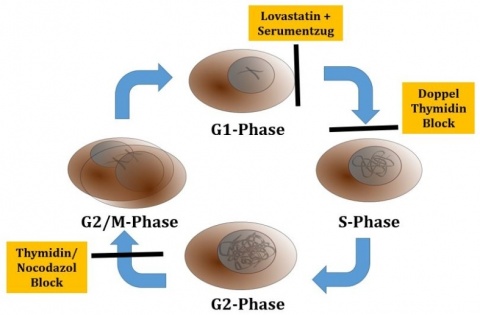
Als Modell für die Untersuchungen diente die humane Keratinozyten Zelllinie HaCaT. Zur Bestimmung der Zytotoxizität in unterschiedlichen Phasen des Zellzyklus wurden zwei Ansätze zur Synchronisation der Zellen etabliert. Mit einem sog. Doppel-Thymidin-Block wurde die Zellpopulation in der G1/S-Phase fixiert, um nach Entfernung des Thymidins den Zellzyklus synchron zu durchlaufen. Im zweiten Ansatz wurden mehrere Methoden zur Arretierung des Zellzyklus in bestimmten Stadien angewendet. Die Zytotoxizität von N-Lost wurde mittels -PrestoBlue Viability Assay die Aktivität von Markern für DNA-Schädigung und Apoptose mittels Westen Blot analysiert. Durch die Zugabe von Inhibitoren verschiedener Zelltod--Pathways wurde untersucht, welche Prozesse hauptsächlich die Zytotoxizität von Mechlorethamin bedingen.
Ergebnisse
V
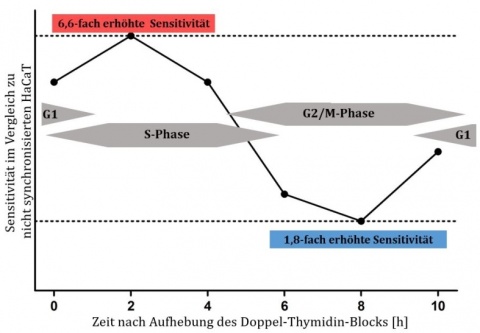
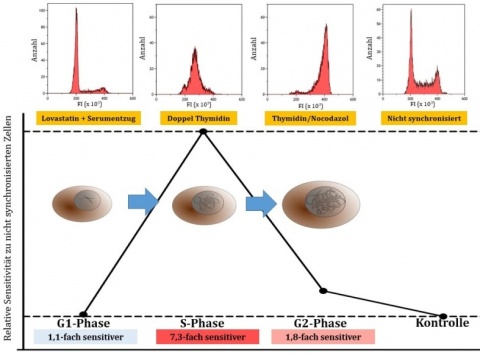
Zellen, die mit einem Doppel-Thymidin-Block in der G1/S-Phase arretiert wurden, befanden sich nach 2 Stunden zu einem großen Teil in der S-Phase mit einer mehr als 6-fach erhöhten Sensitivität gegenüber N-Lost im Vergleich zu nicht synchronisierten Zellen. Der Anteile der Zellen in der S-Phase nahm mit der Zeit ab und diese kamen in die G2/M-Phase, was die Sensitivität gegen N-Lost wieder reduzierte (Abbildung 2). Die synchronisierte Zellpopulation wies in jedem Stadium des Zell-zyklus eine erhöhte Sensitivität auf. Diese Resultate bestätigten sich bei Anwendung weiterer Methoden zur Arretierung in verschiedenen Phasen des Zellzyklus (Abbildung 3). So war die LC50 von Keratinozyten um den Faktor 7,3 niedriger als bei Zellen, die nicht synchronisiert wurden (Abbildung 4).
Marker für DNA-Schädigung und Apoptose waren besonders in der S-Phase hochreguliert. Nicht synchronisierte Zellen und Zellen in anderen Phasen des Zellzyklus zeigten deutlich geringere Effekte bei den untersuchten Markern.Um zu verstehen, welche Vorgänge maßgeblich für den vermehrten Zelltod verantwortlich sind, wurden verschiedene Inhibitoren des apoptotischen Zelltods untersucht. Speziell der Caspase-Inhibitor Z-VAD-FMK zeigte dosisabhängig eine Zytoprotektion. Bei nicht synchronisierten HaCaT konnte Z-VAD-FMK die LC50 verdoppeln und bei Zellen in der S-Phase vervierfachte sich die LC50 im Vergleich zu nicht behandelten Zellen.
Diskussion und Ausblick
Bisher nahm man an, dass die hohe Zytotoxizität der alkylierenden Hautkampfstoffe kaum vom Status des Zellzyklus abhängig ist. Die Ergebnisse zeigen allerdings, dass vor allem Keratinozyten während der S-Phase deutlich sensitiver auf N-Lost reagieren und auch Marker für DNA-Schädigung und Apoptose deutlich erhöht sind.
Der beobachtete Zellzyklusblock in Verbindung mit einer gesteigerten Zytotoxizität von Zellen in der SPhase liefert Anhaltspunkte dafür, dass eine „Second Hit Strategie“ die Effektivität einer Chemotherapie mit N-Lost steigern kann. Eine zunehmende Aufklärung der molekularen Mechanismen steigert das therapeutische Potenzial der ursprünglich als Kampfstoff verwendeten alkylierenden Chemotherapeutika. Die Erkenntnisse für die klinische Anwendung helfen, auch Therapieansätze bei Vergiftungen zu verfolgen.
Die Ergebnisse weisen darauf hin, dass die gezielte Modulation von zellzyklusassoziierten Proteinen einen großen therapeutischen Nutzen haben kann. Sie können dazu beitragen, die medizinische Versorgung nach einer akuten Intoxikation zu verbessern. In weiterführenden Untersuchungen sollte die Evidenz für folgende Handlungsempfehlungen näher geprüft werden:
Der Erstkontakt mit dem Hautkampfstoff führt dazu, dass vermehrt Zellen in der S-Phase vorhanden sind, die in ihrer Sensitivität deutlich erhöht sind. Ein Zweitkontakt (z. B. mit kontaminierter Kleidung) kann die Hautschädigung deutlich verschlimmern und ist daher unbedingt zu vermeiden.
Personen, die sich in Therapie mit Zellzyklus beeinflussenden Medikamenten (z. B. Lovastatin, Hydroxyurea, Methotrexat) befinden, können im Falle einer Exposition mit alkylierenden Hautkampfstoffen besonders ausgeprägte Symptome entwickeln. Ebenso sollte eine Behandlung mit diesen Substanzen nicht unmittelbar nach Kontakt mit alkylierenden Hautkampfstoffen erfolgen.
Vor allem in den USA sorgten Erkenntnisse aus der militärischen Forschung für große Fortschritte in der Etablierung effektiver Chemotherapien [5]. Unsere Ergebnisse und die enge Verknüpfung von klinischen mit wehrmedizinischen Fragestellungen ermöglichen einen doppelten wissenschaftlichen Nutzen. Der in diesem Projekt eingeschlagene und – historisch betrachtet entgegengesetzte Weg der Lost-Forschung von der Klinik ins Repertoire der Wehrmedizin – kann auch bei zukünftigen Fragestellungen vielversprechende Erkenntnisse für die sanitätsdienstliche Versorgung liefern.
Literatur
- Kehe K, Szinicz L: Medical Aspects of sulphur mustard poisoning. Toxicology 2009; 214(3): 198 - 209.
- Krumbhaar EB, Krumbhaar HD: The blood and bone marrow in yellow cross gas (mustard gas) poisoning. Changes produced in the bone marrow of fatal cases. J. Med. Res. 1919; 40: 497508.
- Papac RJ: Origins of cancer therapy. Yale J Biol Med. 2001; 74(6): 391 - 398.
- Smith SL: War! What is it good for? Mustard gas medicine. CMAJ 2017; 189(8): E321-E322.
- Kutcher G: Contested medicine: cancer research and the military. Chicago: University of Chicago Press 2009.
Oberstabsapotheker Simon Lang
E-Mail: simon1 [email protected]
Datum: 21.02.2019