Schilddrüse und Schwangerschaft
Manuela A. Hoffmann¹,², ³, Helmut J. Wieler³, Ines Richardsen⁴, Arno Franzen⁵
Aus der Unterabteilung VI Präventivmedizin des Kommandos Sanitätsdienst der Bundeswehr¹, Koblenz (Unterabteilungsleiter: Oberstarzt Dr. T. Harbaum), dem Institut für Präventivmedizin der Bundeswehr², Andernach (Leiter: Oberstarzt Prof. Dr. Dr. D. Leyk), der Klinik für Nuklearmedizin³ (Klinischer Direktor: Oberstarzt Prof. Dr. H.J. Wieler) und der Klinik für Allgemein-, Viszeral- und Thoraxchirurgie⁴ (Klinischer Direktor: Oberstarzt Prof. Dr. R. Schwab) des Bundeswehrzentralkrankenhauses Koblenz (Kommandeurin und Ärztliche Direktorin: Generalarzt A. Nolte) sowie der Klinik für Frauenheilkunde und Geburtshilfe⁵ (Chefarzt: Dr. A. Franzen) des Gemeinschaftsklinikums Mittelrhein Kemperhof, Koblenz (Medizinischer Geschäftsführer: Dr. M. Hemicker)
Zusammenfassung
Das Thema „Einfluss der Schilddrüsenfunktion auf die Schwangerschaft“ rückt mehr und mehr in den Fokus der täglichen klinischen Betreuung, denn der Frauenanteil in der Bundeswehr ist in den letzten 20 Jahren stetig angestiegen. Evidenzbasierte Empfehlungen fehlen auf diesem Themengebiet in vielen essenziellen Bereichen. Dieser Beitrag beantwortet in einer Übersicht die zehn häufigsten Fragen in Bezug auf Schwangerschaft und Schilddrüse, stellt den aktuellen Stand der Forschung dar und gibt auf dieser Grundlage aktuelle Empfehlungen zur Diagnostik der Schilddrüsenfunktion – mit deren Einfluss auf die Schwangerschaft – und zur gegebenenfalls erforderlichen Therapie. Schlussfolgernd wird resümiert, dass weitere prospektiv randomisierte Studien folgen müssen, um die wichtigsten klinischen Fragen in Bezug auf Schwangerschaft und Schilddrüse evidenzbasiert beantworten zu können.
Schlüsselwörter: Schilddrüse, Schwangerschaft, Jodversorgung, Hypothyreose, Hyperthyreose
Keywords: Thyroid, pregnancy, Iodine deficiency, hypothyroidism, hyperthyroidism
Einleitung

Widmet man sich diesem Thema, so stellt man schnell fest, dass – ähnlich wie im Fachgebiet Kinderheilkunde und ähnlich wie bei der Frage der Pharmakotherapie bei Kindern – der evidenzbasierte Wissensstand bei vielen täglich aufkommenden Fragen ausgesprochen dürftig ist. Auch auf diesem Gebiet findet sich – wie so oft – die erstaunliche Tatsache, dass zwar ein ungeheures Maß an molekularbiologischer Forschung in Deutschland existiert, aber wesentliche klinische Grundfragestellungen nicht ausreichend beantwortet werden (können). Fragen von Schwangeren oder eine Schwangerschaft anstrebenden Patientinnen an den betreuenden Arzt – meist den Gynäkologen, aber auch sehr oft den Endokrinologen und den Nuklearmediziner – sind ausgesprochen vielfältig.
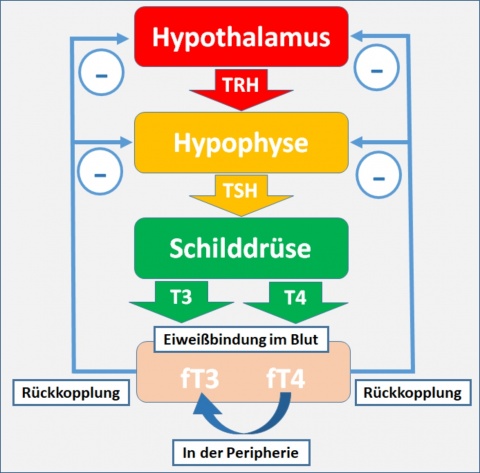
Ein weiteres erhebliches Problem ist, dass in Deutschland eine zweistellige Zahl von Testbestimmungen zur Ermittlung von fT3, fT4 und TSH-basal existiert, was bedeutet, dass noch nicht einmal Konsens über den Normbereich in der alltäglichen physiologischen (sprich Nichtschwangerschafts-) Situation besteht. Darüber hinaus sollte eigentlich jeder Mediziner, der die Schilddrüsenhormone und das TSH im Labor bestimmt – sei es in einer Praxis oder in einem Krankenhaus – idealerweise für die Diagnostik in der Schwangerschaft seine eigenen trimenonspezifischen Referenzwerte finden, die auf der Analyse von gesunden antikörpernegativen und ausreichend mit Jod versorgten Frauen basieren. Dieser theoretischen Forderung entsprechender Fachgremien (z. B. Deutsche Gesellschaft für Laboratoriumsmedizin, Deutsche Gesellschaft für Nuklearmedizin) wird jedoch in keinem Land der Erde nachgekommen. Das Ziel ist offensichtlich nicht wirklich erreichbar. Der fehlende Konsensus bzgl. der physiologischen Normwerte, der schon nicht vorhanden ist, wird durch eine noch schlechtere Datenlage bzgl. der trimenonspezifischen Normwerte weiter negativiert.
Dieser Beitrag widmet sich der Beantwortung von 10 Fragen, die nach hiesiger Erfahrung zu den häufigsten gehören, die in der täglichen Sprechstunde gestellt werden und damit auch für den „Praktiker“ im Rahmen der allgemeinmedizinischen Betreuung die höchste Relevanz aufweisen.
Bei der Beantwortung der 10 Fragen werden die Meinungen/Empfehlungen – wie dies heute auch in Leitlinien üblich ist – nach einem Score aus Empfehlungsgrad und Evidenzlevel ausgedrückt. In diesem Beitrag wurde das Scoring-System der American Thyroid Association (ATA) zur Bewertung herangezogen [1] (Tabelle 1).
Tab. 1: Empfehlungsgrad und Evidenzlevel gem. Guidelines der American Thyroid Association (ATA)
Grad der Empfehlung | Qualität der Evidenz |
Harte Empfehlung (1) | - Hohe Evidenz (a) - Moderate Evidenz (b) - Geringe Evidenz (c) |
Weiche Empfehlung (2) | - Hohe Evidenz (a) - Moderate Evidenz (b) - Geringe Evidenz (c) |
Unzureichende Datenlage, die eine Empfehlung | - Geringe Qualität - Keine Daten - Komplett widersprüchliche Daten |
Empfehlungsgrad und Evidenzlevel werden im Text in geschweiften Klammern durch Zahlen bzw. Zahlen-Buchstabenkombinationen angegeben (z. B. = Harte Empfehlung bei moderater Evidenz).
Häufige Fragen zu Schilddrüse und Schwangerschaft
Frage 1:
Hat die latente Hypothyreose einen Krankheitswert? Sollte bei Kinderwunsch ein TSH-Wert im mittleren bzw. im oberen Normbereich medikamentös behandelt werden, um die Chancen für eine Schwangerschaft zu erhöhen?
Geht man bzgl. des TSH-Spiegels von (möglichst für das eigene Labor ermittelten) oberen Grenzwerten für das erste Trimenon von 2,5 mU/l, für das zweite von 3 mU/l und für das dritte von 3,5 mU/l aus [6], so könnte man sicher intendieren, den TSH-Wert durch Thyroxin-Gabe unter 2,5 mU/l zu senken. Eine kleine Studie [18] mit lediglich 69 Frauen mit latenter Hypothyreose, die infertil waren, erbrachte nach Thyroxin-Gabe eine Schwangerschaftsrate von ca. 75 % innerhalb des ersten Therapiejahres.
Bei latenter Hypothyreose besteht eine erhöhte Rate an Fehl-geburten, Frühgeburten, intrauterinem Fruchttod (IUFT), vorzeitiger Plazentalösung, Schwangerschaftshypertonus und -Präeklampsie. Unbehandelt kann die Hypothyreose der Schwangeren beim Kind schwerwiegende neuro-kognitive Defekte verursachen.
Der TSH-Wert sollte deshalb mindestens 1 x pro Trimenon kontrolliert werden, um ggf. Mehrbedarf durch Dosissteigerungen des Thyroxins zu kompensieren .
Frage 2:
Haben Zyklusstörungen etwas mit der Schilddrüsenfunktion zu tun?
Bei manifester Hypothyreose kommt es gehäuft zu Hypermenorrhoe oder Oligomenorrhoe. Bei einer Hyperthyreose bei jüngeren Frauen im fortpflanzungsfähigen Alter, meist auf dem Boden einer Autoimmunthyreopathie Typ Morbus Basedow, sind Klagen über Polymenorrhoe und Hypomenorrhoe nicht selten. Sowohl die Hypothyreose als auch die Hyperthyreose führen basierend auf Störungen der pulsatilen GnRH-Freisetzung zu Zyklusstörungen bis hin zur Amenorrhoe, Anovulation und Lutealinsuffizienz.
Eine Abklärung der Schilddrüsenfunktionsparameter ist angezeigt . Bei einer Hyperprolaktinämie ist eine Hypothyreose auszuschließen.
Frage 3:
Welchen Effekt hat eine therapeutische Gabe von radioaktivem Jod auf nachfolgende Schwangerschaften?
Gerade diese Frage wird dem Nuklearmediziner, der – wie im Bundeswehrzentralkrankenhaus (BwZKrhs) Koblenz seit 18 Jahren – eine Therapiestation betreibt, oft gestellt. Hierbei ist zu bedenken, dass Frauen ca. 2,5 mal häufiger Schilddrüsencarcinome entwickeln als Männer [10].
Der mögliche Schädigungseffekt der Radioaktivität auf die gonadale Funktion und das Outcome nachfolgender Schwangerschaften wurde durch GARSI et al. [8] und SAWKA et al. [15] untersucht. Erstere werteten 2 673 Schwangerschaften aus, von denen 483 nach einer Radiojodtherapie eines Schilddrüsencarcinoms zustande gekommen waren. In keiner Studie wurde ein gesteigertes Risiko von Infertilität, Fehlgeburt, Totgeburten, neonataler Mortalität, congenitaler Malformation, Frühgeburt, erniedrigtem Geburtsgewicht oder Tod im ersten Lebensjahr festgestellt. Die Behandlung mit Radiojod – ja bewusst durchgeführt in endogener oder exogener Hypothyreose bei einem TSH-Wert über 30 mU/l – führt meist in den Monaten nach Durchführung zu Unregelmäßigkeiten im Zyklus. Die Wahrscheinlichkeit, schwanger zu werden, ist daher primär reduziert. Es wird empfohlen, mindestens 4 - 6 Monate nach einer Radiojodtherapie bis zu einer beabsichtigten Schwangerschaft zu warten. Dann sollte die thyreoidale Hormonsubstitution wieder stabil sein . Ein Zeitintervall von zumindest 4 Monaten bis zum Eintritt einer Schwangerschaft sollte gemäß einer Handlungsempfehlung der Deutschen Gesellschaft für Nuklearmedizin (S1-Leitlinie) gewährleistet sein. Der Nutzen eines 6-monatigen Intervalls nach Radiojod-Gabe wird auch durch eine Studie von PACINI et al. [14] unterstützt, in der der Effekt der 131-Jod-Therapie auf die Spermatogenese bei Männern untersucht wurde. Es fand sich eine dosisabhängige Steigerung der FSH-Spiegel und eine Reduktion der Zahl normokinetischer Spermien. Die Lebenszeit eines Spermiums beträgt etwa 120 Tage, sodass auch diese Zeit (4 Monate) eine Latenz bis zur Schwangerschaftsintention rechtfertigt.
Frage 4:
Wie oft muss die Schilddrüsensituation in der Schwangerschaft untersucht werden?
Die Beantwortung dieser Frage ist natürlich abhängig vom Ausgangsstatus der Patientin und von deren Vorerkrankungen bzgl. der Schilddrüse vor eingetretener Schwangerschaft.
Als Grundschema können folgende Zeiten angegeben werden:
- mindestens 1 x pro Trimenon,
- 4 - 6 Wochen nach der Konzeption, auch wenn das TSH vor der Schwangerschaft normal war,
- 4 - 6 Wochen nach Beginn einer notwendig gewordenen Thyroxin-Therapie (die 1. Kontrolle aber eher nach 4 als nach 6 Wochen) und
- 4 - 6 Wochen nach Änderung einer jeweiligen Dosis, sei die Therapie thyreostatisch (dann eher nach 4 Wochen) oder substitutiv.
Zumeist wird bzgl. einer Substitutionsdosis nach Entbindung von dem Prinzip ausgegangen, wieder die Dosis einzusetzen, die auch vor der Schwangerschaft bestand. Bei einem Teil der Frauen besteht allerdings offensichtlich über die Entbindung hinaus ein erhöhter Bedarf an Schilddrüsenhormonen [7].
Frage 5:
Muss eine Hyperthyreose in der Schwangerschaft medikamentös behandelt werden und – wenn ja – wie?
Hyperthyreosen in der Schwangerschaft sind nicht selten. Es muss allerdings herausgehoben werden, dass die deutlich häufigste Form der Hyperthyreose in der Schwangerschaft die durch humanes Choriongonadotropin (HCG) induzierte Hyperthyreose ist, von der etwa 2 - 3 % der Schwangeren betroffen sind. Die Stimulation des TSH-Rezeptors durch HCG führt meist als Nebenwirkung zu einer Suppression des TSH im Regelkreis und erzeugt damit das Bild einer latenten Hyperthyreose. Gelegentlich kann aber auch eine manifeste Hyperthyreose hervorgerufen werden. Neben den typischen klinischen Zeichen einer Hyperthyreose (wie Herzrasen, Herzrhythmusstörungen, Unruhe, Nervosität, Aggressivität, Stimmungsschwankungen, Schlafstörungen, Gewichtsverlust trotz starken Hungergefühls, Schwitzen, Haarausfall etc.) findet sich auf Grund des hohen HCG-Spiegels oft ein Schwangerschaftserbrechen (Hyperemesis gravidarum). Zur symptomatischen Behandlung des Erbrechens werden Antiemetika (Antihistaminika und Prokinetika), in Einzelfällen Beta-blocker, eingesetzt. Bei Persistenz der Hyperemesis gravidarum sollte eine Molenschwangerschaft ausgeschlossen werden. In der ganz überwiegenden Zahl der HCG-induzierten Hyperthyreosen ist eine thyreostatische Therapie nicht notwendig, da nach der 12. SSW der HCG-Spiegel wieder abfällt und sich nach der 18. SSW üblicherweise wieder normalisiert. Die latente Hyperthyreose (komplette TSH-Suppression) bedarf bei ca. 10 - 20 % der Schwangeren keiner medikamentösen Therapie.
Die „echte“ Hyperthyreose in der Schwangerschaft tritt bei lediglich 0,2 - 0,5 % der Schwangeren auf, zumeist auf der Grundlage einer Autoimmunthyreopathie Typ Morbus Basedow. Die auf der Autoimmunthyreopathie Typ Morbus Basedow beruhende manifeste Hyperthyreose soll thyreostatisch behandelt werden, da es in etwa 6 % der unbehandelten Hyperthyreosen zu Missbildungen bzw. einer Wachstumsretardierung beim Fötus kommt. Darüber hinaus besteht die Gefahr einer Präeklampsie und/oder Frühgeburt [3, 12]. Dem gegenüber ist eine mögliche Missbildungsrate durch die thyreostatische Therapie zu stellen, z. B. mit Carbimazol oder Thiamazol selbst. Hier geht man allerdings lediglich von 1 % der Fälle aus.
Die medikamentöse Therapie richtet sich nach dem Stadium der Schwangerschaft. Im ersten Trimenon ist die Gabe von Propythiouracil zu bevorzugen (3 x 25 bis 50 mg pro Tag Anfangs-dosis, 25 - 50 mg pro Tag Erhaltungsdosis), weil es unter Carbimazol bzw. Thiamazol im 1. Trimenon gehäuft zu Missbildungen wie Ösophagusatresie, Choanalatresie und Aplasia cutis kommen kann. Im 2. und 3. Trimenon hingegen soll die Therapie, wie auch beim Kind bzw. Erwachsenen, mit Carbimazol oder Thiamazol erfolgen, da es Berichte über schwere Lebererkrankungen bis zum Leberversagen unter der Gabe von Propy-thiouracil in dieser Zeit gibt. Aber auch hier gibt es erheblichen Forschungsbedarf. Das Procedere wird unterschiedlich diskutiert. Die Dosierung der Thyreostatika ist möglichst niedrig zu halten, da diese diaplazentar auf die kindliche Schilddrüse wirken. Die fT4-Werte der Mutter sollen im oberen Referenzbereich liegen .
Frage 6:
Muss man während der Schwangerschaft Jod einnehmen, auch wenn man einen Morbus Hashimoto hat?
Die beschriebene Induktion gesteigerter Antikörperaktivität durch (hohe) Jod-Gaben wird in der bestehenden Schwangerschaft durch deren immunsuppressive Eigenqualität meist unterdrückt. Die Jod-Gabe ist elementar für die Entwicklung des Kindes . Der Jodbedarf in der Schwangerschaft ist erhöht. Der Fetus kann seinen Jodbedarf nur über die Mutter decken. Die alleinige Empfehlung zur Einnahme von jodiertem Speisesalz ist unzureichend. 5 g Speisesalz (Natriumchlorid), eine erhebliche Menge an Salz, die in der Schwangerschaft sowieso nicht erwünscht ist, enthalten ca. 80 µg Jod. Die Jodversorgungssituation in Deutschland ist offensichtlich in den letzten 4 - 5 Jahren wieder schlechter geworden. Die zunehmende Zahl von (jungen) Frauen, die sich vegan ernähren, d. h. auch auf die Hauptquelle der Jodzufuhr, den Seefisch, verzichten, verschlechtert die Situation zusätzlich. Es wird daher für Schwangere (und Stillende) eine generelle Einnahme von 100 - 150 µg Jod pro Tag empfohlen, mit der möglichst schon vor der intendierten Schwangerschaft begonnen werden sollte [4], um den täglichen Bedarf von 250 µg Jod zu decken .
Frage 7:
Wenn eine Mutter eine Hyperthyreose hat, besteht dann auch die Gefahr, dass das Kind mit einer Hyperthyreose zur Welt kommt?
Die für die Autoimmunthyreopathie typischen TSH-Rezeptor--Antikörper (insbesondere der Anteil der stimulierenden TSH--Rezeptor-Antikörper) können diaplazentar auf das Neugeborene übertreten. Ca. 1 - 2 % der Neugeborenen von Müttern, die an einem Morbus Basedow erkrankt sind, entwickeln eine tran-siente neonatale Hyperthyreose. Die Mutter mit Morbus Basedow sollte darauf achten, dass vor der Geburt die TSH--Rezeptor-Antikörper erneut bestimmt werden. Es ist bei positiven TSH-Rezeptor-Antikörpern vermehrt auf klinische Zeichen einer Hyperthyreose beim Neugeborenen zu achten, wie Tachykardie, Unruhe, Hyperaktivität, unzureichende Gewichtszunahme und ggf. sogar vortretende Augäpfel (Endokrine Orbitopathie). Die neonatale manifeste Hyperthyreose kann mit Carbimazol/Thiamazol oder mit Propylthiouracil behandelt werden .
Frage 8:
Sollten Frauen mit isolierter Hypothyroxinämie während der Schwangerschaft mit L-Thyroxin behandelt werden?
Nicht selten findet man während der Schwangerschaft den Befund eines erniedrigten fT4 bei normalem fT3 und eher niedrigem bis normalem TSH. Es handelt sich hier nicht um eine Hypothyreose, wie leider häufig auf Überweisungen angegeben, sondern um eine isolierte Hypothyroxinämie. Es gibt nur zwei randomisierte, prospektive Interventionsstudien, bei denen Schwangere mit einem erniedrigten fT4 mit Thyroxin behandelt wurden [5, 11]. Beide Studien zeigten keinen positiven Effekt auf etwa die kognitive Entwicklung der Kinder bei Thyroxin--Gabe. Eine Limitation beider Studien war, dass die Therapie erst ab der 13. bis 17. Schwangerschaftswoche begann. Trotzdem bleibt es dabei, dass die Behandlung einer isolierten Hypothyroxinämie nicht empfohlen wird .
Frage 9:
Welche Substanzen des Schilddrüsenstoffwechsels gehen auf das ungeborene Kind über?
Das Wissen über diese Frage hat sich in den letzten 15 - 20 Jahren deutlich entwickelt und ist weiterhin Bestandteil der Forschung. Jod, Autoantikörper wie die thyreoidale Peroxidase (mikrosomale Antikörper) und auch der TSH-Rezeptor-Antikörper (TRAK) passieren die plazentare Schranke und gehen damit auf den Embryo/den Fetus über. Das Gleiche gilt für die Thyreostatika wie Thiamazol, Carbimazol und Propythiouracil.
Die freien Schilddrüsenhormone fT3 und fT4 gehen nur zum Teil – mit einer Rate von etwa 20 % – auf den Embryo/den Fetus über, wobei diese Rate offensichtlich sehr schwankend ist und bis zu 40 % betragen kann. Für TSH hingegen besteht praktisch kein Transfer durch die Plazenta. Erst ab der 20. Woche ist die fetale Schilddrüse auf fetales TSH responsibel.
Die fetale Schilddrüsenanlage erscheint erst in der etwa 10. bis 12. SSW. Bis zu diesem Zeitpunkt, also bis zur etwa 12. Woche, ist der Fetus komplett abhängig vom mütterlichen fT4 und der mütterlichen Jodzufuhr. Das bedeutet aber, dass die Reifung wichtiger ZNS-Strukturen in einer Zeit beginnt, in der die fetale Schilddrüse noch nicht eigenständig Hormone produzieren kann.
Empfehlenswert ist somit, bereits vor einer geplanten Schwangerschaft die Schilddrüsenfunktion zu kontrollieren und ggf. optimal einzustellen, um Schäden für die neuronale Entwicklung des Kindes zu vermeiden .
Frage 10:
Wie wahrscheinlich/häufig ist eine postpartale Thyreoiditis (PPT) und welche klinische Bedeutung hat sie?
Die Angaben zur Prävalenz der postpartalen Thyreoiditis variieren in verschiedenen Untersuchungen erheblich. Es werden Zahlen zwischen 1,1 % und 16,7 % berichtet [13]. Sicher ist, dass die klinische Situation oft nicht erkannt wird (Symptome der postpartalen Depression!) und die Häufigkeit wohl größer ist als früher angenommen. Frauen mit Autoimmunerkrankungen der Schilddrüse (Hashimoto, Basedow) haben ein erhöhtes PPT--Risiko. Darüber hinaus ist aber auch die Prävalenz der PPT bei Frauen mit Diabetes mellitus Typ I im Vergleich zu einer unselektierten Population drei- bis viermal höher [2, 9].
Der klinische Verlauf der PPT variiert erheblich [17]. Grob geschätzt präsentiert etwa die Hälfte der Fälle eine Hypothyreose, ein Viertel eine transiente Hyperthyreose, gefolgt von einer transienten Hypothyreose, die bis zum Ende des ersten postpartalen Jahres spontan wieder in eine euthyreote Situation übergeht und ein Viertel eine meist kurzzeitige isolierte Hyperthyreose. Immerhin zeigte jedoch eine prospektive Studie von STAGNARO-GREEN et al. [16], dass 50 % der Frauen, die eine PPT erlitten haben, zum Ende des ersten postpartalen Jahres hypothyreot geblieben waren. Alle Schwangeren mit einer postpartalen Depression sollten bzgl. einer thyreoidalen Dysfunktion untersucht werden . Bei Frauen mit einer symptomatischen Hypothyreose sollte eine Thyroxin-Gabe durchgeführt werden. Wenn eine asymptomatische Hypothyreose nicht therapiert wird (da man von einem transienten Geschehen ausgeht), muss der TSH-Wert alle vier Wochen ermittelt werden, bis sich die thyreoidale Funktion normalisiert. Eine Thyroxin-Substitution sollte auch bei Frauen durchgeführt werden, die eine erneute schnelle Schwangerschaft wünschen oder die ihre Babys mit der Muttermilch ernähren .
Schlussbemerkungen
Die Task Force, die die Leitlinien für die ATA bezüglich Diagnostik und Management für Schilddrüsenerkrankungen während der Schwangerschaft und für die Postpartalzeit festlegen sollte [1], zeigt sich zum Abschluss ihrer Arbeiten entsetzt -darüber, dass nur 24 % der von ihr ausgesprochenen Empfehlungen dem höchsten Level des vom American College of Phy-sicians etablierten Gradingsystems (Empfehlungsgrad/Evidenzlevel 1a) entsprachen. Daraus resultiert auch in Deutschland ein signifikanter Bedarf an Studien zur Beantwortung klinisch relevanter Fragen, wie z. B.:
- Wie sieht die tatsächliche aktuelle Jodversorgung in Deutschland aus, gerade unter Einbeziehung veränderter Ernährungsgewohnheiten (Veganer) und dem weiterhin lediglich freiwilligen Jodzusatz in Nahrungsmitteln?
- Welcher Bedarf an Jod resultiert daraus für Schwangere?
Es bedarf
- der Erhebung von Daten zur frühen Thyroxin-Gabe in der Schwangerschaft mit entweder latenter Hypothyreose oder isolierter Hypothyroxinämie, um die Effekte auf die kindliche IQ-Entwicklung abzuschätzen,
- einer umfassenden Studie zur Erfassung des Jodstatus von schwangeren und stillenden Frauen in Deutschland,
- einer Studie zu den Therapeutika, die Fragen zu deren Dosis und der Zeitdauer der Einnahme von Thyreostatika bei der Behandlung von Schwangeren mit Hyperthyreose erläutert, und
- einer Studie, die die Effekte von positiven Thyreoglobulin- und Mikrosomalen-Antikörpern auf das Outcome der Schwangerschaften untersucht.
Kernaussagen
- Schilddrüsenfunktionsstörungen kommen häufig vor, zudem besteht für sie bei Frauen eine zwei- bis dreifach höhere Prävalenz im Vergleich zu Männern.
- Die Schilddrüse und das reproduktive System der Frau interagieren auf vielfältige Weise miteinander.
- Eine manifeste Hypo- und/oder Hyperthyreose sind meist mit einer Subfertilität der Frau assoziiert.
- Für die fetale Entwicklung sind eine normale Schilddrüsenfunktion und eine ausreichende Jodversorgung der Mutter von großer Bedeutung.
- Eine Laboranalyse der Schilddrüsenparameter sowie eine Sonographie der Schilddrüse gehören zur Basisdiagnostik vor geplanter Schwangerschaft; die Notwendigkeit entsprechender Kontrolluntersuchungen ist abhängig von den erhobenen Befunden.
Literatur
- Alexander EK, Pearce EN, Brent GA et al.: 2017 Guidelines of the American Thyroid Association for the diagnosis and arrangement of thyroid disease during pregnancy and the postpartum. Thyroid 2017; 27 (3): 315 - 389.
- Alvarez-Marfany M, Roman SH, Drexler AJ, Robertson C, Stagnaro-Green A: Long-term prospective study of postpartum thyroid dysfunction in women with insulin dependent diabetes mellitus. J Clin Endocrinol Metab 1994; 79: 10 - 16.
- Andersen SL, Olsen J, Laurberg P: Foetal programming by maternal thyroid disease. Clin Endocrinol(Oxf) 2015; 83 (6): 751 - 758.
- Bundesinstitut für Risikobewertung “Ratschläge für die ärztliche Praxis: Jod, Folat/Folsäure und Schwangerschaft”, 2014.
- Casey B: Effect of treatment of maternal subclinical hypothyroidism or hypothyroxinemia on /Q in offspring [Abstract]. Available at: http://www.ajog.org/article/S0002 - 9378(15)01319 - 8/pdf (accessed 28 June 2017).
- Feldthusen AD, Pedersen PL, Larsen J et al.: Impaired fertility associated with subclinical hypothyroidism and thyroid autoimmunity: The Danish General Suburban Population Study. J Pregnancy 2015; 132718.
- Galofre C, Haber RS, Mitchell AA, Pessah R, Davies TF: Increased postpartum thyroxine replacement in Hashimoto’s thyroiditis. Thyroid 2010; 20 (8): 901 - 908.
- Garsi JP, Schlumberger M, Rubino C et al.: Therapeutic administration of 131J for differentiated thyroid cancer: radiation dose to ovaries and outcome of pregnancies. J Nucl Med 2008; 49: 845 - 852.
- Gerstein HC: Incidence of postpartum thyroid dysfunction in patients with type I diabetes mellitus. Ann Intern Med 1993; 118: 419 - 423.
- Krebs in Deutschland für 2013/2014. Zentrum für Krebsregisterdaten. Robert-Koch-Institut, Berlin 2017.
- Lazarus JH, Bertwich JP, Channon S et al.: Antenatal thyroid screening and childhood cognitive function. N Engl J Med 2012; 366: 493 - 501.
- Millar LK, Wing DA, Leung AS et al.: Low birth weight and preeclampsia in pregnancies complicated by hyperthyroidism. Obstet Gynecol 1994; 84 (6): 946 - 949.
- Nicholson WK, Robinson KA, Smallridge RC, Ladenson PW, Powe NR: Prevalence of postpartum thyroid dysfunction: a quantitative review. Thyroid 2006; 16: 573 - 582.
- Pacini F, Gasperi M, Fugazzola L et al.: Testicular function in patients with differentiated thyroid carcinoma treated with radioiodine. J Nucl Med 1994; 35: 1418 - 1422.
- Sawka AM, Lakra DC, Lea J et al.:A systematic review examining the effects of therapeutic radioactive iodine on ovarion function and future. Clin Endocrinol (Oxf) 2008; 69: 479 - 490.
- Stagnaro-Green A, Schwartz A, Gismondi R et al.: High rate of persistent hypothyroidism in a large-scale prospective study of postpartum thyroiditis in southern Italy. J Clin Endocrinol Metab 2011; 96: 652 - 657.
- Stagnaro-Green A: Approach the patient with postpartum thyroiditis. J Clin Endocrinol Metab 2012; 97: 334 - 342.
- Yoshioka W, Amino N, Ide A et al.: Thyroxine treatment may be useful for subclinical hypothyroidism in patients with female infertility. Endocr J 2015; 62 (1): 87 - 92.
Für die Verfasser:
Oberfeldarzt Dr. med. Manuela A. Hoffmann
Kommando Sanitätsdienst der Bundeswehr, Koblenz
Institut für Präventivmedizin der Bundeswehr, Andernach
E-Mail: [email protected]
Datum: 04.01.2019