Giant Prostatic Hyperplasia als Zufallsbefund und damit verbundene Komplikationen in der operativen Therapie
Aus der Abteilung XI – Urologie – (Abteilungsleiter: Oberstarzt Dr. H. Heidenreich) des Bundeswehrkrankenhauses Berlin (Chefarzt: -Admiralarzt Dr. K. Reuter)
Zusammenfassung
Bei bis zu 90 % der europäischen Männer im höheren Lebensalter (> 80 Jahre) besteht eine benigne Prostatahyperplasie, die auch schon bei bis zu 40 % im Alter von 40 - 49 Jahren auftritt und zu Beschwerden des unteren Harntrakts führen kann. In Einzelfällen kann die Vorsteherdrüse dabei so massiv hyperplasieren, dass Prostatavolumina von mehr als 500 ml entstehen (sogenannte Giant Prostatic Hyperplasia (GPH)). Wir stellen am Beispiel eines 81-jährigen Patienten, der wegen einer durch Verletzung mit einem Harn-blasenkatheter verursachten Blutung notfallmäßig offen prostatektomiert werden musste, das Krankheitsbild der GPH mit den damit verbundenen Risiken vor und erörtern die Kriterien zur Wahl der richtigen Operationsmethode.
Schlagwörter: Prostatahyperplasie, Operationsmethoden, Kom-plikationen, giant prostatic hyperplasia, Blutverlust
Keywords: Prostatic hyperplasia, surgical procedures, complications, giant prostatic hyperplasia, blood loss
Einleitung
Die benigne Prostatahyperplasie ist ein Phänomen, welches in Europa je nach Lebensalter zwischen 40 % und bis zu 90 % aller Männer betrifft. Die gutartige Vermehrung der Prostatazellen beginnt nach dem 30. Lebensjahr und nimmt danach immer mehr zu. Dies führt bei einem großen Prozentsatz der Betroffenen zu Beschwerden des unteren Harntrakts (englisch: lower urinary tract symptoms (LUTS)). Dazu zählen verstärkter Harndrang, verzögert einsetzende Miktion trotz starken Harndrangs, schwacher Harnstrahl, Pressmiktion, verlängerte Miktionszeit sowie Restharnempfinden und nachtröpfelnder Urin. Die Prävalenz der benignen Prostatahyperplasie mit LUTS steigt mit dem Alter an und betrifft 40 % der 40 - 49 Jahre alten Männer, 70 % der 60 - 69-jährigen und bis zu 90 % der Männer im Alter von 80 - 89 Jahren [5, 24].
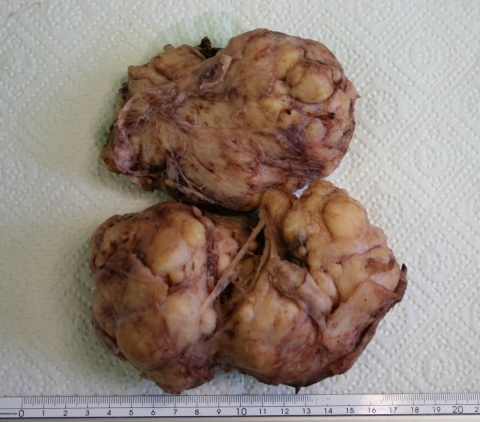
Ein Drüsenvolumen von >25 ml definiert die Prostatahyperplasie. Als Giant Prostatic Hyperplasia (GPH) wird dabei eine massive Hyperplasie von über 500 ml bezeichnet. Das Ausmaß der LUTS korreliert nicht fest mit der Drüsengröße. Dies trifft selbst für Drüsenvolumina von >500 cm3 zu; DOMINGEZ et al. berichteten 2016 über einen Patienten mit einem im MRT gemessenen Drüsenvolumen von 3987 ml bei nur gering ausgeprägten LUTS [7]. GPH ist eine Rarität; weltweit sind nur wenige Fälle von operativ entfernten GPH publiziert worden.
Die folgende Falldarstellung zeigt, dass auch eine enorm vergrößerte Prostata als klinischer Zufallsbefund in Erscheinung treten kann.
Fallbericht
Anamnese
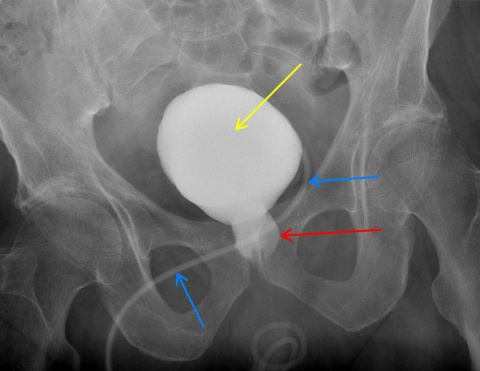
Ein 81-jähriger Patient stellte sich wegen progredienter Luftnot unter Belastung, Unterschenkelödemen sowie Gehstreckenverkürzung in der Notaufnahme des Bundeswehrkrankenhauses (BwKrhs) Berlin vor. Klinisch lag nach ausführlicher Anamnese und Untersuchung eine Herzinsuffizienz Stadium NYHA[1] III vor. Eine Herzrhythmusstörung lag anamnestisch nicht vor, eine kardiologische Abklärung war noch nie erfolgt. Zum Zeitpunkt der Untersuchung bestand ein normofrequent übergeleitetes Vorhofflimmern. Die ambulante bisherige Medikation umfasste Antihypertonika, L-Thyroxin bei Hypothyreose sowie Tamsulosin wegen einer langjährig vorbekannten benignen Prostatahyperplasie (BPH).Unter dem klinischen Bild einer dekompensierten Herzinsuffizienz wurden Diuretika intravenös appliziert. Zur Bilanzierung wurde ein transurethraler Katheter eingelegt, der zunächst nur wenig blutiges Sekret förderte. Als im weiteren Verlauf die Fördermenge sistierte, konnte in der daraufhin durchgeführten Sonographie der Katheterballon nicht in der Blase dargestellt werden; es fand sich jedoch eine große Raumforderung, die zunächst als Blasentamponade interpretiert wurde und die sonographische Volumetrie der Prostata erheblich erschwerte. Digital-rektal tastete sich die Prostata massiv vergrößert. Der einliegende transurethrale Katheter wurde gegen einen Char. 22 Spülkatheter gewechselt und die manuelle Ausräumung von Blutkoageln begonnen. Als dies bei anhaltender Blutung nur unzureichend gelang, bestand die Indikation zur notfallmäßigen, endoskopischen Tamponadenausräumung und Blutstillung.
Operativer Verlauf
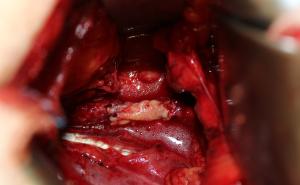
Routinemäßig erfolgte die Einlage einer Char. 12 Epizystostomie[2], transurethral wurde ein Char. 24 Spülkatheter eingelegt und mit 130 ml in der Enukleationshöhle/Prostataloge geblockt. Die Blase wurde anschließend zweischichtig verschlossen.
Aufgrund der kardialen Kompromittierung wurde der Patient auf die Intensivstation verlegt. Dort gestaltete sich der postoperative Verlauf zunächst bei laufender Blasenspülung komplikationslos. Im weiteren Verlauf sistierte die Fördermenge aus dem transurethralen Katheter und die Spülung kam zum Stillstand. Manipulationen am Katheter zur Lageänderung und Anspülversuche verliefen frustran, so dass eine operative Revision erforderlich wurde. Hierbei zeigte sich, dass die Spitze des transurethral eingelegten Katheters in die Enukleationshöhle/Prostataloge disloziert war und somit die Harnblase nicht mehr drainierte. Angesichts der großen Enukleationshöhle drohte eine erneute Diskozierung der Katheterspitze aus der Blase dorthin. Als „Problemlösung“ wurde die Char. 12 Epizystostomie gegen einen Char. 22 Katheter ausgetauscht, die Katheterspitzen mittels Naht mit resorbierbarem Material miteinander verbunden und so ihr Verbleib in der Blase sichergestellt. Der Blasenhals wurde auf den Durchmesser des einliegenden Katheters eingeengt. So zeigte sich unter fortlaufender Blasenspülung eine suffiziente Hämostase, nachdem die Enukleationshöhle mit Blutkoageln austamponiert war. Weitere Revisionseingriffe waren danach nicht mehr erforderlich. Der Patient wurde aufgrund der bestehenden dekompensierten Herzinsuffizienz und stattgehabten Massentransfusion von 18 Erythrozytenkonzentraten sowie Fresh Frozen Plasma (FFP) und Thrombozytenkonzentraten prolongiert intensivmedizinisch behandelt.
Postoperativer Verlauf
Nach Entlassung aus unserer stationären Behandlung unterzog sich der Patient einer Rehabilitationsmaßnahme und stellte sich schlussendlich 4 Monate nach dem Eingriff zur abschließenden Kontrolluntersuchung vor. Die zu diesem Zeitpunkt angefertigte Zystographie zeigte eine mittlerweile deutlich geschrumpfte Enukleationshöhle/Prostataloge (Vorblase). Der Patient konnte seine Blase spontan und restharnfrei entleeren – eine Inkontinenz bestand nicht. Aufgrund dieses sehr erfreulichen Befundes konnte die Epizystostomie entfernt werden.
Diskussion
Vorsteherdrüsen von >500 g Gewicht im Sinne einer GPH sind eine Rarität. Diese können – anders als vielleicht erwartet – mit einer relativen Symptomarmut einhergehen. Der fehlplatzierte transurethrale Katheter machte in diesem Fall bei einem sonst beschwerdefreien Patienten eine notfallmäßige Prostataadenom-Enukleation notwendig.
Tab. 1: Auswahl von Berichten zu operierten Fällen von GPH seit 1920, absteigend sortiert nach Adenomgewicht
| Autor [Quelle] | Gewicht in g | Jahr | Status |
| Medina Perez et al. [15] | 2410 | 1997 | Überleben nicht erwähnt |
| Tolley et al. [221] | 1058 | 1987 | genesen |
| Ockerblad [18] | 820 | 1946 | verstorben |
| Appiah et al. [2] | 800 | 2014 | genesen |
| Maliakal et al. [14] | 740 | 2014 | genesen |
| Oktay et al. [19] | 734 | 2011 | genesen |
| Nelson [17] | 720 | 1940 | verstorben |
| Wroclawski et al [25] | 720 | 2015 | genesen |
| Gilbert [9] | 713 | 1939 | verstorben |
| Wadstein [23] | 705 | 1938 | genesen |
| Lantzius-Beninga [13] | 705 | 1966 | genesen |
| Khan et al. [11] | 700 | 2014 | genesen |
| Ashamalla und Ahmed [3] | 695 | 1972 | genesen |
| Thomson-Walker [21 | 680 | 1920 | genesen |
| Yilmaz et al. [26] | 610 | 2004 | genesen |
| Bacon [4] | 602 | 1949 | genesen |
| De Silva-Gutiérrez et al. [6] | 600 | 2010 | genesen |
| Middleton [16] | 557 | 1937 | genesen |
| Kitagawa et al. [16] | 535 | 1980 | genesen |
| Fishman und Merrill [8] | 523 | 1993 | genesen |
| Aktueller Fall | 526 | 2016 | genesen |
| Sood et al. [20] | 522 | 2006 | genesen |
| Akpo und Akpo [1] | 510 | 2010 | genesen |
| Hosseini und Safarinejad [10] | 508 | 2004 | genesen |
Bei Prostatektomien wird bis zu einem Volumen von etwa 80 ml primär ein transurethrales Vorgehen bei der operativen Sanierung propagiert. Mittels eines transurethral eingelegten Katheters wird dabei versucht, Blutungsquellen in der entstandenen Wundhöhle zu komprimieren. Bei großvolumigen Vorsteherdrüsen wird häufig eine offene Adenomenukleation angestrebt, ggf. auch unter Einsatz von Operationsrobotern wie dem DaVinci®-System.
Problem: Große Enukleationshöhle
Eine offene Adenomenukleation ohne genaue Kenntnis der Prostatagröße – wenn z. B. eine sonographische Abgrenzung und Größenermittlung wie in unserem Fall nicht möglich ist – kann den Operateur vor eine große Herausforderung stellen. Die meisten in der Urologie verwendeten Spülkatheter sind bis zu einem Volumen von maximal 120 ml zu blocken, weshalb eine suffiziente Kompression der Enukleationshöhle/Prostataloge durch den Katheterballon bei einer Prostatagröße von mehr als 120 g (~ 120 ml) nicht mehr möglich ist. Damit wird das Erreichen einer Hämostase zur Herausforderung.
Größere Enukleationshöhlen können durch Raffnähte verkleinert werden. Bei einem ausgeprägten Missverhältnis zwischen Enukleationshöhle/Prostataloge und maximalem Ballonvolumen erreichen aber auch diese Raffnähte ihre Grenzen.
Im beschriebenen Fall spielte das erwähnte Missverhältnis eine große Rolle. Auch konnte die korrekte Lage des eingelegten trans-urethralen Katheters nicht sichergestellt werden. Dieser war postoperativ in der Enukleationshöhle/Prostataloge „verschwunden“ und konnte im Rahmen der Revisionsoperation nur mittels Fixierungsnähten zum suprapubischen Katheter, Raffnähten und bis auf den Durchmesser des transurethralen Katheters einengenden Nähten am Blasenhals in der Harnblase fixiert werden.
Herausforderung: Blutstillung
Bei der Entfernung großer Adenome haben zur Minimierung größerer Blutverluste verschiedenen Operationstechniken -bereits Anwendung gefunden. Dazu gehören u. a. auch das -„Packing“ der Enukleationshöhle/Prostataloge, das temporäre Abklemmen der Aa. iliacae internae sowie Raffnähte innerhalb der Enukleationshöhle/Prostataloge; letztere gehören zu den Standardtechniken zu deren Größenverringerung.
MALIAKAL et al. verwendeten zudem Tabaksbeutelnähte im Bereich des Blasenhalses, um diesen einzuengen. Diese begrenzen die Blutung auf ein Austamponieren der Enukleationshöhle [14]. Mit dieser Technik ist jedoch ein erhöhtes Risiko einer Blasenhalssklerose verbunden, die eine weitere Operation zu deren Beseitigung notwendig macht.
Um in diesem Fall eine suffiziente Hämostase und Spülung der Harnblase zu erreichen, entschlossen wir uns – nach bereits erfolgten Raffnähten zur Verkleinerung der Enukleationshöhle/Prostataloge – im Rahmen der Revision für Tabaksbeutelnähte am Blasenhals sowie zur Fixierung der Katheterspitze am suprapubischen Katheter. Somit konnte eine ausreichende Kompression bestehender Blutungsquellen in der Enukleationshöhle/Prostataloge und die suffiziente Blasenspülung erreicht und ein „Verschwinden“ der Katheterspitze in die Prostataloge vermieden werden.
Schlussfolgernd ist festzuhalten, dass die Verwendung von Raffnähten im Bereich der Enukleationshöhle/Prostataloge bei einem Adenomgewicht von über 120 g entscheidende Bedeutung für die Hämostase und damit für einen unkomplizierten postoperativen Verlauf hat.
Kernaussagen / Fazit
- Die Giant Prostatic Hyperplasia (GPH) ist eine absolute Rarität.
- Die operative Therapie dieser ist mit einer Vielzahl von Komplikationen verbunden, allen voran der mögliche große Blutverlust.
- Mithilfe der Wahl der korrekten Operationsmethode kann die Komplikationsrate deutlich gesenkt und somit ein positives Outcome für den Patienten erreicht werden.
- In dem hier geschilderten Fall konnte ein Adenom von 528 g erfolgreich entfernt werden.
Literatur
Akpo E, Akpo M: Giant Benign Prostatic Hyperplasia In A Nigerian: Report of a Case. The Internet Journal of Urology 2010; Volume 8: Number 1.
Appiah et al.: Giant Benign Prostatic Hyperplasia in a Ghanaian. Journal of Medical and Biomedical Sciences 2014; 3(2): 14 - 17
Ashamalla GR, Ahmed AM: Giant prostatic hypertrophy. Arch Surg 1972; 105: 769 - 770.
Bacon SK: Retropubic prostatectomy: early technical difficulties, report of removel of giant prostate. J Urol 1949; 61:571 - 574.
Berges R: Epidemiologie des benignen Prostatasyndroms. Assoziierte Risiken und Versorgungsdaten bei deutschen Männern über 50. Urologe 2008; 141 - 148
De Silva-Gutiérrez et al.: Giant prostatic hyperplasia. A case report and literature review. Rev Mex Urol 2010; 70(3): 183 - 186.
Dominges A, Muñoz-Rodriguez J, Abad C, Garcia-Roja D, Hannaoui N, Prats J: Giant Prostatic Hyperplasia: Case Report of 3987 mL. Urology 2016; 88: e3 - 4.
Fishman JR, Merrill DC: A case of giant prostatic hyperplasia. Urology 1993; 42: 336 - 337.
Gilbert JB: One-stage suprapubic prostatectomy for a gland weighing 713 grams (one and one-half pounds). Urol Cutan Rev 1939; 43:309 - 10.
Hosseini SY1, Safarinejad MR: Huge benign prostatic hyperplasia. Urol JUNRC/IUA 2004;1(4):276 - 277.
Khan et al.: Giant Benign Prostatic Hyperplasia in a Pakistani Patient. Urology Case Reports 2 (2014) 33e34.
Kitagawa R, Kano S, Nishiura H, Ogawa K, Takahashi S, Yazaki T, Ishikawa S: The largest BPH in Japan. Case report and review of the literature. Rinsho Hinyokikan 1980; 34:467 - 471.
Lantzius Beninga F: Prostate of world record size. J Urol Nephrol 1966;59:77 - 79.
Maliakal J, Moussa EE, Menon V: Giant Prostate Hyperplasia. Med J 2014; Vol. 14, ISS. 2, PP e253 - 256, EPUB. 7th 04/14.
Medina PM, Valero PJ, Valpuesta FI: Giant hypertrophy of the prostate: 2410 grams of weight and 24 cm in diameter. Arch Esp Urol 1997; 50:79 - 97.
Middleton RP: How large is the hyperplastic prostate? Report of the largest hypertrophied prostate ever surgically removed. JAMA 1937; 108:1967 - 1968.
Nelson OA: Largest recorded prostate. Urol Cutan Rev 1940; 44:454 - 455.
Ockerblad NF: Giant prostate: The largest recorded. J Urol 1946; 56:81 - 82.
Oktay U: Giant Prostatic Hyperplasia:Case report and literature review. Dicle Med J 2011; 38 (4): 489 - 491
Sood et al.: Giant Prostatic Hyperplasia: Surgical management of a case. J Postgrad Med September 2006; Vol 52, Issue 3
Thomson Walker JW: Haemorrhage and postoperative obstruction in suprapubic prostatectomy: and an open operation for their prevention. Br J Surg 1920; 7:525 - 536.
Tolley DA, English PJ, Grigor KM: Massive benign prostatic hyperplasia. J R Soc Med 1987; 80:777 - 778.
Wadstein T: The largest surgically removed hypertrophied prostate. JAMA 1938; 110:509.
Wie JT, Calhoun E, Jacobsen SJ: Urologic diseases in America project: benign prostatic hyperplasia. J Urol 2005, 173: 1256 - 1261.
Wroclawski et al.: Giant prostatic hyperplasia: report of a previously asymptomatic man presenting with gross hematuria and hypovolemic shock. einstein 2015;13(3):420 - 422.
Yilmaz K1, Istanbulluoglu O, Guven S, Kilinc M: Giant prostatic hyperplasia:case report. Int Urol Nephrol 2006; 38:587 - 589.
Bildquellen:
Abb. 1: Gemeinschaftspraxis Pathologie, Dr. Ellen Fietze, Dr. Stefan Berger, Dr. Jörg Linke am BwKrhs Berlin,
Abb. 2: BwKrhs Berlin, Abteilung für Radiologie
Für die Verfasser:
Oberfeldarzt Jürgen Stein
Abteilung Urologie
Scharnhorststraße 13, 10115 Berlin
E-Mail: Jü[email protected]
[1] NYHA: New York Heart Association; Klassifikationsschema zur Einteilung der Herzinsuffizienz in bestimmte Stadien.
[2] Epizystostomie = Urinableitung über einen von der Blase durch die Bauchdecke gehenden Katheter (suprapubischer Blasenkatheter)
Datum: 29.08.2017
Quelle:
Wehrmedizinische Monatsschrift 2017/8
Wehrmedizinische Monatsschrift 2017/8