FOURNISCHE GANGRÄN – GESTERN UND HEUTE
Fournier Gangrene – Yesterday and Today
Aus der Abteilung XI – Urologie (Leitender Arzt: Oberstarzt Prof. Dr. H.U. Schmelz) des Bundeswehrzentralkrankenhauses Koblenz (Chefarzt: Generalarzt Dr. M. Zallet)
Nina Sinthofen, Hans U. Schmelz
WMM, 58. Jahrgang (Ausgabe 3/2014; S. 91-94)
Zusammenfassung
Schon früh in der Geschichte der Medizin tauchten Fälle einer idiopathisch entstandenen, fulminanten Gangrän des Genitales auf. Inzwischen meist nicht mehr idiopathisch, geht die Fourniersche Erkrankung trotzdem noch immer mit hohen Mortalitätsraten einher.
Grundlage ist ein Synergismus aus vorbestehenden Komorbiditäten und einem idealen Nährboden für den Bakterienzellzyklus. Wegen des raschen Fortschreitens ist eine sofortige chirurgische Intervention zusammen mit einer frühzeitigen antimikrobiellen Behandlung und intensivmedizinischer Therapie für das Outcome essenziell.
Schlagworte: Fourniersche Gangrän, Nekrotisierende Fasciitis, Sepsis
Summary
Already in ancient medical history, cases describing an idiopathic, fulminate gangrene of the genitalia can be found. By now, idiopathic cases have become rare, but mortality is still high. Patients with medical predisposition are a perfect host for an uninterrupted bacterial cell cycle. Due to its rapid progress immediate surgical therapy in combination with antibiotics and intensive care is necessary to prevent further necrosis.
Keywords: Fournier gangrene, necrotizing fasciitis, sepsis
Einleitung und Definition
Im Allgemeinen gilt der französische Professor für Dermatologie und Venerologie, Jean Alfred Fournier (1832 - 1914), als Namensgeber des Morbus Fournier. Dabei lag sein Forschungs- und Interessenschwerpunkt eher auf dem damals ergiebigen Gebiet der syphilitischen Erkrankungen. Doch auch andere Forscher hatten sich schon vor Fourniers Zeit mit diesem Thema beschäftigt und dazu Überlegungen angestellt: Im Jahre 1764 beschrieb bereits Baurienne [1] ein ähnliches Krankheitsbild [2], noch viel früher sind im „Kanon der Medizin“ des persischen Arztes und Gelehrten Avicienna, der im 10. Jahrhundert wirkte, Symptome und Therapie im Ansatz erwähnt. Herodes der Große ist ein berühmtes Beispiel, von dem manch einer vermutet, dass er im Jahre 4 v. Chr. an einer Fournierschen Gangrän verstorben sei [4].
Als Jean Alfred Fournier 1883 seinen Artikel „Gangrene foudroyante de la verge“ [5] (zu Deutsch: Fulminantes Gangrän des männlichen Gliedes) veröffentlichte, postulierte er drei Hauptaspekte:
(1) Plötzlicher Beginn bei bis dahin gesunden jungen Männer mit einer (2) raschen Progression zum voranschreitenden Gangrän, (3) ohne dass eine definitive Ursache der Erkrankung ausgemacht werden konnte.
Eben dieser letzte Aspekt markierte den entscheidenden Unterschied zu den bis dahin beschriebenen Fällen: Es konnte keine Ursache gefunden werden. Bei dem von Baurienne beschriebenen Fall war wohl eine Verletzung, verursacht durch die Hörner eines Rindes, Grund für die Entwicklung der Gangrän. Hinsichtlich der idiopathischen Entstehung ist also Alfred Fournier tatsächlich Erstbeschreiber.
Immer wieder ist die Begrifflichkeit der Fournierschen Gangrän und ihre Definition von 1883 neu diskutiert worden. Zum Zeitpunkt der Erstbeschreibung konnte keine Ursache der Infektion gefunden werden – inzwischen rund 130 Jahre später sind Forschung und Methodik jedoch deutlich weiter gekommen und damit Verläufe unklarer Genese äußerst rar. Um allen Aspekten und Erkenntnissen unserer Zeit gerecht zu werden, sind verschiedenste Klassifikationen erstellt und wieder verworfen worden, damit der Begriff der Fournierschen Gangrän in den heutigen Kontext korrekt eingliedert werden kann; zum Beispiel die Einteilung in primäre und sekundäre Formen der Infektion [6], wobei die Bezeichnung „primär“ einem idiopathischen Auftreten vorbehalten sein sollte. Der Hauptstreitpunkt dreht sich immer wieder um die obligate Anwesenheit – oder eben auch Abwesenheit – einer Infektion zum Zeitpunkt der Gangränentstehung.
Inzwischen wird eine Infektion als Grundlage der Gangrän als ausnahmslos präsent angenommen [7], sodass einige Autoren fordern, auf den Begriff der Fournierschen Gangrän gänzlich zu verzichten und stattdessen von einer „infektiösen Gangrän der Genitalien“ zu sprechen [8]. Im klinischen Alltag ist der Begriff jedoch fest verwurzelt, sodass heute meist – wie auch in der Literatur – ein Morbus Fournier als Sonderform der infektiösen, nekrotisierenden Fasciitis in den perinealen, perianalen und skrotalen Regionen definiert wird.
Klinik und Diagnose
Grundsätzlich kann die Gangrän bei Männern wie auch Frauen und Kindern auftreten, wobei das Verhältnis eindeutig zu Ungunsten der männlichen Bevölkerung gewichtet ist, nämlich 10:1 [9]. Die Inzidenz ist gering, sie beträgt ungefähr 1,6 Fälle pro 100 000 Männer pro Jahr. In einer großen Studie wird von einer Mortalitätsrate von 16 % berichtet.
Die Diagnose wird klassischerweise klinisch gestellt, die Erkrankung sollte durch einen erfahrenen Kliniker frühzeitig erkannt und sofort therapiert werden. Es zeigt sich das Bild einer fulminanten Nekrose mit einhergehender Sepsis; häufig beginnend mit einer nur kleinen Hautläsion, schreitet die Gangrän oft innerhalb weniger Stunden fort, die Nekrose demarkiert sich zunehmend, erst rötlich-livide, dann fast schwarz. In bis zu 40 % der Fälle zeigt sich der Verlauf allerdings auch larviert, sodass umso mehr eine intensive Beobachtung des Patienten wichtig ist. Es kommt lokal zum Ödem, Indurationen, Krepitationen, Schmerzen und einem oft stark beißenden Geruch. Begleitend zeigen sich Fieber, Schüttelfrost und hohe Entzündungsparameter im Labor; kurzum: Es kommt zu Zeichen einer schweren systemischen Erkrankung oder Sepsis.
Hilfreich können röntgenologische Verfahren sein, um zum Beispiel subkutane Lufteinschlüsse oder Abszedierungen als Hinweis auf Infektherde zu entdecken.
Nach initialer Behandlung ist es wichtig, die Ursachen der Gangrän aufzudecken und auszuschalten.
Ätiologie
Als Riskofaktoren für die Entstehung einer Fournierschen Gangrän kann man einerseits systemische und andererseits lokale Prozesse ausmachen. Begünstigende systemische Grunderkrankungen sind vor allem Diabetes mellitus und Alkoholismus, welche bei bis zu 20 - 70 % respektive 20 - 50 % [10] der Patienten mit Gangrän vorliegen. Andere sind Leukämien, maligne Erkrankungen, chronischer Steroidmissbrauch, Unterernährung und HIV-Infektionen. Gerade Letztere ist seit den 90er Jahren auf dem Vormarsch und Ursache einer signifikant höheren Prävalenz der Gangrän in den afrikanischen Ländern [11]. Als gemeinsames Merkmal kann man eine gestörte zelluläre Abwehr zugrunde legen.
Lokale Eintrittspforten sind in absteigender Häufigkeit die Haut, der Gastrointestinaltrakt und der Genital- und Harntrakt. Insbesondere nach Eingriffen, Verletzungen und Erkrankungen, wie zum Beispiel in einzelnen Fällen nach Vasektomie [12, 13], bei renalen oder rektalen Abszessen, Harnröhrensteinen und -strikturen mit Extravasation sowie bei rupturierten Appendices, Divertikulitis und Kolonkarzinomen kann es zu einer Fournierschen Gangrän kommen.
Pathomechanismus
Ist es zum Eintritt von Erregern gekommen, entwickelt sich (vom Eintrittsort aus) eine sich selbst unterhaltende Kaskade. Meist handelt es sich in den gewonnenen Proben um Mischkulturen aus aeroben und anaeroben Kommensalen wie Clostridien, Klebsiellen, Streptokokken, Coliformen und Staphylokokken. Im Sinne des Synergismus produziert ein Bakterium die Grundlage für das nächste, welches wiederum Leukozytentoxine ausscheidet und somit die weitere Vermehrung der Bakterien unterstützt. Durch Aerobier und deren Verbrauch von Sauerstoff wird der Nährboden für anaerobe Keime geschaffen. Eine Endarteriitis obliterans führt zu Gefäßthromben kleinerer Haut- und Subcutangefäße und damit zur Nekrose. Es kommt zum Erliegen der natürlichen Zirkulation. So wird unter anderem die weitere Einwanderung und Funktionsfähigkeit der Leukozyten gestoppt, so dass sich Bakterien in diesem idealen Medium ungehindert ihrem Zellzyklus „widmen“ können [14, 15]. Es entwickelt sich also ein circulus vitiosus, der sich auch durch die lokale Hypoxie potenziert. Die Hautnekrose schreitet durch Ischämie und durch synergistische Effekte der Bakterienflora rasch fort, obwohl es sich in der Regel um Erreger mit niedriger Virulenz handelt. Es wird vermutet, dass das Zusammenspiel von Primäraffekt, Wirtsimmunität und Erregerspektrum zu Infektionen dieses Ausmaßes führt [7].
Therapie
Das Behandlungsmantra lautet nach wie vor: Frühzeitiges, radikal chirurgisches Debridement mit antibiotischer Breitspektrumtherapie unter intensivmedizinischer Versorgung.
Eine chirurgische Intervention sollte innerhalb der ersten 24 Stunden erfolgen [16], weil dadurch die die Überlebenschancen signifikant verbessert werden. Intraoperativ zeigt sich oft eine bis zur darunterliegenden Faszie reichende Nekrose; seltener ist die Muskulatur und nur sehr selten sind die Testes mitbetroffen. Häufig ist das Ausmaß der Nekrose allerdings weitreichender als es äußerlich erscheint. Initial wird eine Breitspektrumantibiose in Form einer Tripleantibiose, die gegen Anaerobier, Streptokokken, Staphylokokken und coliforme Bakterien wirksam ist, empfohlen. Bei Erhalt der Kulturen aus Blut und Abstrichen kann diese resistenzgerecht umgestellt werden.
Die nekrotisierende Fasciitis ist, laut Verband deutscher Druckkammer-Zentren, eine Indikation mit dringender Empfehlung zur adjuvanten hyperbaren Sauerstofftherapie. Wirkmechanismus ist eine Reduktion der hypoxischen Dysfunktion der Leukozyten, eine direkte Inhibition anaerober Keime und eine verbesserte Penetration des Antibiotikums in Bakterienzellen. In den Leitlinien der European Association of Urology (EAU) ist die Anwendung jedoch umstritten und einer Therapie im Rahmen von Studien vorbehalten. Hinzu kommt die eingeschränkte Verfügbarkeit von Druckkammern in Deutschland.
Fallbeispiel aus der Klinik: Fourniersches Gangrän nach Inkontinenzband-Implantation
Ein 67-jähriger Patient stellt sich mit Fieber bis 38,8 °C und Schüttelfrost in unserer Notaufnahme vor. Noch am Morgen ist er aus der stationären Behandlung bei Wohlbefinden entlassen worden, nachdem fünf Tage zuvor ein transobturatorisches Inkontinenzband implantiert worden war. Aus der Vorgeschichte des Patienten ist ein Diabetes mellitus Typ II bekannt. Nach einer Prostatastanzbiopsie zwei Jahre zuvor kam es zum septischen Infektgeschehen. Ansonsten sind keine, das Immunsystem kompromittierenden Krankheiten bekannt, immunmodulatorischer Medikamente werden nicht eingenommen.
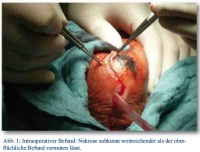
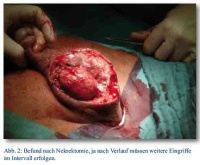
Bei Aufnahme zeigt sich die perineale Narbe reizfrei, der Hoden nach OP mit Hämatom, in der Sonographie ein leichtes peritestikuläres Ödem, sonst unauffällig. Es besteht eine Leukozytose von 17,6*10³/ul und ein CRP von 17,05 mg/dl. Der Urinstatus ist negativ. Trotz Antibiose mit zunächst Cefuroxim, dann Eskalation auf Levofloxacin, steigen die Entzündungsparameter. Die Computertomographie zeigt keinen pathologischen Befund. Die Blutkulturen bleiben zunächst ohne Befund. Innerhalb eines Tages zeigt sich dann eine Zunahme des Skrotalödems, die Skrotalhaut ist fortschreitend livide verfärbt und beginnend nekrotisch, sodass die Indikation zur sofortigen Nekrektomie gestellt wird. Nach radikalem Debridement des nekrotischen Gewebes liegen beide Hoden in ihren Hüllen, die Peniswurzel mit Harnröhre und der anale Schließmuskel frei (Abb. 1 und 2); intraoperativ wird der Patient katecholaminpflichtig, sodass postoperativ eine intensivmedizinische Versorgung notwendig ist. Die intraoperativ gewonnenen Wundabstriche zeigen koagulase-negative Staphylokokken, u. a. Staph. epidermidis, Enterococcus faecium, sowie als Anaerobier Bacteroides capillosus. Die bis dahin mit Meronem und Metronidazol durchgeführte Antibiose wird resistenzgerecht umgestellt. Auch eine Blutkultur zeigt nun ein Erregerreservoir von Streptokokken und Staphylokokken. Nach Debridement normalisieren sich die Laborparameter rasch, der Patient kann vier Tage später extubiert werden, am sechsten postoperativen Tag erfolgt die Verlegung auf die Normalstation. Während des Intensivaufenthaltes erfolgte die Transfusion von einem Erythrozytenkonzentrat und vier FFPs.
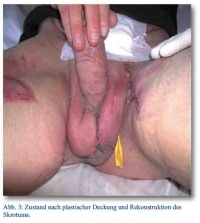
Insgesamt erstreckte sich der stationäre Aufenthalt über 76 Tage; es erfolgte eine einmalige Skrot- und Nekrektomie, eine Schwenklappenplastik und mehrere Spalt- und Vollhauttransplantate. Eine zeitweilige Verlagerung der Hoden unter die Oberschenkelinnenhaut war vonnöten, die Rückverlagerung und plastische Rekonstruktion des Skrotums erfolgte vier Monate später (Abb. 3).
Der Patient ist inzwischen funktionell voll rehabilitiert und mit einem artifiziellen Sphinktersystem versorgt.
Fazit
Alte Infektionsquellen zu Zeiten von Baurienne und Fournier verlieren zunehmend an Stellenwert; steigend sind allerdings andere Risikofaktoren durch die Überalterung und Multimorbidität der Bevölkerung. Nicht zu vergessen sind auch die immer noch hohen Raten an HIV-Infizierten auf dem afrikanischen Kontinent. Wichtig ist es, auch larvierte Verläufe und Fälle bei Frauen und Kindern nicht zu übersehen. Eine schnell fortschreitende Nekrose verbunden mit einem septischen Krankheitsbild sollte jeden Kliniker an eine Fourniersche Gangrän denken lassen.
Literaturverzeichnis
- Baurienne H. Sur une plaie contuse qui s’est terminée par le sphacele de le scrotum. J Med Chir Pharm 1764; 20: 251-6.
- Medina Polo J, Gonzalez-Rivas Fernandez A, Blanco Alvarez M, Tejido Sanchez A, Leiva Galvis O. Historical review of Fournier’s gangrene: Baurienne, 1764 and Herod the Great, 4 B.C. Eur Urol Suppl 2009; 8(4): 121.
- Ibn Sîna [Avicenna]. The canon of medicine. Vol 2, book 3. Boulaq editing [Arabic], Cairo; 1877. p 554.
- Litchfield WR. The bittersweet demise of Herod the Great. J R Soc Med 1998; 91: 283-4.
- Fournier J-A. Gangrene foudroyante de la verge. Semaine medicale 1883; 3: 345-8.
- Bahlmann JCM, Fourie IjvH, Arndt TCH. Fourniers gangrene: necrotising fasciitis of the male genitalia. Br J Urol 1983; 55: 85-8 Smulewicz JJ, Donner D. Gas gangrene of the scrotum. J Urol 1974; 111: 621-5.
- Smith GL, Bunker CB, Dinneen MD. Fournier’s gangrene. Br J Urol 1998; 81: 347-355.
- Osegbe DN, Akaiso OE, Panchalingam L, Dania F, Harry A, Ashiru B. Fournier’s gangrene: infective gangrene of the genitalia. Lagos J Surg 1998; 1: 3-8.
- Eke N. Fournier’s gangrene: a review of 1726 cases. Br J Surg 2000; 87: 718-728.
- Morpurgo E, Galandiuk S. Fournier’s gangrene. Surg Clin North Am 2002; 82(6), 1213-1224. Clayton MD, Fowler JE, Sharifi R, Pearl RK. Causes, presentation and survival of fifty-seven patients with necrotizing fasciitis of the male genitalia. Surg Gynecol Obstet 1990; 170(1), 49-55.
- Elem B, Ranjan P. Impact of immunideficiency virus (HIV) on Fournier’s gangrene: observations in Zambia. Ann R Coll Surg Engl 1995; 77: 283-6.
- Viddeleer AC, Lycklama a Nijeholt GAB. Lethal Fournier’s gangrene following vasectomy. J Urol 1992; 147:1613-14.
- Patel A, Ramsay JW, Whitfield HN. Fournier’s gangrene of the scrotum following day case vasectomy. J R Soc Med 1991; 84: 49-50.
- Mallikarjuna MN, Vijayakumar A, Vijayraj SP, Shivswamy BS. Fournier’s Gangrene: Current Practices. ISRN Surg 2012; Article ID 942437, 8 pages.
- Sroczynski M, Sebastian M, Rudnicki J, Sebastian A, Agrawal AK. A complex approach to the treatment of Fournier’s gangrene. Adv Clin Exp Med 2013; 22(1); 131-5.
- Grabe M, Bjerklund-Johansen TE, Botto H, Çek M, Naber KG, Pickard RS, Tenke P, Wagenlehner F, Wullt B. Guidelines on urolgical infections. Uroweb 2013.http://www.uroweb.org/gls/pdf/18_Urological%20infections_LR.pdf, accessed Nov 1th 2013.
Bildquelle: Abb. 1 - 3: OFArzt Dr. Roland Bartmuß, BwKrHs Ulm
Datum: 13.05.2014
Quelle: Wehrmedizinische Monatsschrift 2014/3