Hintergrund
Karzinome des Mund- und Rachenraumes stellen in Deutschland eine relativ häufige Tumorentität dar, die zu über 90 % aus Plattenepithelzellkarzinomen besteht. Traditionell sind übermäßiger Nikotin- sowie Alkoholkonsum als Hauptrisiskofaktoren etabliert, wobei in den vergangenen Jahren ein beachtlicher Anstieg der Karzinomprävalenz mit Assoziation zu oralen Infektionen mit dem humanen Papillomavirus (HPV) zu beobachten ist. Als ursächlich werden Wandel im Sexualverhalten und häufige Partnerwechsel angesehen.
In modernen multimodalen Therapieansätzen nimmt die adjuvante und neoadjuvante Strahlentherapie in Verbindung mit chi-rurgischen bzw. chemotherapeutischen Verfahren einen zentralen Platz ein. Interessanterweise zeigen HPV-assoziierte Oropharynxkarzinome eine erhöhte Strahlensensibilität und eine bessere Prognose, wobei die zugrundeliegenden Mechanismen noch unklar sind. In den vergangenen Jahren konnte gezeigt werden, dass das in Zellkernen menschlicher Zellen vorkommende heterogene nukleäre Ribonukleoprotein K (hnRNP K) in verschiedenen Tumoren überexprimiert wird und für Tumorwachstum und Überleben der Tumorzellen eine wichtige Rolle spielt. HnRNP K agiert dabei als Co-Faktor des bekannten Tumorsuppressorgens p53, dem sogenannten „Wächter des Genoms“.
HnRNP K verhindert in kolorektalen Tumorzellen das Einleiten des programmierten Zelltods (Apoptose) und ist in Melanomzellen ein wichtiger Faktor für zelluläre DNA-Reparaturprozesse nach Bestrahlung. Pharmakologische Blockade des in Tumorzellen häufig aktivierten MAP-Kinase-Signalwegs bewirkte in diesen Tumoren einen Rückgang der zellulären hnRNP K-Konzentrationen in Verbindung mit einer Strahlensensibilisierung. In der vorliegenden Arbeit wurde deshalb die Bedeutung von hnRNP K für die Vermittlung karzinogener Eigenschaften und der Strahlenresistenz von Karzinomen des Mund- und Rachenraumes, sowie die potentielle Eignung als diagnostisches und therapeutisches Target untersucht.
Methoden und Ergebnisse

Proben von Mund- und Rachenraumkarzinomen von mehr als 120 Patientinnen und Patienten wurden immunhistologisch auf ihre hnRNP K-Expression hin untersucht und mit 15 Gewebeproben Gesunder (Zunge, Epiglottis) verglichen. Im Tumorgewebe zeigte sich hnRNP K signifikant stärker in Zellkernen exprimiert. Innerhalb der Tumore war eine zytoplasmatische hnRNP K-Akkumulation hochsignifikant mit metastasierten Tumoren (UICC: IV) assoziiert.
In-vitro-Experimente
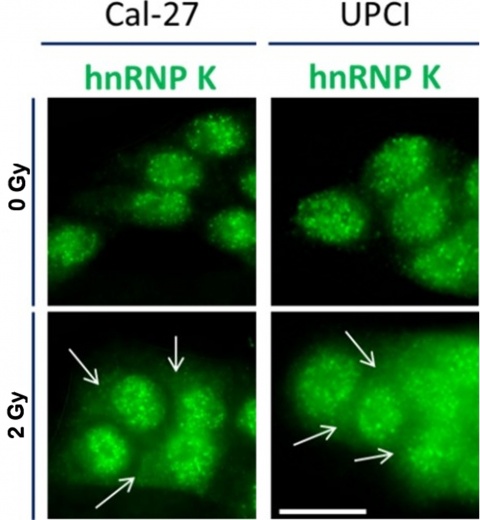
Für in-vitro-Experimente wurden die Plattenepithelkarzinomzelllinien Cal-27 (HPV-negativ) und UPCI-SCC-154 (HPV-positiv) aus Zungentumoren zweier männlicher Patienten verwendet. Bestrahlung mit 2 Gy verursachte in beiden Zelllinien einen dosis- und zeitabhängigen Anstieg der zellulären hnRNP K-Konzentrationen mit Maximalwerten (Faktor 2 - 3) nach ca. einer Stunde und einer anschließenden Normalisierung auf Ausgangsniveau innerhalb von 24 Stunden. In Immunfluoreszenzversuchen zeigte hnRNP K eine überwiegend nukleäre Lokalisation und eine zytoplasmatische Anreicherung innerhalb einer Stunde nach Bestrahlungsdosen von 2 Gy (Abbildung 1).
Die Eignung der verwendeten HPV-positiven Zelllinie UPCI-SCC-154 als Modell für die klinisch beobachtete erhöhte Strahlensensibilität HPV-assoziierter Oropharynxkarzinome wurde mittels dosisabhängiger Klonierungstests überprüft und konnte bestätigt werden. Die mit steigenden Bestrahlungsdosen sinkende Fähigkeit von Tumorzellen zur Bildung von Klonen kann grundsätzlich durch die Induktion von Apoptose bzw. durch verminderte Zellteilung infolge Zellzyklusarrest verursacht werden. Die Analyse des Zellzyklus erfolgte mittels Durchflusszytometrie (FACS), während die Induktion der Apoptose durch ELISA-basierte Messung des zellulären Markers Active-Caspase 3 durchgeführt wurde.
Zur Beurteilung der Rolle von hnRNP K bei diesen Prozessen wurden siRNA-basierte transiente Knock-Down-Experimente herangezogen. Die erfolgreiche Proteinreduktion wurde im Immunoblot nachgewiesen.
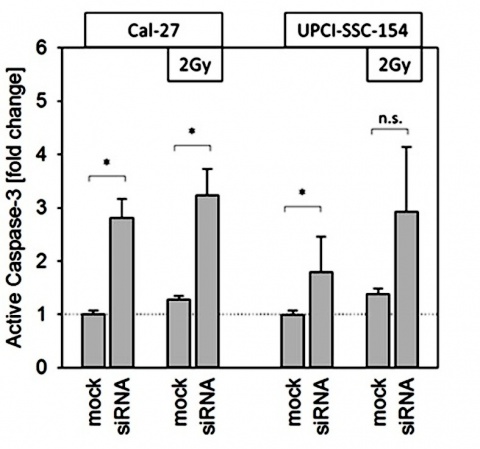
In der Durchflusszytometrie konnte nach hnRNP K-Knock Down keine Änderung des Zellzyklusfortschritts der Tumorzellen gezeigt werden. Die Reduktion der zellulären hnRNP K-Konzentrationen führte jedoch sowohl in Cal27 (HPV-) als auch in UPCI (HPV+) zu einer signifikanten Erhöhung der Active--Caspase 3 und damit zum Zelltod. Dieser Effekt wurde durch Bestrahlung zusätzlich verstärkt (Abbildung 2).
In-vivo Experimente – Chorion-Allantois-Membran Assay
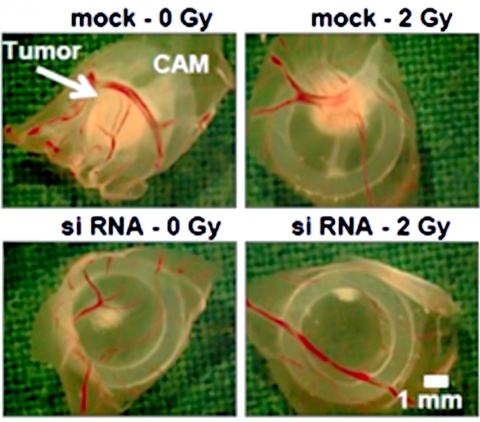
Abschließend wurde die innovative Methode des hühnereibasierten Chorion-Allantois-Membran (CAM) Assays als In-vivo Tierversuchsersatzverfahren genutzt. Beide Zelllinien wurden unter Transfektionsbedingungen (mock/siRNA) kontrolliert bestrahlt (0/2 Gy) und in befruchtete und über sieben Tage vorinkubierte Hühnereier appliziert (je 8 Hühnereier pro Zellansatz). Nach Eröffnung der Schale wurde auf die CAM ein Silikonring aufgebracht und mit 106 Tumorzellen/Ei beimpft. Nach weiteren 3 Tagen Inkubation (37 °C, 60 % Luftfeuchtigkeit) wurden Silikonring sowie Tumor mit versorgenden Gefäßen extrahiert und makroskopisch wie mikroskopisch aufgearbeitet. Es zeigten sich dabei makroskopisch in den Kontrollgruppen (mock) beider Zelllinien – unabhängig von der Bestrahlung – deutliches Tumorwachstum sowie Gefäßeinsprossung. Nach Knock Down waren sowohl Tumorgröße als auch Gefäßneubildung signifikant reduziert (Abbildung 3).
Die HE-Färbung der Tumorschnitte zeigte unter Kontrollbedingungen (mock) ein infiltratives Tumorwachstum, was durch hnRNP K-Knock Down signifikant reduziert werden konnte. Die durch alleinige Bestrahlung mit 2 Gy beobachtete Reduktion des Tumorwachstums konnte in Kombination mit hnRNP K-Knock Down signifikant gesteigert werden. Durch immunhistochemische hnRNP K-Färbung konnte die Effektivität des Knock Down auch nach drei Tagen Inkubation auf der CAM des Hühnereies bestätigt werden.
Zusammenfassung und Ausblick
Verglichen mit Normalgewebe zeigte sich immunhistochemisch eine Zunahme des nukleären hnRNP K Gehalts in Tumorgewebe von Mund- und Rachenraumkarzinomen. Eine zytoplasmatische Akkumulation von hnRNP K war mit einer bereits erfolgten Metastasierung vergesellschaftet.
HnRNP K- Knock Down verursachte eine Induktion der Apoptose, verminderte Invasivität, reduziertes Tumorwachstum und abgeschwächte Blutgefäßneubildung – unabhängig vom HPV--Status der untersuchten Zelllinie.
Die immunhistochemische hnRNP K-Färbung von Tumorproben bietet einen viel versprechenden Ansatz zur diagnostischen Beurteilung der Metastasierungsneigung und Radiosensibilität von Mund- und Rachenraumkarzinomen. Perspektivisch könnte sich hnRNP K – nach weiteren Untersuchungen in Folgestudien – als ein therapeutisch nutzbares Target zur pharmakologischen Radiosensibilisierung des jeweiligen Tumors vor Einleitung einer Strahlentherapie darstellen.
Literatur
- Mallen-St Clair J, Alani M et al.: “Human papillomavirus in oropharyngeal cancer: The changing face of a disease.” Biochim Biophys Acta 2016; 2: 141 - 150.
- Kim L, King T et al.: “Head and neck cancer: changing epidemiology and public health implications.” Oncology (Williston Park) 2010; 24(10): 915 - 919, 924.
- Eder S, Lamkowski A et al.: “Radiosensitization and downregulation of heterogeneous nuclear ribonucleoprotein K (hnRNP K) upon inhibition of mitogen/extracellular signal-regulated kinase (MEK) in malignant melanoma cells.” Oncotarget 2015; 6(19): 17178 - 17191.
- Haley B., Paunesku T et al.: “Response of heterogeneous ribonuclear proteins (hnRNP) to ionising radiation and their involvement in DNA damage repair.” Int J Radiat Biol 2009; 85(8): 643 - 655.
- Strozynski J, Heim J et al.: Proteomic identification of the heterogeneous nuclear ribonucleoprotein K as irradiation responsive protein related to migration.” J Proteomics 2014; 15; 113: 54 - 61.
Leutnant zur See (SanOA) Justus Kähler
E-Mail: [email protected]
Datum: 06.02.2019