Experimentelle Untersuchung zur Biokompatibilität offenporiger metallischer Implantatstrukturen mit bioaktiver Kalzium-Titanat-Reaktionsschicht unter besonderer Berücksichtigung des Knochenaufbaus
Ergebnisse einer tierexperimentellen Untersuchung
Einleitung
Die Behandlung großer Trümmerfrakturen langer Röhrenknochen, verursacht z.B. durch Gewalteinwirkungen im Rahmen militärischer Kampfhandlungen, Hochrasanztraumen oder maligner Knochentumoren, erfordert mitunter autologe oder allogene Spenden biologischen Materials.
Nicht immer lässt sich hierdurch der Defekt adäquat chirurgisch versorgen, sodass andere Knochenersatzmaterialien zum Einsatz kommen müssen. Nach
Ob durch Beschichtung mit Kalziumtitanat funktionalisierte Implantate aus Titanlegierungen die Osteogenese stärker anregen als nicht funktionalisierte, sollte durch die vorgestellte Arbeit geprüft werden.
Material und Methoden
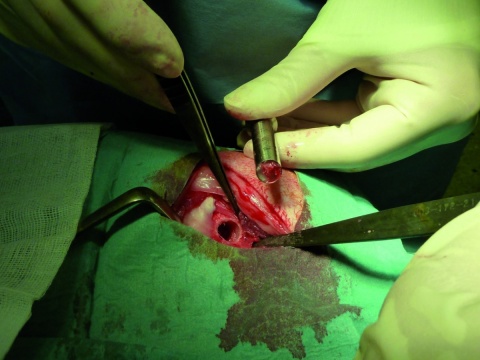
Bei 2 Gruppen zu je 12 adulten Merino-Landschafen wurden 10 x 12 mm große, zylindrisch geformte, offenporige (10 ppi) Titankörper (Ti-6Al-7Nb) in einen durch das Diamond-Bone-Cutting-System (DBCS) reproduzierbaren Defekt in die rechte mediale Femurkondyle (Abbildung 1) implantiert. Diese Scaffolds waren bei einer Gruppe mit einer Kalzium-Titanat-Reaktionsschicht funktionalisiert worden, um eine erhöhte Osteointegration und
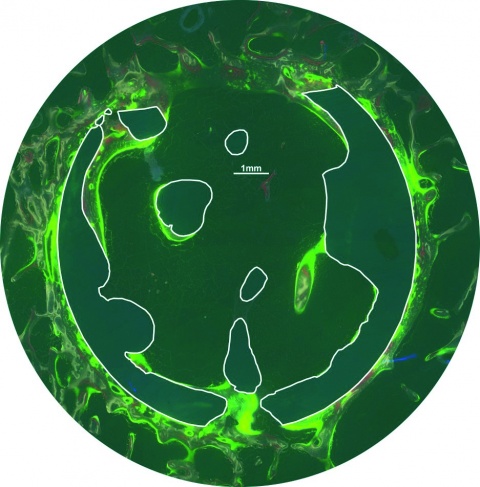
-konduktion zu provozieren. Zur Beurteilung aller 3 Phasen der Knochenheilung wurde eine Standzeit von 6 Monaten gewählt und eine polychrome Sequenzmarkierung mit Fluorochromen (intramuskulär verabreicht) vorgenommen (28. Tag: Tetracyclin, 105. Tag: Alizarin, 168. bzw. 175. Tag: Calcein;), was postmortal eine zeitliche Zuordnung der Osteointegration ermöglichte, ohne die Tiere vorzeitig zu euthanasieren (Abbildung 2). Nach Entnahme der Implantate erfolgte die Einbettung in Technovit®9100Neu und die Erstellung von Knochenschliffen. Zur Evaluation der Osteogenese erfolgten histologische, enzym- und immunhistochemische, histomorphometrische, molekularbiologische sowie biomechanische Untersuchungen.
Ergebnisse
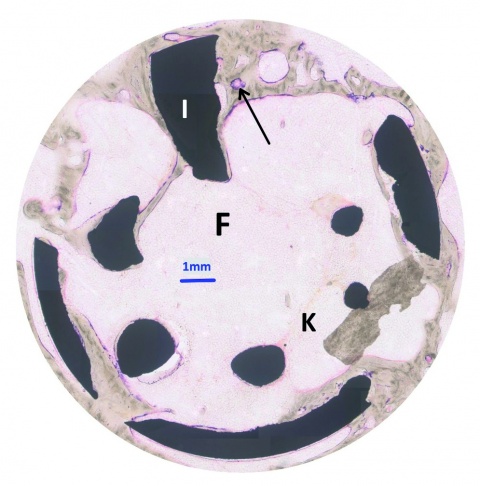
Die Enzymreaktion der alkalischen Phosphatase (Abbildung 3) des neugebildeten Knochens innerhalb der Area of interest (AOI), die den Defektbereich zuzüglich eines Randbereiches von 100 µm umfasste, war bei den funktionalisierten Implantaten (2,77 %) geringfügig stärker als bei den unfunktionalisierten Präparaten (1,57 %). Die histomorphometrisch bestimmte Fläche des neugebildeten Knochens für das Fluorchrom Alizarin betrug bei
Diskussion
Versuchsmodell
Ein wesentliches Ziel osteosynthetischer Operationen ist die Erzielung einer Primärstabilität (Übungsstabilität), um zeitnah eine postoperative Mobilisation des Patienten zu ermöglichen, so die Osteogenese anzuregen und einer Atrophie entgegenzuwirken. Deshalb wurde ein gegossenes, offenporiges und zylindrisches Implantat aus einer Titanlegierung (Ti6Al7Nb) gewählt. Durch die Geometrie konnte die Reproduzierbarkeit der Defektgröße mittels des Diamond-Bone-Cutting-Systems (DBCS, Firma Biomet®, Darmstadt) gewährleistet werden.
Da die Osteoprogenitorzellen über OPN (Osteoprogenitorprotein) und BSP (Bone-specfic Protein) durch L-Typ-Kalzium-Kanäle und die Kalzium-abhängige Proteinkinase (CAMK2) freies Kalzium binden und zu Osteoblasten differenzieren, wurden die funktionalisierten Implantate mit einer Kalzium-Titanat-Reaktionsschicht versehen. Ziel war es, eine erhöhte Adhäsion spezifischer Knochenzellen zu erreichen, um so die Biokompatibilität zu erhöhen.
Um bei einer Evaluation in vivo auf den Menschen übertragbare Daten zu erhalten, fiel die Wahl auf ausgewachsene Merino-Landschafe. Biokompatibilität, Inflammations- und Osteonintegrationsverhalten entsprechen bei diesen weitestgehend denen des humanen Knochens. Oviner Knochen ist daher besser geeignet als z.B. Kleintierknochen. Weiter sind Stoffwechselprozesse im ausgewachsenen Landschaf mit dem des Patientenkollektivs vergleichbar, in welchem die Implantate Anwendung finden sollten. Das gilt auch für Gewichts-Knochen-Relation, Knochenstruktur sowie Blut-, Immun- und Lymphsystem.
Die sekundäre (über Bildung eines Knorpels) Defektheilung eines frakturierten Knochens wird in drei Phasen – Akutphase, Reparationsphase und
Bewertung der Ergebnisse
Im Vergleich der Ergebnisse zeigten die Kalzium-Titanat-Implantate bei der histomorphometrischen Messung, der Aktivität der alkalischen Phosphatase, der Toluidinblau-Färbung des neugebildeten Knochens, den Fluoreszenzen sowie den molekularbiologischen und biomechanischen Testungen jeweilig eine minimal erhöhte Knochenneubildung, die jedoch vornehmlich auf die Randbereiche des Implantates konzentriert war, während das Innere des Defektes weitgehend knochenfrei blieb. Außerdem fand sich bei beiden Testgruppen eine mit Bindegewebe oder Fettmark gefüllte Spaltbildung am Interface. Mögliche Erklärungen dafür sind:
- Bei der Herstellung der zylindrischen Rotationskörper wurden diese in der Drehmaschine nach einem Ätzvorgang mit Flusssäure geformt. Prozessbedingt war der Ätzvorgang an der gedrehten äußeren Oberfläche weniger effektiv als im Inneren. Dies scheint dort zu einer erniedrigten Zelladhäsion geführt zu haben.
- Des Weiteren konnten die ursprünglich geplanten 20 – 30 ppi dichten, Spongiosa-ähnlichen Strukturen, im Gießvorgang nicht vollends realisiert werden, sodass die Zellmigration gehemmt wurde.
- Das zu testende Material hatte einen höheren Elastizitätskoeffizient (Titan 105 kN/m²) als spongiöser Knochen (18 kN/m²). Der Knochen „sah“ damit keine mechanische Veranlassung, in den durch das Implantat stabilisierten Defekt einzuwachsen (Wolff-Transformationsgesetz).
Fazit
Eine Funktionalisierung gegossener offenporiger Titanimplantate durch eine Calcium-Reaktionsschicht erhöht im Großtierversuch gegenüber unfunktionalisierten Surrogaten die Osteointegration nicht.
Klinische und wehrmedizinische Relevanz der optimierten Behandlung von Knochendefekten machen die weitere Forschung zur Entwicklung eines idealen Surrogats erforderlich. Bis es zur Verfügung steht, bleibt der autologe Knochenersatz Goldstandard.
Literatur:
- Schnettler R, Stahl J, Alt V, Pavlidis T, Dingeldein E, Wenisch S. Calcium Phosphate-Based Bone Substitutes, European Journal of Trauma, 2004; 30(4): 219 – 229.
- Laurencin C, Khan Y, El-Amin S F. Bone graft substitutes. Expert Review of Medical Devices, 2006; 3(1): 49 – 57.
- Jung GY, Park YJ, Han JS. Effects of HA released calcium ion on osteoblast differentiation. Journal of Materials Science: Materials in Medicine, May 2010; 21(5): 1649 – 1654.
- Lüllmann-Rauch R. Taschenlehrbuch Histologie, 2012; Thieme Verlag: 151 – 167.
- Qu S, Fan H, Chen J, Feng J, Fu R, Wei D, Zhanget X. Effect of the crystallinity of calcium phosphate ceramics on osteoblast proliferation in vitro. Journal of Materials Science Letters, 2001; 20(4): 331 – 332,
- Schnettler R, Alt V, Dingeldein E, Pfefferle HJ, Kilian O, Meyer C, Heiss C, Wenisch, S. Bone ingrowth in bFGF-coated hydroxyapatite ceramic implants. Biomaterials 2003; 24 (25): 4603 – 4608.
Literatur beim Vefasser.
Bildquellen: L. de Azevedo, Hamburg
Für die Verfasser:
Oberstabsarzt Lucie de Azevedo
Bundeswehrkrankenhaus Hamburg
Email: [email protected]
Datum: 09.12.2016
Quelle: Wehrmedizinische Monatsschrift 2016/11