EPIDEMIOLOGIE UND DIAGNOSTIK VON LEBENSMITTELÜBERTRAGENEN VIREN
Infektionen durch bakterielle Krankheitserreger in Lebensmitteln sind seit Jahrzehnten bekannt.
Bakterien führen in Lebensmitteln einerseits zum Verderb der Produkte, andererseits können pathogene Arten schwerwiegende Infektionen verursachen. Die Bedeutung von Viren in Lebensmitteln ist seit relativ kurzer Zeit bekannt und wird in jüngerer Zeit intensiv untersucht. Nähere Untersuchungen sind erst seit Einführung molekularbiologischer Untersuchungsmethoden (PCR und Sequenzierung) möglich, da die relevanten Viren nicht oder nur schwierig kultivierbar sind.
Virale Lebensmittelinfektionserreger sind international von großer Bedeutung, insbesondere mit Blick auf derzeitige und potentielle Einsatzgebiete der Bundeswehr. Europäischen und deutschen Auswertungen zufolge werden zunehmend Viren als Ursachen lebensmittelassoziierter Gruppenerkrankungen nachgewiesen (EFSA, 2014, BfR, 2013). Von besonderer Bedeutung sind Einrichtungen zur Gemeinschaftsverpflegung. Die Ausgabe kontaminierter Lebensmittel hat eine entsprechend höhere Zahl exponierter Personen zur Folge, als die Versorgung im häuslichen Umfeld. Daher hat im Rahmen des vorbeugenden Gesundheitsschutzes die virologische Untersuchung von Lebensmitteln und Trinkwasser eine hochaktuelle Bedeutung in der veterinärmedizinischen Diagnostik.
1 Einleitung
Jährlich erkranken in Deutschland etwa 200.000 Menschen an Gastroenteritiden, wobei Noroviren die Hauptursache darstellen. Hervorzuheben ist hier ein Norovirus-Ausbruch im Jahr 2012 bedingt durch den Verzehr von importierten Tiefkühl-Erdbeeren, der allein für mindestens 10.000 Fälle ursächlich war (Bernard et al., 2014). Bei virusbedingten Ausbrüchen können neben Noroviren auch Hepatitis A-Viren, Rotaviren oder Flaviviren über kontaminierte Lebensmittel Gruppenerkrankungen verursachen (EFSA 2014). Daneben gewinnen Hepatitis E-Viren zunehmend an Bedeutung. Als Zoonoseerreger können sie über Fleisch und Innereien von infizierten Tieren, insbesondere Haus- und Wildschweine, übertragen werden (Hoofnagle et al. 2012). Zusätzlich besteht für eine Reihe zoonotischer Viren die Möglichkeit mit Lebensmitteln übertragen zu werden. Für pathogene Aviäre Influenza-Viren sowie Nipah-Viren wurden trotz des geringen Übertragungsrisikos durch Lebensmittel Fälle in Ostasien beschrieben (Tumpey et al. 2003, Luby et al. 2006). Das Tick-Borne Encephalitis-Virus (TBEV) wird als vektorabhängige Zoonose üblicherweise durch Zecken übertragen. In einigen Fällen wurde die Übertragung mit Milch oder Milchprodukten auch in Europa nachgewiesen (Hupodisk et al. 2012). Tollwut-Viren sind ein Problem in Ländern, in welchen Hunde als Fleischlieferanten gezüchtet werden, wie China und andere Länder Ostasiens. In Studien wurde Tollwut-Virus bei Hunden aus Haltungen für die Fleischproduktion nachgewiesen. Hier liegt das Infektionsrisiko insbesondere bei der Schlachtung und Verarbeitung des Fleisches (Xiao-Yan Tao et al. 2009).
In Deutschland ist Dank umfangreicher Überwachung entsprechend Tiergesundheits- sowie Lebensmittel- und Bedarfsgegenständegesetz eine hohe Sicherheit der Lebensmittel gegeben. Die Regelungen gelten auch im Bereich der Bundeswehr einschließlich der Lebensmittel- und Küchenhygiene im Einsatz. Die nationalen Regelungen in den Einsatzländern sind dagegen fast immer entschieden weniger effizient.
2 Noroviren
2.1 Epidemiologie Lebensmittel-assoziierter Erkrankungen
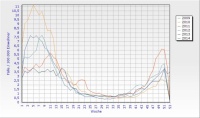
Bei den viralen Enteritiserregern sind insbesondere Noroviren von großer Bedeutung. In den vergangenen Jahren wurden in Deutschland zwischen 91 000 und 140 000 Norovirus-Infektionen pro Jahr nachgewiesen, wobei ein deutlicher Peak in den Wintermonaten zu verzeichnen ist (Abb. 1). Noroviren sind kleine, unbehüllte RNA-Viren, die sich durch hohe Infektiosität (etwa 10 - 100 Viruspartikel) und hohe Tenazität auszeichnen. Noroviren werden derzeit in fünf Genogruppen (GG) eingeteilt, wobei die humanpathogenen Stämme vornehmlich der GGI, GGII und vereinzelt GGIV zuzuordnen sind. Nicht nur über Schmier- und Kontaktinfektionen (Wadl et al., 2009), sondern auch über kontaminierte Lebensmittel können norovirusbedingte Gruppenerkrankungen ausgelöst werden. Daneben sind kontaminiertes Trink- (Larsson, 2014) oder Grundwasser (Cho et al., 2014), als Ursache für Norovirus-Ausbrüche beschrieben (Sinclair et al., 2009).
Bei den lebensmittelbedingten Ausbrüchen wurden EU-weit insbesondere frische Lebensmittel wie Obst, Gemüse oder Salate, Fische und Fischereierzeugnisse, aber auch verzehrsfertige Gerichte als Ursache identifiziert (EFSA 2014). Wesentliche Ursache war die Beschäftigung infizierter Personen in der Produktion, die oft subklinisch erkrankt waren oder in der ihrer Rekonvaleszenzphase Viren ausgeschieden haben. An Noroviren erkrankte Personen scheiden, insbesondere in der akuten Krankheitsphase von ein bis drei Tagen im Mittel 109 Viruspartikel/g Stuhl (gemessen in Genomäquivalenten) aus (Atmar et al., 2008). Die Ausscheidung sistiert üblicherweise innerhalb von etwa 3 Wochen nach Beginn der Erkrankung. Daneben werden aber immer wieder Ausscheider über mindestens 100 Tage nachgewiesen, die wiederum die Ausbruchswahrscheinlichkeit deutlich erhöhen (Milbrath et al., 2013).
Noroviren können über lange Zeit im verzehrsfertigen Lebensmittel infektiös bleiben, sodass auch importierte Lebensmittel als Ursache identifiziert wurden (Bernard et al., 2014).
Innerhalb der Bundeswehr hat sich in den vergangenen zehn Jahren eine deutliche Verschiebung bei den Ursachen für lebensmittelbedingte Gruppenerkrankungen dahingehend abgezeichnet, dass insbesondere Noroviren zunehmend an Bedeutung gewinnen (Kreienbrink et al., 2012).
2.2 Norovirusdiagnostik aus klinischen Proben, Umgebungsproben und Lebensmitteln
Humanpathogene Noroviren sind in vitro nicht kultivierbar, trotz vereinzelter Berichte über Tiermodelle existiert kein routinetaugliches Zellkultur-basiertes Nachweisverfahren. Der Nachweis von Noroviren mittels Real Time RT-PCR stellt daher den Goldstandard in der Routinediagnostik dar. Im Bereich der veterinärmedizinischen Lebensmittelüberwachung am ZInstSanBw Kiel wurde der Genogruppen-spezifische Nachweis mittels Real Time RT-PCR für GG I und II aus Umgebungsproben und Lebensmitteln in der Routine und im Einsatz erfolgreich etabliert (Scherer et al. 2009, Tandler et al., 2012)*1. Parallel erfolgt in Abstimmung mit der Abteilung I des ZInstSanBw Kiel die Untersuchung in der medizinischen Diagnostik positiv getesteter klinischer Proben, um hierdurch in beiden Bereichen den Nachweis zu führen und den Ausbruchsstamm zu bestimmen. Die Bestätigung positiver Befunde erfolgt bei Gruppenerkrankungen grundsätzlich durch Sequenzierung der PCR-Amplifikate (Richards et al., 2004).
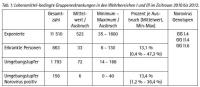
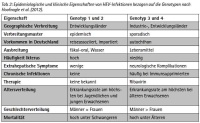
Im Zuständigkeitsbereich des ZInstSanBw Kiel wurden im Zeitraum 2010 bis 2012 26 Ausbrüche mit 863 Erkrankten bei 11 510 Exponierten gemeldet. In zwei Fällen handelte es sich um einen nosokomialen Norovirus-Ausbruch (Ebert et al., 2011), bei den übrigen 24 Ausbrüchen waren Lebensmittel die zunächst vermutete Genese. Durch Sequenzierung konnten neben dem zur Zeit in Deutschland endemisch vorkommenden Genotyp GII.4 auch die für eine Mensch-zu-Mensch-Übertragung nicht beschriebenen Genotypen GII.6 und GI.4 gefunden werden (Binder et al., 2013).
Grundsätzlich hat sich die Sequenzierung der positiven Proben als sinnvoll erwiesen, um epidemiologische Daten zu erhalten, die wertvolle Hinweise zum Outbreak-Management geben können (Schotte et al., 2012). Durch die Untersuchung von Oberflächentupfern kann zudem die Effektivität der Reinigungs- und Desinfektionsmaßnahmen sowohl im Küchen- als auch Patientenbereich geprüft und angepasst werden.
Um die zeitnahe Diagnostik noch in der Ausbruchsphase sicherstellen zu können, wurde durch Einsatz teilautomatisierter Verfahren der Zeitbedarf bei der Untersuchung von Tupferproben soweit reduziert, dass im Bedarfsfall ein Befund innerhalb weniger Stunden nach Probeneingang vorliegen kann. Dies ermöglicht die Beratung der mit der Bekämpfung des Ausbruchs Verantwortlichen noch in der Anfangsphase.
2.3 Noroviren im Auslandseinsatz
In den Jahren 2011/2012 traten im Kosovo Einsatz (KFOR) regelmäßig Enteritiden mit bis zu sechs erkrankten Soldaten auf. Durch den Einsatz der dort vorhandenen Real Time PCR Ausstattung im veterinärmedizinischen Labor im Einsatz konnten Noroviren des Genotyp GII.4 aber auch des seltenen Genotyps GII.7 nachgewiesen werden. Die Untersuchung in der Real Time PCR erwies sich als deutlich sensitiver, als der bis dahin praktizierte Schnelltest. Maßnahmen zur Desinfektion und zum Management des Ausbruchsgeschehens im Einsatz konnten so schnell und effektiv eingeleitet werden. Über norovirenbedingte Ausbrüche im Kosovo wurde in der Vergangenheit selten berichtet (Binder et al. 2013).
3. Hepatitis Viren
Virale Hepatitiden werden durch unterschiedlichste Viren verursacht, werden aber aufgrund des klinischen Bildes einer Leberentzündung in einer Gruppe zusammengefasst.
Die Infektion mit Hepatitis B, C und D Viren erfolgt hämatogen bzw. durch Sekrete und zeigt oft schwerwiegende, chronische Verläufe bis zur Leberzirrhose und zum Leberkarzinom. Hepatitis A und E werden fäkal-oral bzw. Hepatitis E auch zoonotisch übertragen und führen in Regionen mit niedrigem hygienischen Standard zu Epidemien mit mehreren zehntausend Erkrankten. Die Hepatitis A- und B-Impfung ist Teil des Impfschemas der Bundeswehr, daher besteht ein gut wirksamer Impfschutz für Soldaten der Bundeswehr.
3.1 Hepatitis E-Viren - Epidemiologie und Zoonosepotential
Hepatitis E ist die fünfte bekannte Form humaner viraler Hepatitiden und stellt die häufigste Ursache akuter Leberentzündung und Ikterus weltweit dar (Hoofnagle et al. 2012). Das Hepatitis E-Virus (HEV) wurde erstmals während der sowjetischen Besatzung Afghanistans in den 1980ern nach einem Hepatitis-Ausbruch ungeklärter Ursache in einem Militärcamp entdeckt (Freshwater 2013) und hat nicht nur deswegen eine besondere Bedeutung für die Bundeswehr. Der Erreger ist ein kleines, einzelsträngiges, nicht-behülltes RNA-Virus des Genus Hepevirus der Familie Hepeviridae und lässt sich in vier Genotypen einteilen. Hierbei verursachen Genotyp 1 und 2 mit einer fäkal-oralen sowie wasserassoziierten Übertragung in Regionen mit niedrigem hygienischen Standard große Epidemien (Hoofnagle et al. 2012; Yugo u. Meng 2013). Beispielsweise erkrankten bei solch einem Ausbruch in Südindien 2008 etwa 24 000 Menschen. Für jene Haushalte, die ausschließlich die kontaminierte Wasserressource benutzten, wurde eine Erkrankungsrate von 54,5 % festgestellt (Vivek et al. 2010). Genotyp 3 und 4 kommen nicht nur in Entwicklungsländern, sondern auch in den Industriestaaten vor und unterliegen einer zoonotischen Übertragung. Hierbei ereignet sich die humane Infektion in erster Linie über Haus- und Wildschweine sowie daraus hergestellten Lebensmitteln (Hoofnagle et al. 2012; Yugo u. Meng 2013). Während die in Deutschland detektierten humanen HEV-Infektionen in der Vergangenheit zumeist als reisebedingt eingeschätzt wurden, treten zunehmend autochthone Erkrankungsfälle (ohne Reiseanamnese) auf (Koch u. Stark 2009). Zudem ist ein stetiger Anstieg der an das Robert-Koch-Institut gemeldeten Fallzahlen zu verzeichnen: Während 2009 109 an Hepatitis E erkrankte Personen erfasst wurden, hat sich die Anzahl bis 2013 mit 458 mehr als vervierfacht (Robert Koch-Institut: SurvStat@RKI, http://www3.rki.de/SurvStat, Datenstand: 26.5.2014). Dabei wird aufgrund der klinischen Ähnlichkeit zu anderen Hepatitiden und der relativen Unbekanntheit des Virus unter vielen Allgemeinmedizinern von einer hohen Dunkelziffer ausgegangen.
3.2 Hepatitis E-Viren - Nachweis aus Lebensmitteln und Tierproben
Da für HEV kein Impfstoff in Deutschland existiert, stehen Maßnahmen zur Verhinderung einer Infektion im Vordergrund. Dazu sind sichere und sensitive Nachweismethoden für die Untersuchung von verdächtigen Lebensmitteln, Wasser und Tieren sowie für die Aufklärung von Erkrankungsausbrüchen notwendig. Dies ist auch in den Einsatzgebieten von besonderer Bedeutung, da dies häufig Länder mit endemischem HEV-Vorkommen sind. Wenngleich kommerzielle Nachweissysteme für den direkten und indirekten HEV-Nachweis bei Mensch und Tier verfügbar sind, variieren Sensitivität und Spezifität oft erheblich (Bächlein et al. 2010, Krumbholz et al. 2013). Für die Untersuchung von Tierproben, Lebensmitteln, Trinkwasser und Umgebungsproben existieren bislang keine fest etablierten Testsysteme und nur wenige Protokolle sind veröffentlicht. Deswegen erarbeitet und testet das ZInstSanBw Kiel gemeinsam mit der Stiftung Tierärztliche Hochschule Hannover Aufreinigungs- und Nachweisprotokolle, welche sowohl in der Routinediagnostik als auch im Einsatz Verwendung finden sollen. Stets stellt die PCR die Methode der Wahl dar. Im Rahmen dieses Forschungsprojektes *2 werden am ZInstSanBw Kiel zudem Untersuchungen zur Verbreitung des Virus in der Wildtierpopulation auf den Truppenübungsplätzen durchgeführt. Hierfür liegen schon erste Untersuchungsergebnisse vor: Während Antikörper bei zahlreichen Tieren verschiedener Herkunft nachgewiesen werden konnte, erfolgte der Direktnachweis bislang ausschließlich bei Tieren im Grenzgebiet zu Polen. Oft stehen ausschließlich Wildschweine in Verdacht mit HEV infiziert zu sein. Hier wurde Rehwild erstmals in Deutschland als Träger des Virus identifiziert.
4 Diskussion und Schlussfolgerungen
Viren benötigen für die Vermehrung lebende, aktive Zellen und können sich daher nicht in Lebensmitteln vermehren. Zoonotisch übertragene Viren vermehren sich im Tier bis zur Schlachtung und gelangen damit über die Primärproduktion in das Lebensmittel. Im weit größeren Maßstab erfolgt eine Kontamination bei den Produktionsschritten Verarbeitung und Zubereitung. Hierbei handelt es sich in der Regel um Viren humanen Ursprungs, die über das Vehikel Lebensmittel andere Menschen infizieren können. Viren in Lebensmittel sind zum großen Teil lange überlebensfähig und infektiös.
Bedingt durch die zunehmende Anzahl virologischer Lebensmitteluntersuchungen steigt die Nachweisrate von Viren in Lebensmitteln bei Gruppenerkrankungen in den letzten Jahren. Diese Tendenz ist sowohl national als auch international zu verzeichnen (EFSA, 2014; BfR, 2013). Mit Blick auf bestehende und potentielle Einsatzgebiete der Bundeswehr sind in der Diagnostik auch seltene Infektionserreger und Übertragungswege zu berücksichtigen. Dies betrifft sowohl die in tropischen Regionen vorkommenden bakteriellen Enteritiserreger (Vibrio cholerae, Shigella spp., Salmonella typhi) als auch durch Lebensmittel oder Wasser übertragbare Viren.
Der zoonotische Übertragungsweg des HEV Genotyp 3 und 4 über Lebensmittel tierischer Herkunft in Deutschland sowie weiteren Industrieländern rückt in den vergangenen Jahren zunehmend in den Fokus. HEV Genotyp 1 und 2 führen über verunreinigtes Trinkwasser regelmäßig zu großen Erkrankungsausbrüchen in schwächer entwickelten Ländern und in Flüchtlingslagern (Isaäcson et al. 2000; Boccia et al. 2006; Guthmann et al. 2006; Teshale et al. 2010; Arora et al. 2013; Gurley et al. 2014) Um eine höhere Sicherheit hinsichtlich der Risikobewertung des Infektionsrisikos mit HEV durch kontaminierte Lebensmittel und Trinkwasser zu erhalten, ist die Entwicklung sensitiver und robuster Nachweismethoden zur virologischen Untersuchung essentiell. Erst diese Grundlage ermöglicht die Aufklärung von Infektionswegen und eine letztendliche Risikobewertung für den Verbraucher.
Die hohe Bedeutung von Lebensmitteln als Infektionsquelle bei Gruppenerkrankungen durch Noroviren wurde in der jüngeren Vergangenheit wiederholt eindrucksvoll gezeigt (Bernard et al., 2014). Hierbei ist mit Blick auf die Prävention der kritische Einsatz von Personal im Bereich der Lebensmittelproduktion ein wesentlicher Punkt, um das Infektionsrisiko zu reduzieren (Barrabeig et al., 2010). Daneben ist fäkal kontaminiertes Wasser in Regionen mit eingeschränkter Wasseraufbereitung grundsätzlich als hohes Risiko für Infektionen einzustufen (Gallimore et al., 2005).
Die Etablierung neuer und die Verbesserung bestehender Untersuchungsmethoden zum Nachweis von Viren aus Lebensmitteln und Wasserproben ist dringend erforderlich, um nicht nur im Rahmen der amtlichen Lebensmitteluntersuchung in Deutschland, sondern auch im Einsatz die erforderlichen Fragestellungen bearbeiten zu können. Besonderes in den Einsatzländern ist mit einem weit größeren Erregerspektrum zu rechnen. Hier muss auch das Vorkommen hoch pathogener Viren berücksichtigt werden. Die Etablierung der Virusdiagnostik in Lebensmittel-, Tier- und Umgebungsproben stellt einen wesentlichen Schritt dar, der große Bedeutung für die Veterinär- und Präventivmedizin hat.
Literatur bei den Verfassern
*1,*2 Bearbeitung im Rahmen von Forschungsvorhaben für den Sanitätsdienst der Bundeswehr (Projektnummer M-SAB1-7A001 – Nachweis von Noroviren und Projektnummer E-UR2W—CF507-CF553 – Entwicklung von sensitiven Nachweisverfahren für Hepatitis E-Viren. Stiftung Tierärztliche Hochschule Hannover, Institut für Lebensmittelqualität und –sicherheit, ZInstSanBw Kiel, Abteilung II Veterinärmedizin).
Datum: 26.11.2014
Quelle: Wehrmedizin und Wehrpharmazie 2014/3