Fallbericht: Unklares Fieber – Tularämie?
Aus dem Institut für Mikrobiologie der Bundeswehr (Leiter: Oberstarzt Prof. Dr. L. Zöller)1 München, dem Institut für Medizinische Diagnostik Oderland (Ärztlicher Leiter: Dr. F. Berthold)2 Frankfurt(Oder), der Arztpraxis Schwielochsee (Dr. K. Ulrich)3, der Abteilung Innere Medizin (Chefarzt Dr. H. Richter)4 des Oder-Spree-Krankenhauses Beeskow
E.J. Finke
Zusammenfassung
Hintergrund: Die Tularämie (Hasenpest) ist eine in der nördlichen Hemisphäre endemische Zoonose. Im Gegensatz zu anderen Regionen Europas gibt es in Deutschland nur wenige humane Erkrankungen, die sich in der Regel als (ulzero-)glanduläre Form mit lokaler Lymphknotenschwellung manifestieren. Neben sporadischen Fällen können auch Gruppenerkrankungen auftreten.
Falldarstellung: Wir berichten über einen 56-jährigen Patienten, der sich mit hohem Fieber als Leitsymptom bei seinem Hausarzt vorstellte. Nach erfolglosem ambulanten Therapieversuch und anhaltenden Fieberschüben wurde er zur weiteren Diagnostik und Therapie stationär aufgenommen. Aus der Blutkultur gelang dort der Nachweis von Francisella (F.) tularensis subsp. holarctica und damit die Diagnose einer Tularämie. Unter adäquater Therapie mit Ciprofloxacin besserte sich der Zustand des Patienten schnell. Der weitere Verlauf war unauffällig. Unter Berücksichtigung der aktuellen Literatur werden wesentliche mikrobiologische, epidemiologische, klinische und diagnostische Aspekte der Erkrankung dargestellt.
Schlussfolgerungen: Gelegentlich kann sich eine Tularämie auch als fieberhafte Erkrankung ohne signifikante Lymphadenitis präsentieren. Ein entsprechender klinischer Verdacht kann mittels molekularbiologischer oder serologischer Verfahren schnell bestätigt oder ausgeräumt werden. Bei der Diagnose systemischer Infektionen kann eine Blutkulturdiagnostik wegweisend sein und sollte bei anhaltendem Fieber grundsätzlich initiiert werden.
Schlüsselwörter: Fieber, Schüttelfrost, Blutkultur, F. tularensis, Tularämie
Keywords: fever, chills, blood culture, F. tularensis, tularaemia
Einleitung
Die Ursache eines Fiebers ist unter dem Zeitdruck des ärzt-lichen Alltags bei Fehlen spezieller anamnestischer Hinweise und krankheitsspezifischer Symptome bzw. Befunde oft nur schwer zu erkennen [1]. Das trifft vor allem für Krankheiten zu, die wie die Tularämie in Deutschland meist nur sporadisch auftreten und sich in vielfältigen klinischen Formen manifestieren können. Daher sind initial Fehldiagnosen und Therapieversagen geradezu vorprogrammiert, die zugrundeliegende Krankheit wird oft erst im Rahmen einer stationären „Intensivdia-gnostik“ nachgewiesen [1 - 3].
Die Tularämie ist aus wehrmedizinischer Sicht bedeutsam, weil ihre Inzidenz in den letzten Jahren in Mitteleuropa eine steigende Tendenz aufweist und Bundeswehrangehörige in Endemieregionen dieser Zoonose exponiert sein könnten [4 - 6]. Ein erhöhtes Infektionsrisiko besteht unter Kriegsbedingungen bei massiver Zerstörung des Ökosystems und der Infrastruktur. Dies belegen Tularämie-Ausbrüche unter Soldaten, die beispielsweise während des Zweiter Weltkriegs in epidemischen Herden im Abschnitt zwischen Don und Wolga erkrankten [7]. Wir möchten mit dieser Kasuistik und der Literaturübersicht auf die Tularämie als eine bisher in Deutschland selten erkannte Ursache ungeklärten Fiebers und den diagnostischen Wert der Blutkultur hinweisen.
Fallbericht
Klinik
Ein 56-jähriger, bisher gesunder Mann aus der Nähe von Beeskow (Landkreis Oder-Spree/Brandenburg) stellte sich Mitte Juli 2013 mit akut aufgetretenem hohen Fieber, Frösteln und gerötetem Rachen beim Hausarzt vor. Die Anamnese ergab keine Hinweise auf mögliche Ursachen der Erkrankung. Unter dem Eindruck einer akuten Atemweginfektion wurde zunächst Roxithromycin verordnet. Weil nach zwei Tagen keine Besserung eintrat, und jetzt auch die Tonsillen geschwollen waren, erhielt der Patient unter der Annahme einer Streptokokken-Tonsillitis Penicillin. In Anbetracht der weiterhin anhaltenden Fieberschübe mit Schüttelfrost und des verschlechterten Allgemeinzustands erfolgte schließlich die stationäre Einweisung.
Bei Aufnahme fanden sich weder vergrößerte Lymphknoten noch Hauteffloreszenzen oder andere Anhaltspunkte als Erklärung für das Fieber. Die Labordiagnostik zeigte eine Leukozytose mit Neutrophilie (77 %) und erhöhte Werte für CRP (212 mg/l), Transaminasen und Fibrin (7,27 g/l). Im weiteren Verlauf entwickelte sich eine leichte Thrombozytose (435 Gpt/l). Zusätzliche Laboruntersuchungen und die bildgebende Diagnostik (einschließlich Echokardiografie) im Rahmen der Fokussuche waren unauffällig. Wegen Beschwerden beim Wasserlassen wurde unter dem Verdacht einer Harnwegsinfektion eine Blutkultur abgenommen und eine intravenöse Therapie mit Ciprofloxacin eingeleitet.
Mikrobiologische Diagnostik
Nach 5 Tagen gelang es, aus der Blutkultur (BACTEC™, BD, Heidelberg) auf Kochblut--Agar kleine kokkoide gramnegative Stäbchen anzuzüchten. Das Isolat wurde aufgrund des kulturellen und mikroskopischen Bildes sowie des negativen Oxidase-Tests zur Abklärung an das Institut für Mikrobiologie der Bundeswehr gesandt und dort mittels Real-time PCR als Francisella (F.) tularensis subsp. holarctica identifiziert. Damit konnte die Erkrankung als Tularämie bestätigt und der Erregernachweis nach § 7 des Infektionsschutzgesetzes (IfSG) gemeldet werden. Eine weitere Typisierung mittels MLVA-12 (Multi Locus Variable Number of Tandem Repeat Analysis) ergab, dass der Stamm zu einem genetischen Cluster gehört, der in der Region des Wohnortes des Patienten im Nordosten Deutschlands typisch ist. Auch die phänotypischen Eigenschaften des Stammes entsprachen dem endemischen Wildtyp von F. tularensis subsp. holarctica mit Empfindlichkeit gegenüber Gentamicin, Streptomycin, Ciprofloxacin, Levofloxacin, Doxycyclin und Chloramphenicol.
Verlauf
Der Zustand des Patienten besserte sich unter der Ciprofloxacin-Therapie schnell. Der weitere Krankheitsverlauf war unauffällig und er wurde nach Umstellung von intravenöser auf orale Ciprofloxacin-Therapie in die ambulante Betreuung entlassen.
Nachdem die Diagnose Tularämie bestätigt war, wurde der Patient retrospektiv hinsichtlich möglicher Infektionsquellen befragt. Er wohnte auf einem ehemaligen Bauernhof mit ungenutzten Stallgebäuden. Dort gab es auch Mäuse und Ratten, die von seinen Katzen gelegentlich gefangen, vor der Tür abgelegt und von ihm entsorgt wurden. Zudem hielt er Kaninchen und war als Waldbesitzer auch regelmäßig im Forst tätig. Er erinnerte sich auch an einen Zeckenstich, allerdings waren ihm weder ein Hautgeschwür an der Einstichstelle noch regionäre Lymphknotenschwellungen (typisch für ulzeroglanduläre oder glanduläre Tularämie) aufgefallen.
Bewertung
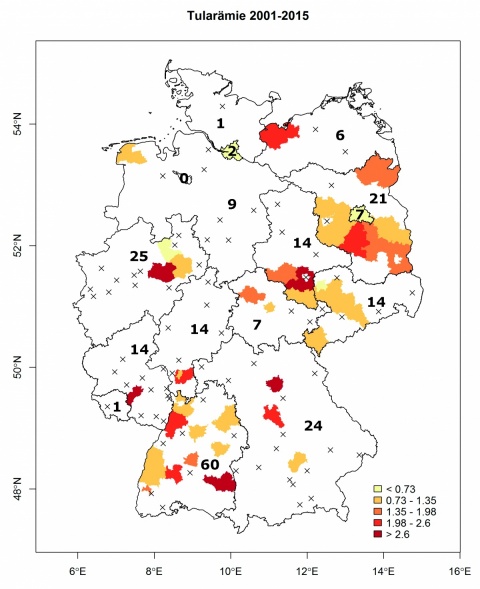
Unser Patient wohnt in einer endemischen Tularämie-Region Brandenburgs (vgl. Abbildung 4), worauf auch seroepidemiologische Untersuchungen an Füchsen hinweisen [8]. Ein konkreter Infektionsort ließ sich im vorliegenden Fall jedoch nicht endgültig ermitteln. Am ehesten ist als Infektionsquelle eine Inhalation erregerhaltigen Staubes beim Aufenthalt in den durch Nagetiere belasteten Ställen oder bei Forstarbeiten anzunehmen. Der Fall ist aber aus sanitätsdienstlicher Sicht beachtenswert, da sich in dieser Region ein Standortübungsplatz der Bundeswehr befindet. 2008 erkrankte auf einem Truppenübungsplatz im Raum Leipzig ein Berufssoldat an oropharyngealer Tularämie, vermutlich durch Aufnahme von kontaminiertem Oberflächenwasser oder Staub [9].
Diskussion
Definition der Tularämie
Die Tularämie ist eine vom Tier auf den Menschen übertragbare akute bakterielle Infektion, die bei bestimmten Säugetierarten (Hasenartige, Nager) Krankheitsausbrüche (Hasenpest) auslösen kann. Die Infektion des Menschen manifestiert sich klinisch meist an der Eintrittsstelle als Haut- oder Schleimhautgeschwür (Primäraffekt) mit oder ohne regionärer Lymphadenopathie und seltener als schwere respiratorische oder septische (typhusähnliche) Allgemeinerkrankung.
Erreger
Die Erkrankung wird durch F. tularensis hervorgerufen. Es handelt sich um gramnegative, aerob wachsende, unbewegliche, sporenlose, kokkoide bis
Humanmedizinisch bedeutsam sind die ersten drei Subspezies. Der Jellison Typ A weist eine hohe Virulenz auf und findet sich hauptsächlich in Nordamerika. F. tularensis subsp. holarctica ist dagegen in der gesamten nördlichen Hemisphäre zwischen dem 30. und 70. Breitengrad verbreitet. Diese Subspezies besitzt eine mäßige Virulenz und ist in Europa der hauptsächliche Erreger der Tularämie [11]. Das Vorkommen von F. tularensis subsp. mediasiatica beschränkt sich auf Mittelasien. Die Pathogenität von F. tularensis äußert sich in der hohen Infektiosität (perkutane und aerogene Infektionsdosis: 10 - 50 Zellen) und der fakultativ-intrazellulären Vermehrung in Phagozyten [38]. Francisellen sind sehr empfindlich gegenüber Temperaturen über 60ºC und üblichen Desinfektionsmitteln. Die Anzucht der langsam wachsenden Bakterien aus klinischem Probenmaterial erfordert Spezialnährböden mit Blut-, Eigelb- oder Cysteinzusatz [10, 38].
Epidemiologie
Reservoir
Die Tularämie ist in der Tierwelt weit verbreitet und wurde bisher bei etwa 250 Arten von Wirbeltieren und Wirbellosen nachgewiesen. Die eigentlichen Reservoire von F. tularensis subsp. holarctica in Europa sind noch weitgehend unbekannt [10, 12]. Primäre Wirte sind Lagomorphe (Wildhasen und -kaninchen), Nager (z. B. Feld-, Wald-, Haus- und Wühlmäuse, Hamster, Biber) und Kleinsäuger (z. B. Spitzmaus, Maulwurf, Eichhörnchen). Für die Zirkulation des Erregers in einem Tularämie-Naturherd sorgen zahlreiche Arten blutsaugender Insekten (Zecken, Stechmücken und -fliegen, Läuse, Flöhe, Milben) als Vektoren und zum Teil auch als Wirte bzw. Keimträger [13]. Außerdem wird F. tularensis durch direkten Kontakt, aerogen (Staub) und fäkal-oral (u. a. kontaminiertes Wasser) übertragen. Auf diese Weise können Naturherde über mehrere Jahre relativ stabil bleiben [14 - 16].
In den Naturherdzyklus sind außerdem Karnivoren (u. a. Füchse, Marderhunde), Haarwild und Wildvögel (u. a. Bussarde, Eulen), Nutz- und Haustiere
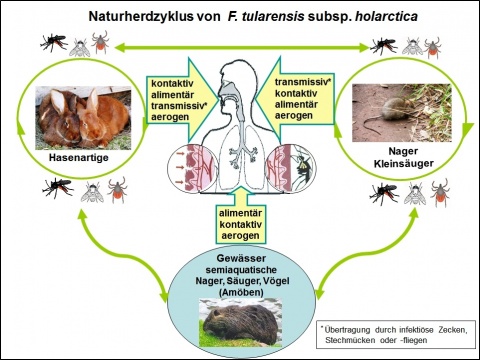
Bei hoher Dichte der Hasen- und Nagerpopulationen in endemischen Regionen der Tularämie aufgrund von zyklischer Massenvermehrung, Überangebot an Nahrung und/oder Zerstörung des Ökosystems durch Überschwemmungen oder Kriege, wie 1941/42 an der Ostfront oder 1999 im Kosovo, können Naturherde aktiviert und Epizootien sowie nachfolgend Epidemien ausgelöst werden [7, 16, 20]. Dringen kranke Tiere in menschliche Siedlungsräume ein, ist mit Kontamination der Umwelt (Boden, Gewässer, Feldfrüchte, Stroh, Heu, Trinkwasserreservoire, Lebensmittel) mit Fäzes, Urin, Speichel und Kadavern zu rechnen [20, 21]. Daraus resultiert ein Expositions- und Infektionsrisiko für den Menschen und die Gefahr von Tularämie-Epidemien, insbesondere wenn Trinkwasser- und Lebensmittelhygiene, medizinische Versorgung und Schädlingsbekämpfung unzureichend sind.
Vorkommen
Die Tularämie ist in ganz Europa und den östlich angrenzenden Staaten endemisch [19, 22]. Die höchsten Inzidenzraten in Europa finden sich im Kosovo (5,2 Fälle/100.000 Einwohner) und Skandinavien (0,4 - 2,8 Fälle/100 000 Einwohner) [13, 23, 24]. In Skandinavien stieg die mittlere Inzidenz von 1999 bis 2012 um das 10-fache an, und zwischen 1992 und 2012 trat hier allein gut die Hälfte der in Europa gemeldeten 18 343 humanen Fälle auf [19]. Berichte über Erkrankungen und Ausbrüche gibt es des Weiteren aus der Slowakei, aus Österreich, Italien, Ungarn, Frankreich, Spanien, Bulgarien und der Schweiz [12 - 14, 25, 26]. Auch in der Türkei wurden im letzten Jahrzehnt vermehrt Tularämiefälle registriert [27]. Ihre Zahl erreichte 2011 mit 2 151 Erkrankten einen Höhepunkt [13].
Immer wieder kommt es auch zu größeren Epidemien mit mehreren Hunderten Erkrankten, z. B. 2007/2008 in Spanien und der Türkei und 1999/2000, 2002
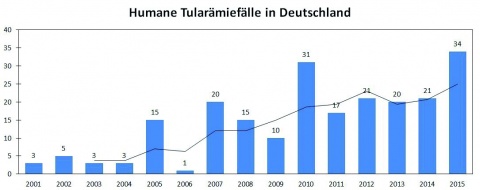
Die Inzidenz der Tularämie variiert über die Jahre, in bestimmten geografischen Regionen und innerhalb eines Jahres beträchtlich. Dies ist u. a. durch die Saisonalität dieser Zoonose und zyklische Schwankungen der Dichte von Wirts- und Vektorpopulationen bedingt. So werden die meisten Erkrankungen in Deutschland vor allem im 3. und 4. Quartal (erhöhte Zeckenaktivität bzw. Jagdsaison für Feldhasen) beobachtet. Aber grundsätzlich ist ganzjährig mit niedrigen Fallzahlen zu rechnen [5]. Die gemeldeten Erkrankungen von 2001 bis 2015 sind in Abbildung 3 dargestellt. Ihre Zahl hat seit 2004 mit 10 bis 34 Fällen pro Jahr wieder zugenommen, was zum Teil auf eine verbesserte Diagnostik zurückzuführen ist. In Abbildung 4 wird die geografische Verteilung der Tularämiefälle anhand der kumulativen Inzidenzwerte veranschaulicht. Danach ist die Tularämie über das gesamte Bundesgebiet verbreitet. Landkreise mit erhöhter endemischer Aktivität und Hotspots finden sich vor allem in Baden-Württemberg, Sachsen-Anhalt und Brandenburg. Interessanterweise sind darunter auch aus den 50er Jahren bekannte Endemiegebiete, z. B. in den damaligen Bezirken Rostock, Neubrandenburg und Potsdam sowie in den Tälern von Main und Tauber [10, 38]. Hier wurden offenbar in Wald- und Feuchtgebieten mit zahlreichen Gewässern oder Mooren durch klimatische und anthropogene Einflüsse (u. a. Natur- und Landschaftsschutz) Naturherde der Tularämie reaktiviert oder neu etabliert [15].
Die gemeldeten Erregernachweise spiegeln natürlich nur den Anteil der klinisch manifesten Tularämiefälle wider. Endemisches Niveau und potenzielles
Da der Mensch für Tularämieerreger sehr empfänglich ist, können alle Altersgruppen und beide Geschlechter betroffen sein. Das zeigt sich insbesondere bei lebensmittel- und trinkwasserbedingten Ausbrüchen [20]. Bezogen auf das zumeist sporadische Auftreten der Tularämie in Deutschland erkranken aber Kinder seltener als Erwachsene und Frauen seltener als Männer [5, 24]. Dies ist vermutlich auf eine geringere Exposition in Beruf und Freizeit zurückzuführen.
Übertragung
Die Übertragung des Erregers auf den Menschen erfolgt in einem Naturherd zufällig (Abbildung 2). Am häufigsten wird in Deutschland ein direkter Kontakt zu infizierten Wildtieren, insbesondere zu Hasen, Wildkaninchen und Nagetieren bzw. deren Ausscheidungen, Kadavern und Körperteilen berichtet [37, 55]. Dabei gelangen die Keime schon über kleinste Haut- und Schleimhautläsionen oder Verletzungen, z. B. beim Abhäuten, Ausweiden, Zerlegen und Zubereiten kranker Feldhasen, in den Organismus. Außerdem sind Infektionen durch Zecken- oder Mückenstiche bei Aufenthalt in Endemie-Regionen möglich [23, 38, 39]. Seltener werden Erkrankungen nach Biss- und Kratzverletzungen durch Katzen beobachtet, die als Freigänger durch Zecken oder Nagetiere angesteckt wurden [40 - 42]. Epidemiologisch wichtig ist der Genuss von nicht ausreichend gegartem Fleisch oder die Aufnahme von stark kontaminiertem Wasser, da dies oft zu Gruppenerkrankungen oder Explosivepidemien der Tularämie führt [9, 13, 20, 21, 33, 43]. Schließlich kann der Erreger durch Inhalation kontaminierter Stäube (Heu, Stroh, Tierfelle) und Aerosole übertragen werden [7, 23, 35, 37, 42, 44]. Laborinfektionen sind beim Umgang mit infektiösem Material und infizierten Versuchstieren möglich [10].
Aufgrund der geringen Infektionsdosis bei Ausbringung als Aerosol und der teils schweren Krankheitsverläufe wird F. tularensis subsp. tularensis als potenzieller biologischer Kampfstoff betrachtet. Allerdings könnte auch F. tularensis subsp. holarctica [10] für Terror- oder Sabotageanschläge, z. B. auf die Trinkwasserversorgung, eingesetzt werden [20]. Eine Übertragung der Tularämie von Mensch zu Mensch ist nicht bekannt. Somit sind Krankheitsverdächtige und Kranke nicht als kontagiös im Sinne des IfSG zu betrachten.
Die Tularämie wird gewöhnlich in ländlichen Gegenden erworben, in denen es Naturherde der Zoonose gibt. Daher sind hier Infektionen vorrangig auf die Jagd und Exposition gegenüber Vektoren oder Oberflächenwasser zurückzuführen. Als besonders gefährdet gelten Jäger und in der Land- und Forstwirtschaft, im Landschafts- und Gartenbau tätige Personen, daneben auch Gastwirte, Köche, Fleischer und Veterinäre [18, 33, 37, 39]. Ein gewisses Risiko kann für Soldaten entstehen, wenn sie in Naturherden, durch Nagetiere belasteten Räumlichkeiten und Gewässern eingesetzt werden [7, 9]. Im Verdachtsfall sollten daher im Rahmen der Anamnese berufliche oder sonstige Kontakte zu Hasen oder Wildkaninchen, deren Ausscheidungen und Geweben und damit kontaminierten Gebrauchsgegenständen, Nagerkontakt oder Insektenstiche erfragt werden. Von Interesse können auch Rasenmähen, Verschneiden von Büschen und Hecken, Laubbläsereinsatz, Laborarbeit, Schwimmen in Oberflächengewässern bzw. Aufenthalt in längere Zeit ungenutzten Räumlichkeiten oder in Endemie-Regionen sein [5, 46]. Sofern Tularämiefälle nur sporadisch auftreten, gelingt es aber nicht immer, Ort und Quelle der Infektion zu identifizieren.
Klinischer Verlauf
Das klinische Bild ist vielgestaltig und wird von Infektionsweg, Menge und Virulenz der Erreger sowie der Disposition des Patienten bestimmt [17, 23, 38]. Die Inkubationszeit liegt meist zwischen drei und sechs Tagen, kann aber auch zwischen 1 und 14, selten bis zu 21 Tagen betragen [10, 38]. Bei Erkrankungsbeginn klagen die Patienten meist über hohes Fieber (bis 40 ºC), Frösteln, Kopf-, Muskel- sowie Gliederschmerzen, Mattigkeit und Appetitlosigkeit sowie gelegentlich auch über geschwollene druckempfindliche Lymphknoten. Diese Symptome können sich bei Kindern verzögert entwickeln und damit die Diagnostik erschweren.
Je nach Eintrittspforte der Erreger gibt es neben asymptomatischen und subklinischen (Grippe-ähnlichen) Verläufen verschiedene klinische
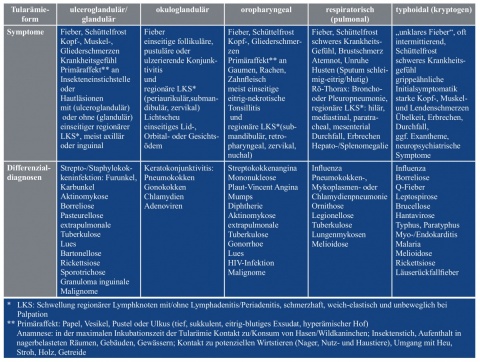
Seltener kommen die okuloglanduläre (einseitige follikuläre Konjunktivitis mit regionärer Lymphknotenschwellung), respiratorische (pulmonale) und typhoidale (typhöse, kryptogene) Tularämie vor. Die zwei letztgenannten Formen präsentieren sich als akute hoch fieberhafte Allgemeinkrankheit mit schwerem Krankheitsgefühl, Beteiligung des Atem- oder Verdauungstraktes und ausgeprägten neuropsychiatrischen Symptomen, wie Schlaf- und Bewusstseinsstörungen bis hin zu Delirien. Häufig äußert sich die typhoidale Tularämie nur durch Fieber, das unbehandelt wochenlang undulieren und mit flüchtigen Exanthemen verbunden sein kann; oft ähnelt sie einer Influenza [35, 42, 45]. Gewöhnlich fehlen Primäraffekt, Lymphadenopathien und Organmanifestationen sowie Hinweise auf die Eintrittspforte des Erregers und auf Art, Ort oder Zeitpunkt der Infektion („kryptogen“). Daher wird diese Form in praxi oft nicht oder zu spät diagnostiziert.
Komplikationen
Bei ausbleibender oder inadäquater Antibiotika-Therapie können Fieberschübe mit Nachtschweiß und Gewichtsabnahme für bis zu drei Wochen, vergrößerte Lymphknoten und neuropsychiatrische Symptome über Monate bestehen [2, 9, 34]. Mögliche Komplikationen sind z. B. Einschmelzen der betroffenen Lymphknoten und Fistelbildung, Osteomyelitis, Hepatitis; kardiale Schädigungen, Nephropathie oder Meningitis [41, 42].
Differenzialdiagnosen
Tabelle 1 zeigt eine Auswahl von Krankheiten, die bei den einzelnen Formen der Tularämie klinisch und labordiagnostisch abzugrenzen sind. Im Falle von Asylsuchenden könnte bei ulzeroglandulären Hautprozessen beispielsweise auch eine kutane Leishmaniose oder Tuberkulose und bei unklarem intermittierendem Fieber ein Läuserückfallfieber vorliegen. In bekannten Endemie-Regionen von Melioidose, Milzbrand, Pest, Rotz, Brucellose und Rickettsiosen wären diese Zoonosen ebenso in die Differenzialdiagnostik einzubeziehen.
Diagnostik
Bedingt durch ihre Seltenheit, klinische Formenvielfalt und protrahierten Verläufe wird die Tularämie außerhalb von Ausbrüchen oft erst spät (nach Wochen oder Monaten) diagnostiziert [2]. Die Ergebnisse üblicher Laboruntersuchungen sind unspezifisch und nicht wegweisend. Bei Tularämie-Verdacht werden in der Regel Untersuchungen auf spezifische Antikörper gegen F. tularensis im Serum mittels Mikroagglutination, IgG-, IgA- und IgM-ELISA oder Westernblot veranlasst [10, 48, 55]. Da diese Antikörper allerdings erst ab der 2. Krankheitswoche zuverlässig nachweisbar sind, ist bei zunächst negativem Befund eine Verlaufskontrolle nach 10 - 14 Tagen notwendig.
Eine Frühdiagnostik wird durch den Direktnachweis mittels immunologischer (ELISA, Immunfluoreszenz, Immunchromatografie) und molekularbiologischer
Bei Verdacht auf Pneumonie oder Sepsis sind Blutkulturen indiziert. Allerdings konnte F. tularensis subsp. holarctica bisher in Europa selten aus dem Blut isoliert werden [27, 43]. Eine Anzüchtung in Blutkulturen gelang nur während septischer Schübe bei Patienten mit pleuropulmonaler oder typhoidaler Tularämie [3, 27, 43, 53]. Bei ungeklärtem Fieber und Verdacht auf Bakteriämie sollten 2 bis 3, maximal 4 Blutkulturen innerhalb von 12 bis 24 Stunden angelegt und umgehend zum bakteriologischen Labor transportiert werden [54].
Therapie
Die klassischen Antibiotika zur Behandlung einer Tularämie sind Streptomycin, Gentamicin, Chloramphenicol, Ciprofloxacin und Doxycyclin [55]. Aufgrund des Nebenwirkungsprofils werden die drei erstgenannten Optionen heute nur noch selten bei schweren Fällen eingesetzt. Etabliert hat sich als First-line--Therapie die orale Gabe von Ciprofloxacin (2 x 500 mg/d) über 2 Wochen. Die Wirksamkeit dieses Ansatzes ist durch In-vitro-Tests sowie klinische Berichte belegt. Aufgrund der geringen Inzidenz der Erkrankung gibt es allerdings keine größeren kontrollierten, prospektiven Therapiestudien. Betalaktam-Antibiotika, Cotrimoxazol, Rifampicin, Makrolide und Clindamycin sind nicht geeignet. In Fällen mit massiver Lymphadenopathie und Abszessbildung ist eine Exstirpation bzw. Inzision der betroffenen Lymphknoten indiziert [24].
Prognose
Die Prognose hängt von Infektionsweg, Erregervirulenz und -menge und wirtsspezifischen Faktoren sowie Zeitpunkt der kalkulierten Antibiotika-Therapie ab. F. tularensis subsp. holarctica verursacht neben asymptomatischen Infektionen eher mildere, auch spontan ausheilende Erkrankungen [35]. Klinisch manifeste Infektionen enden selten tödlich. Sie können aber die Einsatz- und Leistungsfähigkeit der Konvaleszenten für längere Zeit erheblich einschränken [42]. Bei Infektionen durch F. tularensis subsp. tularensis beträgt dagegen die Letalitätsrate ohne adäquate Therapie bis zu 30 %. Ein verzögerter Therapiebeginn wirkt sich ungünstig auf Verlauf und Prognose aus. Die Infektion hinterlässt in der Regel eine dauerhafte Immunität, die primär auf zellulären Immunitätsfaktoren beruht.
Prophylaxe
Eine Mensch-zu-Mensch-Übertragung ist nicht bekannt, so dass Standard-Hygienemaßnahmen bei Diagnostik und Behandlung der Patienten genügen. Zur Immunisierung aus epidemiologischer Indikation oder zum Schutz des Laborpersonals werden in einigen Ländern (USA, Russland, Kasachstan) Lebendvakzine eingesetzt. Diese vermitteln für etwa fünf Jahre eine belastbare Immunität gegen typhoidale und pulmonale Tularämie und mildern den Verlauf der ulzeroglandulären Tularämie. Derartige Impfstoffe sind in Deutschland weder zugelassen noch verfügbar. In bestimmten Situationen kann eine Postexpositionsprophylaxe mit Ciprofloxacin oder Doxycyclin über 14 Tage indiziert sein.
Meldepflichten
Nach § 7 Abs. 1 Nr. 13 IfSG ist der direkte oder indirekte labordiagnostische Nachweis des Erregers bei Hinweis auf eine akute Infektion namentlich meldepflichtig. In Sachsen müssen auch Erkrankung an und Tod durch Tularämie gemeldet werden (Arztmeldung). Außerdem sind bei Tieren das Auftreten der Krankheit oder der Erregernachweis gemäß der Verordnung über meldepflichtige Tierkrankheiten zu melden.
Fazit
Fieber als Leitsymptom kann für den Truppenarzt eine besondere diagnostische Herausforderung darstellen. Grundsätzlich kommen ätiologisch mehr als 200 Erkrankungen aus den Gruppen „Infektionen“, „Malignome/Neoplasien“, „rheumatische bzw. entzündliche, nicht-infektiöse Erkrankungen“ und „sonstige Ursachen“ (z. B. medikamenteninduziertes Fieber) in Betracht [1]. Im vorliegenden Fall ließ die Symptomatik anfangs eine bakterielle Atemwegsinfektion und nach Anschwellen der Tonsillen eine Streptokokken-Tonsillitis vermuten.
Oft gelingt die Klärung eines unklaren Fiebers erst, wenn ambulante Diagnostik und kalkulierte Antibiotika-Therapie versagt haben, und eine stationäre Aufnahme erfolgt ist. Aufgrund der Anamnese, des klinischen Bildes und des Erregernachweises aus dem Blut ist anzunehmen, dass unser Patient an der seltenen typhoidalen Tularämie litt. Diese wurde vermutlich durch Inhalation der Erreger ausgelöst. Aerogene Infektionen können asymptomatisch, subklinisch oder grippeartig bzw. Typhus-ähnlich verlaufen [35]. Bei einem Tularämieausbruch nach einer Hasenjagd 2006 im Darmstadt-Dieburg-Kreis entwickelten sechs von zehn Jägern nach Inhalation eines infektiösen Aerosols eine typhoidale Tularämie [23, 37]. Fieber und grippale Symptome als einzige Anzeichen einer Infektion wurden auch während der Tularämieepidemien an der Ostfront 1941/42 am häufigsten beobachtet [7, 35, 42, 45]. Die Soldaten infizierten sich überwiegend durch kontaminierten Staub in den Unterständen, die mit Stroh ausgelegt und durch die Exkremente kranker Nager massiv verunreinigt waren. Auffallend war der hohe Anteil an symp-tomlosen Verläufen, die nur serologisch oder durch einen Tularin-Hauttest nachgewiesen werden konnten.
Sanitätsoffiziere sollten mit der Tularämie vertraut sein, um diese seltene Zoonose rechtzeitig erkennen, behandeln und als mögliche Ursache bei ungewöhnlichen Ausbrüchen von unklaren fieberhaften Erkrankungen berücksichtigen zu können.
Weitergehende Fragen zur Tularämie und Diagnostik können an das Institut für Mikrobiologie der Bundeswehr in München (www.instmikrobiobw.de) und an das Nationale Konsiliarlaboratorium am Robert Koch-Institut Berlin (www.rki.de) gerichtet werden.
Kernaussagen
- Bei unklarem Fieber ist frühzeitig eine umfassende Anamnese zu erheben, um sich über Wohn-/Aufenthaltsregion, Beruf, Freizeitaktivitäten, Reisen, Kontakt zu Tieren, Oberflächengewässer, etc.) und damit verbundene Expositionsrisiken zu orientieren.
- Im Falle anhaltenden unklaren Fiebers ohne Hautläsionen oder Lymphadenopathien, mit anamnestischen Hinweisen auf eine mögliche Exposition in endemischen Regionen und bei Unwirksamkeit von Beta-Laktam- und/oder Makrolid-Antibiotika, ist auch eine Tularämie trotz ihrer geringen Inzidenz differenzialdiagnostisch zu erwägen.
- Sofern klinische Symptome und Befunde für ein bakteriämisches oder septisches Geschehen sprechen, sollten vor Beginn der kalkulierten Antibiotika-Therapie Blutkulturen abgenommen werden.
- Die Diagnose Tularämie kann mittels serologischer, molekularbiologischer oder kultureller Verfahren in spezialisierten Laboren schnell bestätigt oder ausgeschlossen werden.
- Bei rechtzeitiger Therapie ist die Prognose in der Regel gut.
- Zur Prävention der Tularämie beim Aufenthalt oder Einsatz in bekannten oder mutmaßlich aktiven Naturherden werden folgende Maßnahmen empfohlen:
- Schutz vor blutsaugenden Insekten (imprägnierte Kleidung, Bedeckung der Haut, Insektenschutz);
- Tragen von Handschuhen beim Umgang mit Wildtieren und Nagern und Vermeiden des direkten Kontakts mit Tierkörpern, -organen, -blut, -sekreten und -ausscheidungen;
- Tragen von Atemschutz bei Staub und/oder Aerosol erzeugenden Tätigkeiten sowie bei Aufenthalt in durch Nagetiere belasteten Bereichen (Unterstände, verlassene Lager, Häuser, Schuppen, usw.);
- ausreichendes Erhitzen von Wildbret und Abkochen bzw. Desinfektion von Oberflächen- und Brunnenwasser;
- Schwimmverbot in Oberflächengewässern.
Literatur
- Handrick W, Menzel G: Fieber unklarer Genese: Definitionen, Hinweise, diagnostisches Vorgehen. Stuttgart: Wiss. Verl.-Ges; 2006.
- Robert Koch-Institut: Tularämie - eine differentialdiagnostische Herausforderung. Epidemiol Bull 2015; (46): 491 - 492.
- Weile J, Seibold E, Knabbe C, Kaufmann M, Splettstoesser W: Treatment of tularemia in patient with chronic graft-versus-host disease. Emerg Infect Dis 2013; 19 (5): 771 - 773.
- Cağlı S, Vural A, Sönmez O, Yüce I, Güney E: Tularemia: a rare cause of neck mass, evaluation of 33 patients. Eur Arch Oto-Rhino-Laryngol 2011; 268 (12): 1699 - 1704.
- Robert Koch-Institut: Tularämie - Zum Vorkommen in Deutschland. Analyse auf der Basis der Meldedaten von 1949 bis 2006. Epidemiol Bull 2007; (7): 51 - 56.
- Splettstoesser WD, Piechotowski I, Buckendahl A, et al.: Tularemia in Germany: the tip of the iceberg? Epidemiol Infect 2009; 137 (5): 736 - 743.
- Bogendörfer L, Saleck W, Kairies H: Über das Auftreten der Tularämieerkrankungen an der Ostfront. Der deutsche Militärarzt 1942; 7 (11): 669 - 673.
- Kuehn A, Schulze C, Kutzer P et al.: Tularaemia seroprevalence of captured and wild animals in Germany: the fox (Vulpes vulpes) as a biological indicator. Epidemiol Infect 2013; 141: 833 - 840.
- Capka E, Roch M, Ritter M, Stölzel U: [A 23-year-old patient with sore throat and cervical lymph node enlargement: a rare presentation of tularemia]. Internist 2010; 51 (6): 784 –787.
- Splettstoesser WD, Rakin A, Neubauer H: Francisella tularensis (Hasenpest). Hochpathogene Erreg. - Biol. Kampfstoffe Teil II, Elsevier, Urban & Fischer; 2008; 112 - 121.
- Tärnvik A, Priebe H-S, Grunow R: Tularaemia in Europe: an epidemiological overview. Scand J Infect Dis 2004; 36 (5): 350 –355.
- Kaysser P, Seibold E, Mätz-Rensing K, et al.: Re-emergence of tularemia in Germany: presence of Francisella tularensis in different rodent species in endemic areas. BMC Infect Dis 2008; 8: 157.
- Gürcan S: Epidemiology of tularemia. Balk Med J 2014; 31 (1): 3 - 10.
- Ariza-Miguel J, Johansson A, Fernández-Natal MI, et al.: Molecular investigation of tularemia outbreaks, Spain, 1997-2008. Emerg Infect Dis 2014; 20 (5): 754 - 761.
- Svensson K, Bäck E, Eliasson H, et al.: Landscape epidemiology of tularemia outbreaks in Sweden. Emerg Infect Dis 2009; 15 (12): 1937 - 1947.
- Gurycová D, Výrosteková V, Khanakah G, Kocianová E, Stanek G: Importance of surveillance of tularemia natural foci in the known endemic area of Central Europe, 1991-1997. Wien Klin Wochenschr 2001; 113 (11-12): 433 - 438.
- World Health Organisation: WHO Guidelines on Tularemia. 2007; ISBN 9789241547376.
- Kantardjiev T, Ivanov I, Velinov T, et al.: Tularemia outbreak, Bulgaria, 1997-2005. Emerg Infect Dis 2006; 12 (4): 678 - 680.
- Desvars A, Furberg M, Hjertqvist M, et al.: Epidemiology and ecology of tularemia in Sweden, 1984-2012. Emerg Infect Dis 2015; 21 (1): 32 - 39.
- Grunow R, Finke E-J: A procedure for differentiating between the intentional release of biological warfare agents and natural outbreaks of disease: its use in analyzing the tularemia outbreak in Kosovo in 1999 and 2000. Clin Microbiol Infect 2002; 8 (8): 510 - 521.
- Grunow R, Kalaveshi A, Kühn A, Mulliqi-Osmani G, Ramadani N: Surveillance of tularaemia in Kosovo, 2001 to 2010. Euro Surveill 2012; 17(28) : pii=20217. http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20217
- Leblebicioglu H, Esen S, Turan D, et al.: Outbreak of tularemia: a case-control study and environmental investigation in Turkey. Int J Infect Dis 2008; 12 (3): 265 - 269.
- Kohlmann R, Geis G, Gatermann SG: [Tularemia in Germany]. Dtsch Med Wochenschr 2014; 139 (27): 1417 - 1422.
- Dlugaiczyk J, Harrer T, Zwerina J, et al.: Oropharyngeal tularemia--a differential diagnosis of tonsillopharyngitis and cervical lymphadenitis. Wien Klin Wochenschr 2010; 122 (3-4): 110 - 114.
- D’Alessandro D, Napoli C, Nusca A, Bella A, Funari E: Human tularemia in Italy. Is it a re-emerging disease? Epidemiol Infect 2015; 143 (10): 2161 - 2169.
- Fritzsch J, Splettstoesser WD: Septic pneumonic tularaemia caused by Francisella tularensis subsp. holarctica biovar II. J Med Microbiol 2010; 59 (Pt 9): 1123 - 1125.
- Karagöz S, Kiliç S, Berk E, et al.: Francisella tularensis bacteremia: report of two cases and review of the literature. New Microbiol 2013; 36 (3): 315 - 323.
- Anda P, Segura del Pozo J, Díaz García JM, et al.: Waterborne outbreak of tularemia associated with crayfish fishing. Emerg Infect Dis 2001; 7 (3 Suppl): 575 - 582.
- Robert Koch-Institut: Neuer Tularämie-Ausbruch im Kosovo - auch Deutschland kann durch Einreisende betroffen sein. Epidemiol Bull 2015; (9): 63 - 65.
- Hestvik G, Warns-Petit E, Smith LA, et al.: The status of tularemia in Europe in a one-health context: a review. Epidemiol Infect 2015; 143 (10): 2137 - 2160.
- Mailles A, Vaillant V: 10 years of surveillance of human tularaemia in France. Euro Surveill 2014; 19(45): pii=20956. Artikel-DOI: http://dx.doi.org/10.2807/1560-7917.ES2014.19.45.20956
- Robert Koch-Institut: Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten, Robert Koch-Institut, Berlin, 2001 - 2014.
- Jenzora A, Jansen A, Ranisch H, et al.: Seroprevalence study of Francisella tularensis among hunters in Germany. FEMS Immunol Med Microbiol 2008; 53 (2): 183 - 189.
- Chitadze N, Kuchuloria T, Clark DV, et al.: Water-borne outbreak of oropharyngeal and glandular tularemia in Georgia: investigation and follow-up. Infection 2009; 37 (6): 514 - 521.
- Gaede D, Kairies H: Untersuchungen zur Epidemiologie und Diagnostik der Tularämie. Der deutsche Militärarzt 1942; 8 (1): 30 - 35.
- Yıldırım S, Turhan V, Karadenizli A, et al.: Tuberculosis or tularemia? A molecular study in cervical lymphadenitis. Int J Infect Dis 2014; 18: 47 - 51.
- Hauri AM, Hofstetter I, Seibold E, et al.: Investigating an airborne tularemia outbreak, Germany. Emerg Infect Dis 2010; 16 (2): 238 - 243.
- Grunow R, Splettstösser W, Hirsch FW, Kleemann D, Finke EJ: [Differential diagnosis of tularemia]. Dtsch Med Wochenschr 2001; 126 (14): 408 - 413.
- Hirsch FW, Kleemann D, Grunow R: [Case reports of tularemia]. Dtsch Med Wochenschr 2001; 126 (14): 393 - 394.
- Weinberg AN, Branda JA: Case records of the Massachusetts General Hospital. Case 31-2010. A 29-year-old woman with fever after a cat bite. N Engl J Med 2010; 363 (16): 1560 - 1568.
- Yuen JC, Malotky MV: Francisella tularensis osteomyelitis of the hand following a cat bite: a case of clinical suspicion. Plast Reconstr Surg 2011; 128 (1): 37e - 39e.
- Landsiedl A: Ein Beitrag zur Epidemiologie und Symptomatologie der Tularämie. Der deutsche Militärarzt 1942; 7 (10): 644 - 647.
- Provenza JM, Klotz SA, Penn RL: Isolation of Francisella tularensis from blood. J Clin Microbiol 1986; 24 (3): 453 - 455.
- Siret V, Barataud D, Prat M, et al.: An outbreak of airborne tularaemia in France, August 2004. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull 2006; 11 (2): 58 - 60.
- Holler G: Zur Symptomatologie und Diagnose der Tularämie. Der deutsche Militärarzt 1944; 9 (3): 137 - 144.
- Kohlmann R, Wolf PJ, Gatermann SG: [Pleuropulmonary tularemia in a 63-year-old hunter in Germany]. Dtsch Med Wochenschr 2014; 139 (11): 534 - 537.
- Potz-Biedermann C, Schwendemann L, Schröppel K, et al.: Ulceroglandular tularemia. J Dtsch Dermatol Ges 2011; 9 (10): 806 - 808.
- Chaignat V, Djordjevic-Spasic M, Ruettger A, et al.: Performance of seven serological assays for diagnosing tularemia. BMC Infect Dis 2014; 14:234. Artikel-DOI: http://dx.doi.org/10.1186/1471-2334-14-234
- Seibold E, Maier T, Kostrzewa M, Zeman E, Splettstoesser W: Identification of Francisella tularensis by whole-cell matrix-assisted laser desorption ionization-time of flight mass spectrometry: fast, reliable, robust, and cost-effective differentiation on species and subspecies levels. J Clin Microbiol 2010; 48 (4): 1061 - 1069.
- Svensson K, Granberg M, Karlsson L, et al.: A real-time PCR array for hierarchical identification of Francisella isolates. PloS One 2009; 4 (12): e8360.
- Vogler AJ, Birdsell D, Wagner DM, Keim P: An optimized, multiplexed multi-locus variable-number tandem repeat analysis system for genotyping Francisella tularensis. Lett Appl Microbiol 2009; 48 (1): 140 - 144.
- Georgi E, Schacht E, Scholz HC, Splettstoesser WD: Standardized broth microdilution antimicrobial susceptibility testing of Francisella tularensis subsp. holarctica strains from Europe and rare Francisella species. J Antimicrob Chemother 2012; 67 (10): 2429 - 2433.
- Hoel T, Scheel O, Nordahl SH, Sandvik T: Water- and airborne Francisella tularensis biovar palaearctica isolated from human blood. Infection 1991; 19 (5): 348 - 350.
- Handrick W: Blutkulturen - Betrachtungen aus Kostensicht. Arzneimittel-, Therapie-Kritik & Medizin und Umwelt 2014; (3): 655 - 659.
- Robert Koch-Institut: Tularämie (Hasenpest). Epidemiol Bull 2016; (12): 95 - 100.
Für die Verfasser:
Dr. Ernst-Jürgen Finke
Oberstarzt a. D.
Thornerstr. 9, 80993 München
E-Mail: [email protected]
Datum: 31.08.2016
Wehrmedizinische Monatsschrift 2016/6

