DIE ABTEILUNG VIII - WEHRPHARMAZIE IM SANITÄTSAMT
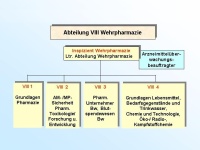
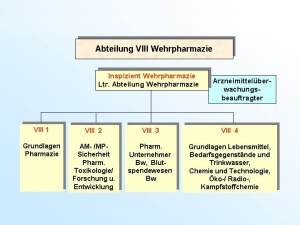
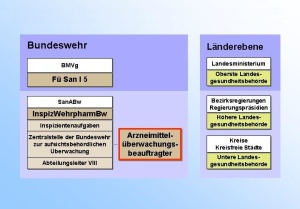
Die Abteilung VIII Wehrpharmazie ist die Arbeitsebene für den Führungsstab des Sanitätsdienstes (FüSan) im Bundesministerium der Verteidigung (BMVg) auf den Gebieten der praktischen und wissenschaftlichen Pharmazie und Lebensmittelchemie als Teilgebieten der Wehrpharmazie. Die Arbeiten orientieren sich an rechtlichen Vorgaben, die sich insbesondere aus den Gesundheits- und Verbraucherschutzgesetzen, den hierzu erlassenen Verordnungen sowie anderen, wehrpharmazeutisch relevanten Rechtsvorschriften einschließlich Richtlinien und unmittelbar geltenden Rechtsakten der Europäischen Gemeinschaft und ggf. hierzu erlassenen Verwaltungsvorschriften ergeben. Besondere Aufgaben resultieren aus der Wahrnehmung der Funktion eines pharmazeutischen Unternehmers. Die Abteilung ist in vier Dezernate gegliedert und hat eine Sollstärke von 27 Soldaten und zivilen Mitarbeitern (davon 12 Sanitätsoffiziere Apotheker), zusätzlich einen Wahrnehmungsdienstposten Sanitätsoffizier Arzt. Der Abteilungleiter VIII ist in Personalunion "Inspizient Wehrpharmazie der Bundeswehr (InspizWehrpharm Bw)". Dem Inspizienten obliegt zugleich die Funktion der Zentralstelle der Bundeswehr zur aufsichtsbehördlichen Überwachung von Arzneimitteln und Medizinprodukten", wobei die praktische Durchführung durch den Arzneimittelüberwachungsbeauftragten der Bundeswehr wahrgenommen wird.
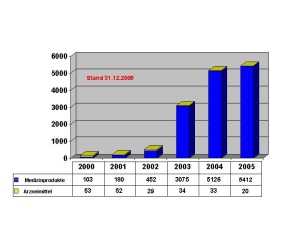
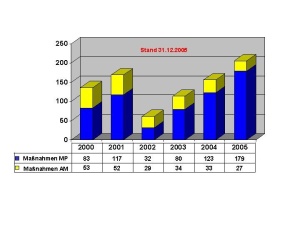
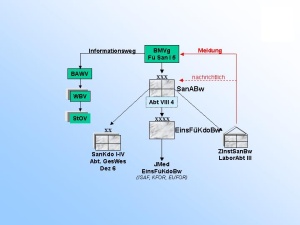
Das Dezernat VIII 1 ist auf den Gebieten des Arzneimittel-, Betäubungsmittel-, Medizinpro-dukte- und Apothekenrechtes mit der Er- und Bearbeitung grundsätzlicher Beiträge für den Bereich der Bundeswehr beauftragt. Das betrifft auch die Zuarbeit für BMVg Fü San bzw. die Umsetzung ministerieller Erlasse im Fachgebiet. Für die tägliche Arbeit bedeutet dies z.B. die Überarbeitung bzw. Erstellung zentraler Dienstvorschriften oder von Durchführungsbestimmungen im Fachgebiet wie auch die Mitarbeit bei Systemfähigkeitsforderungen und grundsätzlichen Regelungen für die Einsätze der Bundeswehr. Ein weiterer Tätigkeitsschwerpunkt liegt auf der Erarbeitung und Zusammenfassung fachli-cher Beiträge für die Personal- und Materialausstattung im eigenen wie im nachgeordneten Bereich, wie z.B. die Bearbeitung der Grundlagen der derzeitigen Personalausstattung der wehrpharmazeutischen Laborabteilungen in den Zentralen Instituten des Sanitätsdienstes der Bundeswehr (ZInstSanBw) und die Vorbereitung der örtlichen Erhebung im Sanitätsamt im Jahr 2006. Eingebracht wird die fachliche Expertise auch in die anstehende Erstellung der materiellen Ausstattungsgrundlagen der genannten Laborabteilungen. Eingebunden ist das Dezernat auch in die Erstellung fachlicher Grundlagen zu Aus-, Fort- und Weiterbildungsmaßnahmen im Fachgebiet. So werden für an der Sanitätsakademie stattfin-dende Lehrgänge im Rahmen der Überarbeitung und Aktualisierung der Lehrpläne z.B. Richt- und Grobziele formuliert und bei der Neukonzeption von Lehrgängen, wie z.B. den Lehrgän-gen SanUffzMat bzw. SanFwMat, fachliche Vorgaben eingebracht. Bei Arbeiten zur Prozessstruktur wehrpharmazeutischer Aufgaben konnte die Verankerung der Untersuchungsleistung der Fachabteilungen der Institute und der Aufgaben zur amtlichen Überwachung in den zuständigen Dezernaten der Sanitätskommandos (SanKdo) in die Pro-zessmodellierung des Hauptprozesses Gesundheitsversorgung initiiert werden. Eine neue He-rausforderung stellt die Einbindung der unterschiedlichen Qualitätssicherungssysteme im wehrpharmazeutischen Bereich in den Geschäftsprozess Qualitätssicherung im Hauptprozess Rüstung/Logistik dar. So basieren die Qualitätssicherungssysteme der öffentlich-rechtlich tätigen Dezernate der Sanitätskommandos und der Laborbereiche der Institute auf diversen zivilen Normen; für den Bereich der Arzneimittelüberwachung kommen zusätzlich Vorgaben aus dem pharmazeutischen Recht zum Tragen. Die Planung und Koordination fachlicher Lehrgänge an der Sanitätsakademie – Organisation und Leitung des Lehrgangs “Wehrpharmazeutische Fortbildung“ liegen z.B. in den Händen des Dezernatsleiters – sowie die Erarbeitung und Koordination von Beiträgen zur Darstellung des Fachgebietes, wie z.B. dem „Jahresbericht öffentlich-rechtliche Überwachung in der Wehrpharmazie“ runden die aufgezeigte Vielfalt der Aufgaben ab. (Abb. 2) Das Dezernat VIII 2 nimmt für den Bereich der Bundeswehr die fachlichen Führungsaufga-ben in den Bereichen der Arzneimittel- und Medizinproduktesicherheit, der pharmazeutischen Toxikologie und der Forschung und Entwicklung auf wehrpharmazeutischem Gebiet wahr. Eine der Hauptaufgaben ist es, als „zentrale Stelle“ der Bundeswehr für alle auftretenden Meldungen zu Arzneimittelrisiken und Medizinproduktevorkommnissen die erforderlichen Maßnahmen einzuleiten. Die Meldungen hierzu erhält das Dezernat entweder aus dem Bereich der Bundeswehr auf dem in den „Fachdienstlichen Anweisungen des Inspekteurs des Sanitätsdienstes“ festgeleg-ten Meldeweg oder durch Auswertung von Informationsquellen aus dem zivilen Bereich, wie - Warnhinweise zu Arzneimitteln, - veröffentlichte Meldungen zu Arzneimittelrisiken, z.B. unerwünschte Arzneimittel- wirkungen, - Risiken aufgrund mangelhafter pharmazeutischer Qualität, - aktuelle Informationen zu Arzneimitteln, z.B. geänderte Anwendungshinweise, - aktuelle Informationen auf dem Gebiet der Medizinprodukte, oder - Meldungen zu Vorkommnissen bei der Anwendung. Diese Meldungen werden durch das Dezernat erfasst, dokumentiert, und bzgl. ihrer Relevanz für die Bundeswehr bewertet. (Abb. 3) Je nach Bedeutung dieser Meldungen zur Abwehr von Risiken für den Bereich der Bundes-wehr werden nach einem etablierten Meldesystem entweder direkt (bei Gefahr im Verzug) oder indirekt – über die Kommandobehörden – die betroffenen Dienststellen bzw. Sanitätseinrichtungen über die einzuleitenden Maßnahmen informiert. (Abb. 4) Falls angezeigt, erfolgt in Zusammenarbeit mit dem Arzneimittelüberwachungsbeauftragten der Bundeswehr auch die Weitergabe von Informationen über beobachtete Arzneimittel-Risiken aus dem Bereich der Bundeswehr an die zivilen Überwachungsbehörden. In den Mel-deweg ist grundsätzlich das Fachreferat im Ministerium – BMVg Fü San I 5 – eingebunden, dem auch die Kontaktaufnahme zu den Bundesoberbehörden und den Bundesministerien obliegt. Ein weiterer Tätigkeitsschwerpunkt liegt in der fachlichen Zuständigkeit für die Laborabtei-lung Pharmazie des ZInstSanBw München. Hierzu gehört auch die Absteuerung von Untersu-chungsaufträgen zu Arzneimitteln und Medizinprodukten aufgrund von Meldungen aus dem Bereich der Bundeswehr. Die fachliche Bewertung der durch die Laborabteilung IV erstellten Gutachten führt zur Erarbeitung von Risikoanalysen für Arzneimittel und Medizinprodukte einschließlich einer pharmazeutisch-toxikologischen Bewertung. Zusätzlich werden Projekte im Bereich der wehrpharmazeutischen Forschung und Entwicklung - vor allem in den ZIns-tSanBw oder in den Bundeswehrkrankenhausapotheken - vom Stadium der Antragsstellung bis zum Abschluss des Projektes koordinierend und steuernd durch das Dezernat begleitet.
Das Dezernat VIII 3 “Pharmazeutischer Unternehmer, Blutspendewesen Bw“ ist mit der Wahrnehmung und Koordination der Aufgaben als Pharmazeutischer Unternehmer der Bun-deswehr beauftragt. Hierzu gehört die Umsetzung rechtlicher sowie fachlicher Rahmenbedin-gungen für den Bereich der Herstellung wehrpharmazeutisch relevanter Zubereitungen ein-schließlich Blut und Blutprodukte; diese nimmt das Dezernat z.T. in enger Abstimmung mit der Abteilung IV des Sanitätsamtes (SanABw) wahr. Mit Verabschiedung der 14. AMG-Novelle sind Tätigkeitsfelder, wie sie auch von einer Zulassungsabteilung in der pharmazeuti-schen Industrie abgedeckt werden, noch stärker in den Vordergrund gerückt. Direkte Aufgaben des Pharmazeutischen Unternehmers sind die Pflege der von der Bundes-wehr selbst gehaltenen Zulassungen für Arzneimittel und die Erstellung wesentlicher Beiträge zu Neuzulassungen. Die Bedeutung eigener Zulassungen liegt für die Bundeswehr in der Unabhängigkeit von Monopolisten, im Zugriff auf notfallmedizinisch relevante Arzneimittel, deren Herstellung für die Industrie wirtschaftlich uninteressant ist oder in der Überbrückung akuter Lieferengpässe. Mit der Einführung des Verfahrens der Hämopherese (selektive Gewinnung einzelner Blutbe-standteile) im Blutspendedienst der Bundeswehr und der Erarbeitung ergänzender Zulassun-gen für Blutprodukte zur Transfusion wird der neuen Ausrichtung der Bundeswehr Rechnung getragen.
(Abb. 5) Ein sehr wichtiger Teil der Dezernatsarbeit ist die Koordination der multinationalen Zusam-menarbeit auf dem Sektor der Arzneimittelherstellung. Aktuelle Projekte - in Zusammenarbeit mit der Abteilung IX des SanABw - sind dabei Entwicklungen eines Transdermalen Thera-peutischen Systems und eines Dreifach-Kombinationsautoinjektors zur Vorbeugung und The-rapie von Vergiftungen mit Nervenkampfstoffen. Da dieser Autoinjektor einen für den deut-schen Markt neuen Wirkstoff zur Anwendung bei Intoxikationen mit phosphororganischen Verbindungen enthalten soll, liegt in der Erarbeitung eines Dossiers zur Erlangung einer arz-neimittelrechtlichen Zulassung eine besondere fachliche Herausforderung. Abgeleitet aus der Übernahme der Verantwortung des pharmazeutischen Unternehmers wur-den die zwischenzeitlich rechtsverbindlich geforderten Qualitätssicherungshandbücher für die Herstellung von Arzneimitteln in den Bundeswehrkrankenhausapotheken und die Herstellung von Blutzubereitungen im Blutspendedienst der Bundeswehr ausgearbeitet und kontinuierlich fortgeschrieben. Ergänzend nimmt das Dezernat auch verantwortlich vielfältige Funktionen für die Eigenhers-tellung und das Inverkehrbringen von Medizinprodukten und Dermopharmazeutika wahr. Insgesamt werden 19 Fertigarzneimittel, darunter Infusions- und Injektionslösungen, feste und halbfeste Zubereitungen, sowie 27 weitere pharmazeutische Produkte durch das Sanitätsamt der Bundeswehr in Verkehr gebracht.Das Dezernat VIII 4 “Grundlagen Lebensmittel, Bedarfsgegenstände und Trinkwasser, Chemie und Technologie, Öko-, Radio- und Kampfstoffchemie“ hat als Hauptaufgabe die Wahrnehmung und Koordination fachlicher Aufgaben auf dem Gebiet der Lebensmittelsi-cherheit und des gesundheitlichen Verbraucherschutzes sowie der Chemie und Technologie von Lebensmitteln und Bedarfsgegenständen. Diese Aufgabe wird durch die Fachliche Füh-rung, Koordination und Steuerung lebensmittelchemischer Überwachungs- und Untersu-chungseinrichtungen der Bundeswehr im Zuständigkeitsbereich ergänzt. Hierunter sind zum einen die Laborabteilungen III der ZInstSanBw aber auch die Sachverständigen der Dezernate Lebensmittelchemie/Pharmazie der SanKdo zu sehen. (Abb. 6) Ein Aufgabenschwerpunkt des letzten Jahres und auch für die weitere Zukunft ist die fachli-che Begleitung der Neuordnung des Verpflegungswesens der Bundeswehr. Hier wurden in Zusammenarbeit mit der Abteilung Veterinärmedizin des SanABw Ausführungsbestimmun-gen für die “Durchführung der amtlichen Überwachung des Verkehrs mit Lebensmitteln und Bedarfsgegenständen und der Qualitätskontrolle in Wettbewerbsküchen der Bundeswehr“ erlassen. Die lebensmittelchemischen Gutachten der Sachverständigen der SanKdo werden durch das Dezernat nach einheitlichen Kriterien bewertet. Ziel ist die objektive, vergleichende Betrachtung und Bewertung der am Wettbewerb teilnehmenden Küchen. Des Weiteren werden im Dezernat fachliche Grundlagen und Vorgaben im Fachgebiet für den Einsatz erstellt sowie die Planung, Koordination und z.T. Ausbildung des Einsatzpersonals für den Laborcontainer Lebensmittelchemie / Ökochemie sowie für die „Leitenden Apotheker i.E.“ durchgeführt. Eingebunden ist das Dezernat auch in die fachliche Koordination und Steuerung der Quali-tätssicherungssysteme auf dem Gebiet der lebensmittelchemischen Überwachung. Nach den Vorgaben des Gesetzgebers müssen die öffentlich-rechtlichen Aufsichtsbehörden bis Ende 2007 ein Qualitätssicherungssystem etabliert haben. Auf der Ebene der Sanitätskommandos wird dies z.Z. aufgebaut und für eine Akkreditierung nach der DIN EN ISO/IEC 17020 vorbereitet. In Pilotfunktion ist das Dezernat 6 der Abteilung Gesundheitswesen des SanKdo I in Kiel bereits 2004 akkreditiert worden. Dem Dezernatsleiter VIII 4 obliegt die Federführung für die Vorbereitung und Durchführung der Akkreditierung der Dezernate Veterinärmedizin und Lebensmittelchemie/Pharmazie der Sanitätskommandos. Die Zuarbeit für BMVg Fü San bei der Umsetzung von Bestimmungen auf den Gebieten des Lebensmittel- und Trinkwasserrechts zeigt sich in der Erstellung bzw. Überarbeitung der bundeswehrinternen Durchführungsbestimmungen zur Trinkwasserverordnung bzw. zu dem im September 2005 in Kraft getretenen Lebensmittel- und Futtermittel-Gesetzbuch. Die Bear-beitung von TSK-/OrgBer-übergreifenden Teilkonzeptionen (z.B. Teilkonzeption Verpflegung i.E., Teilkonzeption Wasserversorgung) erfolgt in enger Abstimmung mit den veteri-närmedizinischen Sachverständigen der Abteilung VII des SanABw.
Die für die Überwachung des Verkehrs mit Arzneimitteln in der Bundeswehr zuständige oberste Behörde im Sinne des Arzneimittelgesetzes ist BMVg Fü San, Referat I 5. Die mittlere und untere Behördenebene wird durch die „Zentralstelle der Bundeswehr zur aufsichtsbehördlichen Überwachung von Arzneimitteln und Medizinprodukten“ dargestellt. Leiter dieser Stelle ist der Inspizient Wehrpharmazie; die Durchführung der Aufgaben obliegt im wesentlichen dem Arzneimittelüberwachungsbeauftragten. (Abb. 7) Dessen Aufgabenbereich umfasst im Rahmen der Eigenvollzugskompetenz die Überwachung auf der Grundlage der rechtlichen Regelungen für Arzneimittel und Medizinprodukte; das sind vor allem das Arzneimittelgesetz, das Apothekengesetz, das Betäubungsmittelgesetz sowie das Transfusionsgesetz und das Medizinproduktegesetz. Die mitunter besonderen Ver-hältnisse in der Bundeswehr werden durch den Gesetzgeber insofern berücksichtigt, dass die gesetzlichen Vorschriften „entsprechend anzuwenden sind“, wobei ein strenger Maßstab gilt. Als Hauptaufgabe resultieren daraus Abnahme und Besichtigung, bzw. Revision aller Bun-deswehrapotheken und Herstellungsbetriebe, die Entnahme von amtlichen Proben zur Untersuchung in den Zentralinstituten der Bundeswehr, die Überwachung der klinischen Prüfungen und der Eigenblutspenden in den Bundeswehrkrankenhäusern. Hinsichtlich der Medizinprodukteüberwachung erstreckt sich die Zuständigkeit auf aktive implantierbare und nicht aktive Medizinprodukte, während für aktive Medizinprodukte in der Bundeswehr andere Stellen zuständig sind. Der Arzneimittelüberwachungsbeauftragte ist weiterhin Schnittstelle zwischen Bundeswehr-dienststellen und den zivilen für die Überwachung zuständigen Stellen des Bundes und der Länder. Zunehmend aufwändiger wird die Überwachung von Einrichtungen in der Bundeswehr, die - entsprechend den Vorgaben des Herstellungserlasses - Arzneimittel großtechnisch mit einer Erlaubnis nach § 13 Arzneimittelgesetz herstellen. Dazu zählen die Laborabteilung V, Bluts-pendedienst der Bundeswehr, beim ZInstSanBw Koblenz und die neue Bundeswehrkrankenhausapotheke Ulm. Hier gilt dann die Betriebsverordnung für Pharmazeutische Unternehmer (PharmBetrV), woraus sich die Rechtverbindlichkeit der „Good Manufacturing Practices“ (GMP-Regeln) ergibt. Daraus resultieren unmittelbar auch höhere Anforderungen an die be-hördliche Überwachungstätigkeit. Eine weitere anstehende Aufgabe liegt in der Einrichtung eines Qualitätssystems Arzneimit-telüberwachung in der Bundeswehr in Anlehnung an das Qualitätssicherungssystem der Bundesländer.
Datum: 10.01.2006
Quelle: Wehrmedizin und Wehrpharmazie 2006/1