Das Referat V 1 – pharmazeutisch-fachliche Kompetenz in allen Facetten
T. Hussenether, P. Langer, C. Röseler
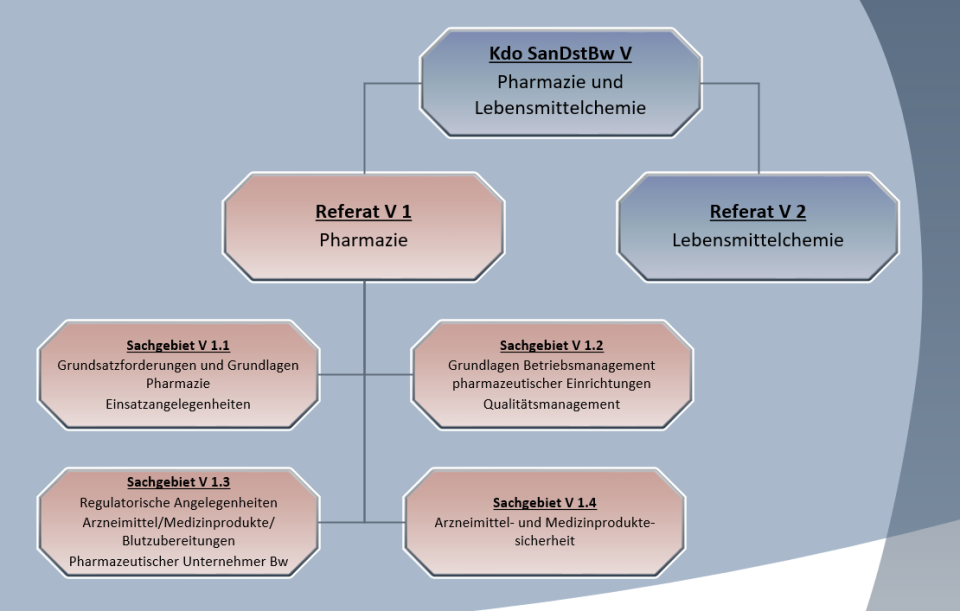
Die Unterabteilung V – Pharmazie und Lebensmittelchemie – im Kommando Sanitätsdienst der Bundeswehr (Kdo SanDstBw) wird in Personalunion vom Leitenden Apotheker der Bundeswehr geführt und untergliedert sich in die beiden Referate V 1 – Pharmazie und V 2 – Lebensmittelchemie. Sie berät den Stab des Kommandos und den unterstellten Bereich in Fragen der praktischen und wissenschaftlichen Pharmazie und Lebensmittelchemie. Darüber hinaus bildet sie in diesen Gebieten auf der ersten nachgeordneten Ebene den fachlichen „Arbeitsmuskel“ für das Bundesministerium der Verteidigung (BMVg), insbesondere für die ministeriellen Referate der Referatsgruppe Führung Streitkräfte Sanität.
Wie sich aus seiner Bezeichnung unschwer ableiten lässt, stehen im Referat V 1 die Belange der Pharmazie, die neben der Sanitätsmateriallogistik und der Lebensmittelchemie eine der drei Säulen der Wehrpharmazie darstellt, in allen Facetten im Mittelpunkt der täglichen Arbeit. In den vier Sachgebieten werden dabei mannigfaltige pharmazeutisch-fachliche Aufgaben wahrgenommen. Das Spektrum reicht von der Umsetzung der rechtlichen Vorgaben des Arzneimittel-, Apotheken-, Betäubungsmittel- und Medizinprodukterechts für den Bereich der Bundeswehr, über die Festlegung fachlicher Vorgaben für die öffentlich-rechtliche Überwachung entsprechend einer zivilen Oberbehörde, die Qualitätssicherung in pharmazeutischen Einrichtungen bis hin zur Sicherstellung der Arzneimittel- und Medizinproduktesicherheit mit übergeordneten Funktionen. In Angelegenheiten der Sicherheit von Arzneimitteln und Medizinprodukten ist das Referat auch zentrale Kontaktstelle zu den Bundesoberbehörden im Gesundheitsressort.
Besondere Aufgaben für das Referat V 1 ergeben sich zudem für die Eigenherstellung von insbesondere Arzneimitteln in der Bundeswehr und der Wahrnehmung der Funktion des Pharmazeutischen Unternehmers. Hier besteht eine Schnittstelle zu logistischen Prozessen, die sich im besonderen Maße in den ohnehin bestehenden engen Arbeitsbeziehungen des Fachreferates zu der für die Sanitätsmateriallogistik zuständigen Unterabteilung X im Kdo SanDstBw bemerkbar macht. Dieser Beitrag bietet einen Überblick über die vielschichtigen Aufgaben sowie aktuelle und fortwährende Arbeitsschwerpunkte.
Die Sachgebiete V 1.1 und V 1.2 – Pharmazeutischer Grundsatz, Öffentlich-rechtliche Aufgaben, Qualitätsmanagement
Im Sachgebiet V 1.1 werden für das Teilgebiet Pharmazie fachliche Grundlagen erarbeitet, Angelegenheiten der Weiterentwicklung, Standardisierung, Ausbildung sowie der internationalen Zusammenarbeit bearbeitet und darüber hinaus fachliche Vorgaben zur Wahrnehmung öffentlich-rechtlicher Aufgaben herausgegeben. So sind im Rahmen der sogenannten Eigenvollzugskompetenz im Auftrag des BMVg für den Bereich der Bundeswehr Festlegungen zur Durchführung der Bestimmungen des Arzneimittel-, Apotheken- und Betäubungsmittelgesetzes sowie des Medizinprodukterechts in Form von Allgemeinen Regelungen zu treffen. Zur Gewährleistung rechtskonformen Handelns in diesen Rechtsgebieten im Inland sowie im Einsatz obliegt dem Sachgebiet V 1.1 die fachliche Führung des in der Überwachungsstelle für öffentlich-rechtliche Aufgaben des Sanitätsdienstes der Bundeswehr Süd ausgebrachten Arzneimittelüberwachungsbeauftragten der Bundeswehr. Eine entsprechende Führungsverantwortung besteht zudem für die Abteilung C des Zentralen Institutes des Sanitätsdienstes der Bundeswehr in München mit dem Ziel, die für den Gesundheitsschutz der Angehörigen der Bundeswehr erforderlichen pharmazeutischen Untersuchungsleistungen sicherzustellen.
Fachliche Vorgaben für durch die Sanitätsakademie der Bundeswehr durchgeführte Lehrgänge für pharmazeutisches Personal gehören ebenso in das Spektrum des Sachgebietes wie Stellungnahmen zu Vorhaben der wehrmedizinischen Forschung mit pharmazeutischem Bezug und deren anschließende fachliche Begleitung. In diesen Tätigkeitsfeldern bildeten die Wiederaufnahme des Lehrgangs „Arzneimittelherstellung im Einsatz“, bei dem in einer Übungsapotheke unter Einsatzbedingungen die Herstellung von pharmazeutischen Produkten ausgebildet wird, nach coronabedingter Zwangspause und mit Verlegung des Ausbildungsortes von Quakenbrück nach München sowie die Überführung weiterer Lehrgänge in das neue System der „Kompetenzorientierten Ausbildung“ Arbeitsschwerpunkte im vergangenen Jahr.
Kernaufgabe des Sachgebietes V 1.2 ist die Koordinierung der Einrichtung und des Betriebs von Qualitätsmanagementsystemen in pharmazeutischen Versorgungs-, Überwachungs- und Untersuchungseinrichtungen, einschließlich deren Auditierung sowie Zertifizierung/Akkreditierung.
Herstellung für den besonderen Auftrag der Bundeswehr – Sachgebiet V 1.3
Die Umsetzung rechtlicher sowie fachlicher Rahmenbedingungen für die Herstellung von Arzneimitteln, Medizinprodukten und anderen pharmazeutischen Produkten, die unter dem Namen des Kdo SanDstBw in den Verkehr gebracht werden sollen, erfolgt im Sachgebiet V 1.3. Die Herstellung umfasst dabei in erster Linie Arzneimittel, die eine hohe Relevanz für die wehrmedizinische Einsatzversorgung besitzen. Neben Arzneimitteln mit chemisch definierten Wirkstoffen spielen hier auch Blutprodukte wie Erythrozytenkonzentrate und gefrorenes Frischplasma eine bedeutende Rolle. Die Verantwortung des Pharmazeutischen Unternehmers liegt dabei in der Festlegung der für eine sichere Anwendung dieser Arzneimittel erforderlichen Qualitätskriterien sowie im Nachweis der Wirksamkeit und Unbedenklichkeit mit den Zulassungsunterlagen, die bei den zuständigen Bundesoberbehörden, dem Bundesinstitut für Arzneimittel und Medizinprodukte bzw. dem Paul-Ehrlich-Institut, einzureichen sind.
Zusätzliche Aufgaben entstehen aus der Wahrnehmung der Pflichten als Inhaber der behördlichen Herstellungserlaubnis nach § 13 Arzneimittelgesetz für die beiden Produktionsstätten, die Bundeswehrkrankenhausapotheke (BwKrhsApotheke) Ulm und die Abteilung XXII (Transfusionsmedizin und Hämotherapie) im Bundeswehrzentralkrankenhaus Koblenz (Blutspendedienst der Bundeswehr). Dabei steht der Pharmazeutische Unternehmer der Bundeswehr bei beiden Einrichtungen vor beachtlichen Herausforderungen. Sich zügig ändernde rechtliche Vorgaben erfordern eine permanente Überprüfung und Anpassung der eigenen Verfahren. Darüber hinaus wird die BwKrhsApotheke Ulm derzeit für die künftige Autoinjektor-Herstellung ertüchtigt, was abgesehen von den umfangreichen Infrastrukturmaßnahmen und der Beschaffung neuer Maschinen, auch für die Erfüllung der regulatorischen Voraussetzungen in größerem Maßstab Kapazitäten bindet. Hierauf wird in einem weiteren Artikel in diesem Heft näher eingegangen.
Die demographische Entwicklung mit bundesweit sinkenden Spenderzahlen bei gleichzeitig steigendem Verbrauch und ein im Falle der Landes- und Bündnisverteidigung zu erwartender außerordentlich hoher Bedarf bilden wesentliche Rahmenbedingungen für die Weiterentwicklung der Eigenherstellung von Blutprodukten. Neben der Bildung einer robusten Fähigkeit zur Gewinnung und Verarbeitung größerer Mengen Spendeblut für den Krisenfall kommt hier auch der Forschung an und Weiterentwicklung von Blutprodukten unter wehrmedizinischen Aspekten ein sehr hoher Stellenwert zu. Ein Beispiel hierfür ist die Verlängerung der Haltbarkeit zellulärer Blutprodukte durch Tiefkühlung (Kryokonservierung). Dadurch soll mittelfristig ermöglicht werden, eine größere Anzahl von Blutkonserven der besonders relevanten Blutgruppen für die Einsatzversorgung bereithalten zu können. Im Bereich der Blutspende und Herstellung von Blutprodukten ist eine kontinuierliche, enge fachliche Abstimmung zwischen den Unterabteilungen II (Wehrmedizin, Humanmedizin) und V von großer Bedeutung.
In den letzten Jahren zeigen sich in Deutschland und Europa in zunehmendem Maße Lieferschwierigkeiten bis hin zu Versorgungsmangellagen bei Arzneimitteln, die bislang in ausreichender Menge sicher marktverfügbar geglaubt wurden. Die Ursachen hierfür sind vielfältig. Ein wesentlicher Grund findet sich in der Globalisierung mit Zentralisierung der Wirkstoffherstellung auf wenige, zumeist in China und Indien ansässige Unternehmen und die dadurch resultierenden Abhängigkeiten. Krisensituationen wie die Coronapandemie mit unerwartet hohem Verbrauch und eine zu geringe Flexibilität für eine kurzfristige bedarfsorientierte Anpassung der Produktionsplanungen der Pharmaindustrie haben das Bewusstsein für die teilweise sehr fragilen Lieferketten deutlich geschärft. Vor diesem Hintergrund wird die Weiterentwicklung der pharmazeutischen Großherstellung in der Bundeswehr geplant. Eine ausreichende Dimensionierung der eigenen Herstellungsfähigkeiten zur nachhaltigen Bereitstellung wehrmedizinisch besonders relevanter Produkte soll effektiv zur Sicherstellung der Einsatzfähigkeit der Bundeswehr beitragen und bildet das vorrangige Ziel der Planungen. Bei den Betrachtungen werden aber auch Möglichkeiten zur Unterstützung des zivilen Gesundheitssystems und von Partnernationen nicht außer Acht gelassen. Mit einer unter der Federführung des Referats V 1 im Kdo SanDstBw erstellten Projektskizze wurde der Grundstein für die nächsten Entwicklungsschritte gelegt, die es zielgerichtet fortzuführen gilt.
Der Sicherheit der Anwenderinnen und Anwender verpflichtet – Sachgebiet V 1.4
Einen wichtigen Beitrag für die Sicherheit von Arzneimitteln und Medizinprodukten in der Bundeswehr leistet das Sachgebiet V 1.4. Dort werden kontinuierlich die bei der Anwendung und Verwendung von Arzneimitteln und Medizinprodukten auftretenden Risiken zentral erfasst und bewertet. Über diese Risiken erlangt das Sachgebiet einerseits durch Meldungen aus der sanitätsdienstlichen Praxis zu Verdachtsfällen von Nebenwirkungen, Vorkommnissen und Qualitätsmängeln Kenntnis, die über den bundeswehrinternen Meldeweg eingehen. Andererseits führen die MitarbeiterInnen arbeitstäglich umfangreiche Recherchen in verschiedenen Medien und Datenbanksystemen durch. Folgemaßnahmen zur Risikoabwehr wie Warnhinweise und Arzneimittel- und Medizinprodukteinformationen, die durch das Sachgebiet V 1.4 veranlasst werden, sind in den Sanitätseinrichtungen hinlänglich bekannt. Darüber hinaus erfolgt die Weitergabe bekannt gewordener Risiken an die Hersteller und/oder an die zuständigen Bundesoberbehörden, wodurch ein wichtiger Beitrag zur Bewertung des Gesamtsicherheitsprofils der Produkte geleistet wird. Im Sachgebiet werden auch im Zusammenhang mit Impfungen auftretende Meldungen zu Nebenwirkungen erfasst und unter Einbezug der Fachliteratur insbesondere entsprechender Informationen der Zulassungsbehörden bewertet. Zahlreiche im Internet verbreitete, die Bevölkerung verunsichernde Falschinformationen zur Corona-Schutzimpfung, denen es beharrlich mit derart fachlich untermauerten Bewertungen entgegenzutreten gilt, zeigen die große Bedeutung dieser Tätigkeit.
Fazit
Zusammenfassend ist festzuhalten, dass das Referat V 1 mit seinen MitarbeiterInnen über weitreichende und tiefgehende Fachexpertise in der gesamten Bandbreite der Pharmazie verfügt und dadurch effizient zur ordnungsgemäßen Versorgung und zur Sicherheit im Verkehr mit Arzneimitteln und Medizinprodukten in der Bundeswehr beiträgt. Die Abbildung wesentlicher Teile der Fachlichkeit „unter einem Dach“ bildet dabei die große Stärke des Referats. Dies hat sich über viele Jahre bewährt und erlaubt es, Fragestellungen, die sich häufig nicht nur einem pharmazeutischen Teilgebiet zuordnen lassen, schnell aus unterschiedlichen Blickwickeln zu beleuchten sowie einer umfassenden, fundierten Bewertung zuzuführen.
Wehrmedizin und Wehrpharmazie 1/2023
Oberstapotheker Dr. T. Hussenether
Kommando Sanitätsdienst der Bundeswehr
Von-Kuhl-Straße 50
6070 Koblenz
E-Mail: [email protected]