Q-Fieber- eine Differentialdiagnose von Einsatzrelevanz
Aus der Klinik für Unfallchirurgie und Orthopädie, septische und rekonstruktive Chirurgie, Sporttraumatologie1 (Leitender Arzt: Oberstarzt Prof. Dr. B. Friemert) des Bundeswehrkrankenhauses Ulm (Chefarzt: Dr. A. Kalinowski), der Klinik für Anästhesie, Intensivmedizin, Notfallmedizin und Rettungsdienst2 (Leitender Arzt: Flottenarzt M. Benker) des Bundeswehrkrankenhauses Berlin (Chefarzt: Admiralarzt Dr. K. Reuther), der Klinik für diagnostische und interventionelle Radiologie3 (Leitender Arzt: Oberstarzt Dr. S. Waldeck) des Bundeswehrzentralkrankenhauses Koblenz (Chefarzt: Generalarzt Dr. J. Brandenstein), des Sanitätsversorgungszentrums Cochem4 (Leiter: Oberstarzt Dr. T. Emser) und der Klinik für Innere Medizin5 (Leitender Arzt: Oberstarzt Dr. C. Busch) des Bundeswehrkrankenhauses Hamburg (Chefarzt: Generalarzt Dr. J. Hoitz)
Zusammenfassung
Hintergrund: Coxiella burnetii ist ein in den Einsatzgebieten der Bundeswehr verbreiteter zoonotischer und obligat intrazellulärer Erreger. Das gramnegative Bakterium wird von Tieren übertragen und kann zu einer hochfieberhaften Erkrankung mit Pneumonie führen.
Fallbericht: Ein 42-jähriger Patient stellte sich aufgrund von Fieber mit Schüttelfrost, Husten und ausgeprägtem Krankheitsgefühl im „Oberstabsarzt Dr. Thomas Broer“[1]-Einsatzlazarett Mazar-e-Sharif (Afghanistan) vor. Die bildgebende Diagnostik konnte eine linksseitige Pneumonie nachweisen, ein Erregernachweis gelang zu diesem frühen Zeitpunkt nicht. Erst als die initiale empirische antibiotische Therapie nach weiterer Diagnostik um Doxycyclin erweitert wurde, kam es zu einer Verbesserung der klinischen Symptomatik und Ausheilung. Mithilfe der Serologie und der PCR wurde eine akute Coxiella burnetii-Infektion nachgewiesen: das Q-Fieber.
Fazit: Das durch Coxiella burnetii verursachte Q-Fieber ist eine mögliche Differenzialdiagnose fieberhafter Erkrankungen, insbesondere im Auslandseinsatz in Q-Fieber Endemie-Gebieten. Obwohl diese Infektionen zumeist asymptomatisch verlaufen, kommen auch schwerwiegendere Verlaufsformen mit Pneumonie, Endokarditis oder neurologischer Beteiligung vor; insbesondere die chronische Erkrankung ist gefürchtet. Die akute Infektion sollte daher nach serologischer und PCR-Diagnostik immer antibiotisch behandelt werden. Doxycyclin gilt als Mittel der Wahl.
Schlüsselwörter
Q-Fieber, Pneumonie, unklares Fieber, Coxiella burnetii, pulmonale Infiltrate, Infektionserkrankung, Auslandseinsatz
Q-fever- a differential diagnosis relevant for military missions
Summary
Background: Coxiella burnetii is a zoonotic and obligatory intracellular pathogen commonly present in operational areas of the Bundeswehr. Transmitted from mammals, the gram negative bacterium can cause a highly feverish infectious disease which often leads to pneumonia.
Case report: A 42 years old patient presented at the German “Major MC Dr. Thomas Broer”[2] field hospital in Mazar-e-Sharif (Afghanistan) complaining of fever with chills and severe malaise. Chest x-ray showed a left sided pneumonia, pathogen proof was not possible at this early stage. Empirical initial antibiotic therapy was not successful. After treatment with doxycycline the patients’ symptoms improved and the patient recovered. Finally, serological examination and PCR proved an infection with Coxiella burnetii: The patient had been suffering from Q-fever.
Conclusions: Q-fever caused by an infection with Coxiella burnetii has to be taken into account as a potentially differential diagnosis in cases of feverish illness especially on deployment in endemic areas. In most cases the infection shows an asymptomatic pattern, however, pneumonia, endocarditis and neurological effects can occur. Especially, a chronic disease must be feared. After serological and PCR diagnostics antibiotic therapy, with Doxycyclin e. g., is obligatory.
Keywords
Q-fever, pneumonia, fever of unknown origin, Coxiella burnetii, pulmonary infiltrations, infectious disease, missions abroad
Hintergrund
Mit Fieber und Husten einhergehende Erkrankungen der Atmungsorgane sind auch bei Soldatinnen und Soldaten während Auslandseinsätzen nicht selten. Das erweiterte Einsatzspektrum der Bundeswehr bringt dabei ein erhöhtes Risiko mit sich, an in Deutschland eher seltenen oder überhaupt nicht vorkommenden Infektionen zu erkranken. Insbesondere Zoonosen müssen dabei immer in die differenzialdiagnostischen Überlegungen mit einbezogen werden.
Eine sowohl in den Einsatzgebieten auf dem Balkan als auch in Afghanistan endemische Zoonose ist das durch Coxiella (C.) burnetii verursachte Q-Fieber. An einem Fallbeispiel aus dem „Oberstabsarzt Dr. Thomas Broer“-Einsatzlazarett (EinsLaz) Mazar-e-Sharif soll dieses Krankheitsbild vorgestellt und diskutiert werden.
Fallbericht
Ein 42-jähriger Niederländer stellte sich mit Fieber, Schüttelfrost, Husten und deutlichem Krankheitsgefühl in der Notaufnahme des EinsLaz Mazar-e-Sharif vor.
Anamnese
Bei Aufnahme klagte der Patient über ein seit circa 1 Woche andauerndes Fieber, welches durch den Truppenarzt zunächst unter dem Verdacht auf einen
Der Patient sei 6 Wochen vor der jetzigen Vorstellung für 10 Tage ohne Einnahme einer Malariaprophylaxe im Sudan gewesen. Dort sei er in ländlichen Gebieten mit freier Viehhaltung unterwegs gewesen, habe jedoch keinen direkten Tierkontakt gehabt. Ähnliche Reisen unternehme er bereits seit 5 Jahren, jeweils ohne medikamentöse Prophylaxe und Krankheiten. Er habe alle notwendigen Impfungen, inklusive Gelbfieberimpfung, sexuelle Risikokontakte seit seiner letzten Beziehung vor 6 Monaten wurden verneint. Der Patient hatte keine Vorerkrankungen, unterlag keiner Dauermedikation und hatte keine Allergien.
Aufnahmebefund und Initialdiagnostik
Bei Aufnahme zeigte sich der allseits orientierte Patient schwitzend und in deutlich reduziertem Allgemeinzustand; physikalische Befunde: Herzfrequenz 60/min, Blutdruck 120/56 mmHg, SpO2 93 %, T 39,8 °C, Atemfrequenz 23/min unter Einsatz der Atemhilfsmuskulatur. Es bestand ein vesikuläres Atemgeräusch beidseits, die Herztöne waren rhythmisch und rein ohne pathologische Herzgeräusche. Der abdominelle Befund war unauffällig, es bestanden keine peripheren Ödeme, periphere Pulse waren tastbar. Die arterielle Blutgasanalyse (BGA): pH 7,6, pCO2 24 mmHg, pO2 60mmHg, SO2 97 %. Der abdominelle Ultraschallbefund war unauffällig, das EKG altersentsprechend. Laborwerte: Leukozyten 6,5/nl (Norm: 4 - 10/nl), CRP 18 mg/dl (Norm: <0,5 mg/dl), PCT 0,25 ng/ml (Norm: <0,5 ng/ml), Quick 52 % (Norm: 70-130 %); Urin positiv für Eiweiß und Glucose.
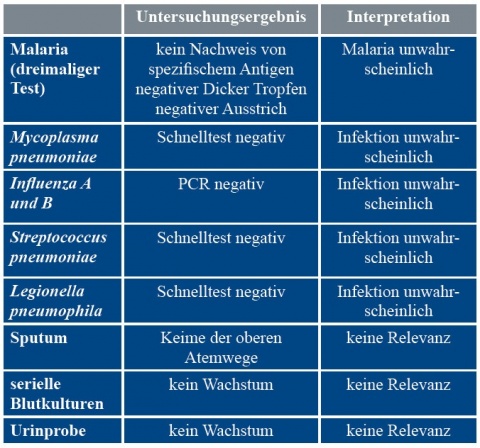
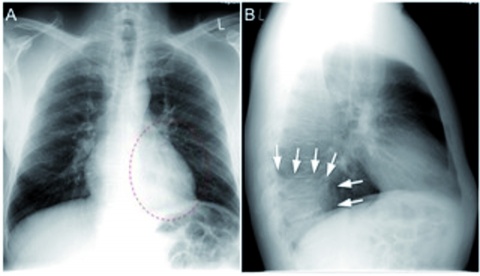
Zur Komplettierung der initialen Diagnostik wurden im Fieberschub Blutkulturen und Blutproben zur serologischen Untersuchung abgenommen. Das Röntgenbild der Lunge (Abbildung 1) zeigte ein retrocardiales Infiltrat links mit minimalem Pleuraerguss.
Arbeitsdiagnose
In Zusammenschau der klinischen, radiologischen und Laborbefunde wurde die Verdachtsdiagnose „mittelschwere Pneumonie“ gestellt und leitliniengerecht eine empirische Therapie mit Cefuroxim und Clarithromycin, letzteres zur Abdeckung der Erreger einer atypischen Pneumonie, gestartet [16]. Der Patient wurde zur weiteren Therapie stationär aufgenommen.
Verlauf
Unter der Therapie mit zusätzlicher antipyretischer Medikation kam es zunächst zu einer Verbesserung des Allgemeinzustandes. Der Patient hatte jedoch
weiterhin einen hohen Flüssigkeitsbedarf, ehe eine ausreichende Urinproduktion einsetzte. Die ersten mikrobiologischen Untersuchungsergebnisse konnten eine Infektion durch die häufigsten Erreger einer atypischen Pneumonie ausschließen (Urinprobe zum Ausschluss von Legionellen, Blutprobe zum Ausschluss einer Mykoplasmeninfektion), sodass die Behandlung mit Clarithromycin nach einem Tag beendet wurde. Bemerkenswert war zu diesem Zeitpunkt, dass der Patient weder mit einer Leukozytose, noch mit einem Anstieg des Procalcitonins (PCT) auf die Erkrankung reagierte, sondern dass das erhöhte CRP der einzige Entzündungsparameter war.Die bisherigen mikrobiologischen Ergebnisse (Tabelle 1) konnten die häufigeren Erreger einer Pneumonie zunächst nicht nachweisen, sodass in Anbetracht des unklaren klinischen Bildes die Cefuroxim-Gabe am 2. Tag zur kritischen Evaluation des weiteren Verlaufs beendet wurde. Aufgrund der Reiseanamnese wurde dreimalig eine Abklärung auf Malaria (dicker Tropfen, Ausstrich und Schnelltest) durchgeführt, die bei negativen Befunden ausgeschlossen werden konnte.
Nach Beendigung der antibiotischen Therapie kam es zu einer Verschlechterung des Allgemeinzustandes. Der Patient zeigte über 2 Tage zunehmendes Fieber, stärkste therapierefraktäre Kopfschmerzen und Dyspnoe, es kam zu peripheren Ödemen bei normalen Retentionsparametern. Das CRP und nun auch das PCT (0,85 ng/ml, Norm: <0,5 ng/ml) waren ansteigend, es bestand eine Lymphozytopenie. Eine HIV-Testung zum Ausschluss weiterer, bei einem ansonsten gesunden Mann möglichen Differenzialdiagnosen wurde vom Patienten abgelehnt.
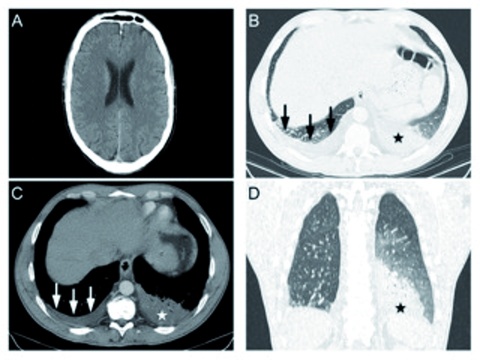
Wegen der progredienten Klinik wurde eine native Computertomographie des Schädels (Fragestellung: Infektion, Entzündung, Hirnblutung, erhöhter Hirndruck) und des Thorax (Fragestellung: Infiltrate) durchgeführt (Abbildung 2). Hierbei zeigte sich ein unauffälliger intrakranieller Befund, insbesondere kein Hirnödem, keine Zeichen eines erhöhten Hirndrucks oder einer Infektion.
Das Thorax-CT konnte mehrere pathologische Veränderungen nachweisen. So zeigten sich eine Segmentpneumonie im Segment 10 links sowie atypische Infiltrate im restlichen linken Unterlappen und rechten Ober- und Unterlappen. Die miterfassten Oberbauchorgane waren unauffällig. Durch eine Liquorpunktion konnte eine Infektion des zentralen Nervensystems ausgeschlossen werden.
Aufgrund der durchgeführten Diagnostik und des klinischen Verlaufs musste weiterhin von einer „bakteriellen Pneumonie“ ausgegangen werden. Bis zu
Unter der neuen Therapie kam es zu einer raschen Besserung der klinischen Symptomatik mit Rückgang von Kopfschmerzen, Dyspnoe und Körpertemperatur; die Entzündungsparameter fielen über die folgenden 7 Tage sukzessive bis in den Normbereich. Die antipyretische Medikation und intravenöse Flüssigkeitsgabe konnten beendet werden, Doxycyclin wurde nach 5 Tagen auf orale Gabe umgestellt. Die peripheren Ödeme waren rückläufig. Die Ceftriaxon-Gabe wurde nach 8 Tagen beendet, das orale Doxycyclin sollte bis zum 14. Tag weitergenommen werden. Der Patient konnte nach Beendigung der intravenösen Therapie nach insgesamt 13 Tagen in gutem Allgemeinzustand entlassen werden. Er kehrte anschließend in die Niederlande zurück.
Gesicherte Diagnose
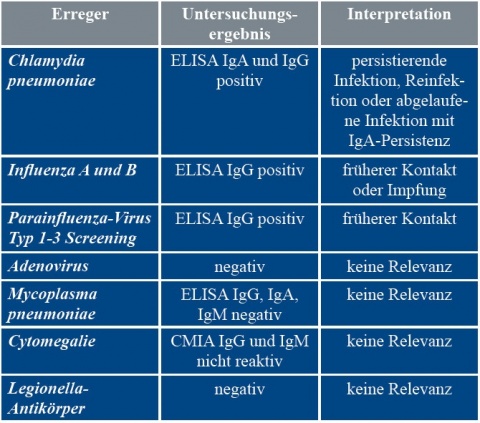
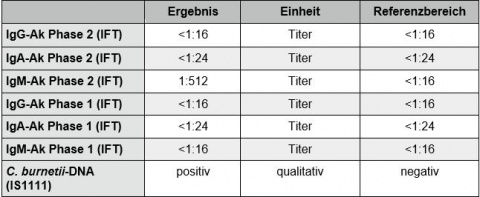
Einige Tage nach Entlassung trafen die endgültigen mikrobiologischen Befunde aus Deutschland ein (Tabelle 2): Es hatte eine akute Infektion mit Coxiella burnetii (Tabelle 3) vorgelegen. Diagnose: akutes Q-Fieber.
Diskussion
Coxiella burnetii
C. burnetii ist ein weltweit verbreiteter zoonotischer und obligat intrazellulärer Erreger. Das gramnegative Bakterium wird von Tieren übertragen, z.B. von
Schafen, Ziegen und Rindern. Die Infektion erfolgt über direkten Kontakt mit den Tieren, durch Staubaerosole, Tröpfcheninfektion, transkutan und Genuss von Rohmilchprodukten. Bereits 1 bis 10 Erreger sind für eine Infektion ausreichend [1, 2, 15]. Eine Übertragung von Mensch zu Mensch ist äußerst selten, nosokomiale Infektionen sind nicht beschrieben. Aufgrund der hohen Kontagiosität wird der Erreger in die Risikogruppe 3 eingeordnet. Früher war C. burnetii Teil der biologischen Waffenprogramme der USA und der ehemaligen Sowjetunion [1, 3].Die Coxiellen werden nach Aufnahme von Monozyten und Makrophagen phagozytiert, wo sie aufgrund des niedrigen pH-Wertes in den Phagolysosomen stoffwechselaktiv sind und sich vermehren (Verdopplungszeit: 20 – 45 h). Sie kommen dabei in verschiedenen Formen vor, wobei sie in Säugerzellen vor allem als „large cell variant“ (LCV) wachsen und umweltresistente, sporenähnliche Partikel bilden. Es kommt zur Ausbildung von 2 antigenen Formen, welche für die Antikörperantwort und damit für den serologischen Nachweis eine Bedeutung haben (Phase I und II) [1, 2].
Q-Fieber
Eine C. burnetii-Infektion führt zu einer fieberhaften Erkrankung, dem sog. Q-Fieber. Vom Verlauf her kann sie in eine akute und eine chronische Form sowie nach den Manifestationsorten eingeteilt werden. Die Inzidenz in Deutschland beträgt 1 - 5/1 000 000 Einwohner, es kommt gelegentlich zu Ausbrüchen in Schafherden [1].
Klinischer Verlauf
Nach einer Inkubationszeit von 3 – 30 Tagen kommt es bei nur 5 – 20 % der Fälle zur symptomatischen Erkrankung mit Fieber, Schweißausbrüchen,
gastrointestinalen Beschwerden sowie ausgeprägter Abgeschlagenheit [1, 4, 5]. Auffällig sind auch stärkste Kopfschmerzen, die auf Analgetika nicht ansprechen. Meist ist die Krankheit selbstlimitierend, jedoch kommt es bei bis zu 2 % zur Ausbildung einer Pneumonie, oft als Lobärpneumonie oder atypische Pneumonie imponierend. Eine Hepatitis kann ein Begleitbefund sein, diese ist an erhöhten Transaminasen zu erkennen. Auch Meningitis und Encephalitis sind möglich, dabei finden sich mononukleäre Zellen und ein erhöhter Proteingehalt im Liquor.Komplikationen
5 – 15 % der Erkrankten zeigen einen chronischen Verlauf, in dem o.g. Symptome chronifizieren und eine Endokarditis auftreten kann, 20 – 30 % entwickeln ein chronisches Müdigkeitssyndrom [1, 6]. Bei Symptomatik beträgt die Letalität 2 % [1, 7].
Diagnostik
Diagnostisch kommen serologische Untersuchungen und der PCR-Nachweis der C. burnetii-DNA zur Anwendung. Der indirekte Immunfluoreszenztest ist der Referenzstandard und wird circa 1 – 2 Wochen nach Krankheitsbeginn positiv. Auch ein Nachweis mittels ELISA oder Westernblot ist möglich. Aufgrund der diagnostischen Lücke von 1 – 3 Wochen bis zur Antikörperbildung (zunächst werden Antikörper gegen Phase II gebildet) etabliert sich zunehmend der PCR-Nachweis aus Blut [1, 2, 5, 6]. Eine Anzucht ist prinzipiell mit Spezialmedien möglich, hat jedoch aus o.g. Gründen einen nur untergeordneten Stellenwert [1, 8].
Meldepflicht
Dem Gesundheitsamt muss gemäß § 7 Abs. 1 Infektionsschutzgesetz der direkte oder indirekte Nachweis von C. burnetii, sollte er auf eine akute Infektion hinweisen, namentlich gemeldet werden.
Therapie
Bei klinischer Symptomatik wird das Q-Fieber mit Doxycyclin als Erstlinienmedikament behandelt. Die Behandlung sollte in einer Dosierung von 2 x 100 mg/Tag über 14 Tage erfolgen; im Falle einer Schwangerschaft oder sonstigen Kontraindikationen für die Doxycyclin-Gabe kann als Mittel der zweiten Wahl Cotrimoxazol 160/800 mg ebenfalls 2x täglich verwendet werden [1, 2, 6, 7, 9]. Letzteres kann auch in der Schwangerschaft oder bei Kindern unter 8 Jahren in gewichtsadaptierter Dosierung verabreicht werden [2]. Bei der chronischen Infektion muss Doxycyclin mit Hydroxychloroquin zur Alkalisierung der Phagolysosomen über mindestens 18 Monate gegeben werden [1, 2, 10]. Weitere alternative Antibiotika zur Therapie sind Makrolide, wie Azithromycin und Clarithromycin, Fluorchinolone oder Tigecyclin [1, 2].
Verlauf und Prognose
Eine Infektion mit C. burnetii verläuft zwar zumeist asymptomatisch, bei Nachweis einer akuten Infektion sollte jedoch eine antibiotische Therapie eingeleitet werden. Zum einen kommt es mit Behandlung im Durchschnitt nach 2 – 3 Tagen zum Abklingen der Krankheitssymptome und des Fiebers, wohingegen unbehandelt ein Rückgang im Mittel erst nach 12,5 Tagen zu erwarten ist [2]. Zum anderen gibt es Hinweise darauf, dass durch eine frühe Therapie Komplikationen und ein chronischer Verlauf (Risiko bei etwa 2 – 15 %) mit z.B. einer Endokarditis oder Gefäßinfektion vermieden werden können [1, 3, 6]. Es gilt, besonders die Entwicklung des Q-Fieber-Fatigue-Syndroms, das unbehandelt bei 20 – 30 % der Patienten mit einer langfristigen Aktivitätseinschränkung und damit Minderung der Einsatzfähigkeit von Soldaten auftritt, zu vermeiden [4, 6].
Bewertung des eigenen Vorgehens
Der obige Fallbericht schildert einen Patienten mit hohem Fieber aufgrund einer Pneumonie. Die definitive Diagnose war erst mit dem Nachweis von C. burnetii aus einer Blutprobe möglich. Zu dem Zeitpunkt war der Patient jedoch bereits mit einer empirischen, auch gegen Coxiellen wirksamen antibiotischen Therapie weitgehend gebessert entlassen worden.
Die Pneumonie des Patienten wurde als mittelschwer bewertet, sodass entsprechend der S3-Leitlinie für die ambulant erworbene Pneumonie - Stand 02/2016 – [16] initial die Kombination eines Cephalosporins der 2. Generation (Cefuroxim) in Kombination mit einem Makrolid (Clarithromycin) gewählt wurde. Die initiale Kombination war mit Clarithromycin gegen C. burnetii nur mäßig wirksam. Makrolide sind weiterhin keine Erstlinienantibiotika bei Q-Fieber [1, 2].
Rückblickend lässt sich die geschilderte Symptomatik sehr gut mit der Diagnose „Q-Fieber“ zur Deckung bringen. Hohes Fieber, extreme Abgeschlagenheit, therapierefraktäre Kopfschmerzen, Segmentpneumonie und zusätzlich atypische Infiltrate passen zum Vollbild der Erkrankung, wobei aber nur 2 % der Infizierten diese Manifestation entwickeln [1].
Der Infektionsweg ist nachträglich nicht zu rekonstruieren. Der geschilderte Sudanaufenthalt liegt mit 6 Wochen deutlich über der maximalen Inkubationszeit von bis zu 30 Tagen und scheidet damit als mögliche Quelle aus. Als Sicherheitsangestellter in einem Konsulat bestand jedoch auch in Afghanistan Kontakt zu potenziellen Überträgertieren [4].
Bei der häufigen Diagnose Pneumonie ist primär nicht routinemäßig von einer Infektion mit C. burnetii auszugehen. Erst bei Beschwerdepersistenz oder Versagen der initialen antibiotischen Therapie sollte das differentialdiagnostische Spektrum, wie hier geschehen, erweitert werden. Die Initiierung und das Monitoring der antibiotischen Therapie sollte sich hierbei nicht allein an Laborbefunden orientieren, entscheidend ist letztlich der klinische Eindruck.
Gerade bei Erkrankungsbeginn besteht eine diagnostische Lücke, da es erst nach 1 – 2 Wochen zur Ausbildung von Antikörpern kommt, welche dann serologisch nachgewiesen werden können. Daher hat der DNA-Nachweis mittels PCR in letzter Zeit an Bedeutung gewonnen, da hiermit eine frühere Diagnosesicherung erfolgen kann [2, 5, 6]. Im geschilderten Fall war eine Antikörperantwort mittels Immunfluoreszenztest nachweisbar, was sicherlich dem protrahierten Verlauf vor Aufnahme des Patienten in die Klinik geschuldet war.
Wehrmedizinische Relevanz
Deutsche Soldaten sind nunmehr seit Jahrzehnten im globalen Einsatz und kommen dabei regelmäßig mit Erregern und Resistenzmustern in Berührung, die in der Heimat eher selten anzutreffen sind [3, 9, 11, 12]. Die großen Konflikte der letzten Jahrhunderte haben immer wieder gezeigt, wie sehr die Einsatzfähigkeit der eigenen Kräfte durch Infektionserkrankungen gemindert werden kann [4]. Die stetigen Bemühungen mit intensiven Prophylaxe- und Präventionsmaßnahmen und effektiveren Therapien haben die Bedrohung für die Soldaten zwar geringer werden lassen, dennoch kommt es immer wieder zu Erkrankungen durch eine Vielzahl viraler, parasitärer und bakterieller Erreger. Hierbei handelt es sich oft um in Deutschland nur selten auftretende Krankheiten, sodass als erster Schritt das „Daran denken!“ einen hohen Stellenwert hat.
Aufgrund der Übertragungswege und der Umweltresistenz kommen Coxiellen in den Einsatzgebieten, wie Kosovo oder Afghanistan, vor und können eine Gesundheitsgefahr darstellen [1]. Erst im April 2016 kam es zu einem Q-Fieber Ausbruch im Kosovo mit 50 Erkrankten, wovon 35 Soldaten eine radiologisch gesicherte Pneumonie hatten und ein Soldat verstarb; dies entspricht der oben genannten Letalitätsrate [15]. Auch aus Afghanistan liegen Daten vor. So wurde bei 1,7 % der britischen Soldaten, die in der Provinz Helmand in Afghanistan eingesetzt wurden, eine Serokonversion als Zeichen einer Infektion mit C. burnetii nachgewiesen [4]. Deutlich höhere Ergebnisse mit einer Serokonversion von etwa 10 % berichten die Amerikaner aus ihren Irak-Erfahrungen [13].
Ausblick
Das EinsLaz Mazar-e-Sharif kann im mikrobiologischen Labor ein solides Methodenspektrum zum Erregernachweis mittels klassischer Anzucht, Schnelltests oder auch PCR vorweisen [1, 2, 14]. Die C. burnetii-Diagnostik kann leider (noch) nicht im Einsatzland erfolgen, das Probenmaterial muss hierfür zum Zentralen Institut des Sanitätsdienstes der Bundeswehr nach Koblenz versendet werden. Dadurch ergibt sich zusätzlich zur o.g. diagnostischen Lücke eine Zeitverzögerung in Folge der notwendigen Logistik. Aufgrund der britischen und amerikanischen Daten zur Häufigkeit sowie eigener Erfahrungen im Kosovo ist zu überlegen, zukünftig auch die PCR-Diagnostik von C. burnetii im Einsatzland zu etablieren.
Kernaussagen/Fazit
- Im Auslandseinsatz trifft man auf veränderte Erregerspektren mit teils seltenen Erregern, deren Diagnostik bekannt sein sollte.
- Bei Pneumonien sollten bei adäquater Klinik auch intrazelluläre Erreger bedacht werden.
- Das namentlich meldepflichtige Q-Fieber ist eine zu bedenkende Differenzialdiagnose bei pulmonalen Infiltraten, insbesondere im Auslandseinsatz.
- Der Nachweis einer akuten Q-Fieber-Erkrankung erfolgt durch Antikörpernachweis sowie C. burnetii-DNA-PCR.
- Q-Fieber erfordert eine antibiotische Therapie, primär mit Doxycyclin, bei Schwangeren und Kindern unter 8 Jahren mit Cotrimoxazol.
Literatur
1. Coxiella burnetii- Erreger des Q(query)-Fiebers; Bundesgesundheitsbl 2013;56: 1178 - 1190
2. Kersh GJ:, Antimicrobial therapies for Q fever. Expert Rev Anti Infect Ther 2013;11: 1207 – 1214.
3. Frangoulidis D: , Einsatz molekularer Typisierungsmethoden zur Untersuchung von Q-Fieberausbrüchen. Wehrmedizinische Monatsschrift 2012; 56(4): 90 – 95.
4. Newman ENC, Johnstone P, Bridge H et al.: Seroconversion for infectious pathogens among UK military personnel deployed to Afghanistan 2008 - 2011., Emerg Infect Dis 2014; 20: 2015 – 2021.
5. Hagenaars JCJP, Renders NH, van Petersen AS et al.: Serological follow-up in patients with aorto-iliac disease and evidence of Q fever infection. Eur J Clin Microbiol Infect Dis 2014; 33: 1407 – 1414.
6. Keijmel SP, Krijger E, Delsing CE et al.: Differentiation of acute Q fever from other infections inpatients presenting to hospitals, the Netherlands. Emerg Infect Dis 2015; 21: 1348 – 1356.
7. Shishido AA, Letiaia AG, Hartzell JD: Q Fever. US Army Med Dep J. 2016 Jan-Mar: 68 – 70.
8. Omsland A, Hackstadt T, Heinzen RA:, Bringing culture to the uncultured: Coxiella burnetii and lessons for obligate intracellular bacterial pathogens. PLOS Pathog 2013; 9(9): e1003540
9. Oltmanns K: Luftnot und Lungeninfiltrat im Auslandseinsatz- Immer eine Infektion?, Wehrmedizin und Wehrpharmazie 2011; 3: 25 – 28.
10. Kampschreur LM, Wegdeam-Blans, MCA, Wever PC et al.: Chronic Q fever diagnosis- consensus guideline versus expert opinion. Emerg Infect Dis 2015; 21: 1183 – 1188.
11. Frickmann H, Hagen RM: Bakterielle Erreger mit atypischen Resistenzmustern- ein Update. Wehrmedizinische Monatsschrift 2012; 56(10): 234 – 239.
12. H. Frickmann H, Hinz R, Ebert KP et al.: Atypisch resistente Erreger in subtropischen und tropischen Einsatzgebieten und bei Kriegsversehrten aus Krisengebieten- ein Update. Wehrmedizinische Monatsschrift 2015; 59(3): 81 – 86.
13. Anderson AD, Baker TR, Littrell AC et al.: Seroepidemiologic survey for Coxiella burnetii among hospitalized US troops deployed to Iraq. Zoonoses Public Health 2011; 58: 276 – 283.
14. Angelakis E, Mediannikov O, Stein A, Bassene H Sokhna C, Roault D: Throat swab samples for diagnosis of Q-fever, Am J.Trop Med Hyg 2014; 90(1): 147 – 148.
15. Fengler I: Hochmobile Laborfähigkeiten im Einsatz- Rapidly Deployable Outbreak Investigation Team (RDOIT) zur Aufklärung des Q-Fieberausbruchs im Kosovo im April 2016. Wehrmedizinische Monatsschrift 2016; 60(9/10): 289
16. Ewin S et al.: S3-Leitlinie: Behandlung von erwachsenen Patienten mit ambulant erworbener Pneumonie und Prävention – Update 2016 vom 21.01.2016; http://www.awmf.org/uploads/tx_szleitlinien/020-020l_S3_ambulant_erworbene_Pneumonie_Behandlung_Praevention_2016-02-2.pdf (accessed: 27.09.2016)
Manuskriptdaten
Eingereicht: 29.06.2016
Revidierte Fassung angenommen: 02.10.2016
Zitierweise
Deutsch:
Zischek C, Fürstenberg M, Schneider T, Giebel S, Engels M: Q-Fieber- eine Differentialdiagnose von Einsatzrelevanz. Wehrmedizinische Monatsschrift 2016; 60(11): XXX – YYY
Englisch:
Zischek C, Fürstenberg M, Schneider T, Giebel S, Engels M: Q-fever- a differential diagnosis relevant for military missions. Wehrmedizinische Monatsschrift 2016; 60(11): XXX – YYY
Für die Verfasser
Oberstabsarzt Dr. Christoph Zischek
Klinik für Unfallchirurgie und Orthopädie, septische und rekonstruktive Chirurgie, Sporttraumatologie
Bundeswehrkrankenhaus Ulm
Oberer Eselsberg 40, 89081 Ulm
Email: [email protected]
Eine Englische Version des Textes finden Sie hier.
An english version of this article you will find here.
[1] Das Deutsche Einsatzlazarett Mazar-e-Sharif trägt den Namen des am 15. April 2010 gefallenen Sanitätsstabsoffiziers
[2] The German field hospital in Masar-e-Sharif is named by Major Dr. Thomas Broer; he was a physician who was killed in action on 15 April 2010 in Afghanistan
Datum: 09.12.2016
Quelle: Wehrmedizinische Monatsschrift 2016/11