ENTWICKLUNG NEUER OXIME FÜR DIE THERAPIE VON VERGIFTUNGEN DURCH PHOSPHORORGANISCHE VERBINDUNGEN
Development of New Oximes for the Treatment of Poisoning by Organophosphorus Compounds
Aus dem Institut für Pharmakologie und Toxikologie der Bundeswehr, München (Leiter: Oberstarzt Priv.-Doz. Dr. H. Thiermann)
Timo Wille, Horst Thiermann und Franz Worek
Die gegenwärtig klinisch verfügbaren Oxime Obidoxim und Pralidoxim sind bei Vergiftungen mit einigen Nervenkampfstoffen nur unzureichend wirksam. Dies erfordert die Entwicklung neuer, möglichst gegenüber allen Nervenkampfstoffen wirksamer Oxime.
Aus ethischen Gründen kann die therapeutische Wirksamkeit neuer Wirkstoffe nicht in humanen Studien getestet werden und erfordert die Verwendung unterschiedlicher Invitro- und In-vivo-Modelle.
Methoden:
In-vitro-Untersuchungen von Wechselwirkungen zwischen dem primären Target der Nervenkampfstoffe, Acetylcholinesterase (AChE), Oximen und Nervenkampfstoffen sind die Basis für die Wirksamkeitsprüfung neuer Oxime und ermöglichen eine Quantifizierung von Speziesunterschieden. Durch den Einsatz von Hochdurchsatzverfahren ist es möglich, eine große Zahl neuer Verbindungen zu testen.
Ergebnisse:
Gegenwärtig werden zwei Oxime mit dem Ziel der Zulassung entwickelt: HI 6 in Deutschland und einigen weiteren Staaten und MMB-4 in den USA. Eine Auswertung von zahlreichen In-vitro- und In-vivo- Daten zeigen eine überlegene therapeutische Wirkung von HI 6 bei Vergiftungen durch verschiedene Nervenkampfstoffe.
Schlussfolgerungen:
Um weiterhin bestehende Wirksamkeitsdefizite zu kompensieren wird eine kombinierte Gabe von Obidoxim und HI 6 empfohlen.
Summary
Background:
The clinically used oximes obidoxime and pralidoxime show an insufficient therapeutic effect in poisoning by various nerve agents. This requires the development of new broad-spectrum oximes. For ethical reasons the therapeutic efficacy of new compounds cannot be tested in humans and different in vitro and in vivo models are necessary for testing.
Methods:
A detailed investigation of interactions between the primary target of nerve agents, acetylcholinesterase (AChE), oximes and nerve agents serves as a basis for the assessment of the efficacy of new oximes and enables the quantification of species differences. By using high throughput methods the testing of large numbers of novel oximes is possible.
Results:
Presently, two oximes are in advanced development: HI 6 in Germany and other countries and MMB-4 in the USA. An analysis of numerous in vitro and in vivo studies reveals a superior therapeutic effect of HI 6 in poisoning by different nerve agents.
Conclusions:
In order to compensate therapeutic gaps a combined use of obidoxime and HI 6 is recommended.
Keywords:
Nerve agents, treatment, oximes, acetylcholinesterase
1. Einführung
1.1 Bedrohung durch Organophosphate
Phosphororganische Verbindungen (im Allgemeinen als Organophosphate bezeichnet) sind eine sehr heterogene Gruppe von chemischen Verbindungen, die unterschiedliche physiko-chemische Eigenschaften und Toxizitäten aufweisen. Organophosphate finden als Pestizide eine breite Anwendung in der Landwirtschaft. Insbesondere in den USA, Südamerika und Asien werden dabei große Mengen ausgebracht. Da die Sicherheitsvorkehrungen und der Bildungsstand der ausbringenden Landarbeiter oftmals gering sind, ereignen sich dabei häufig Vergiftungen. Der weitaus größte Teil an lebensbedrohlichen Vergiftungen mit zum Teil sehr hohen Dosen ist Folge von Suizidversuchen. Insgesamt kommt es durch Vergiftungen mit Pestiziden weltweit jährlich zu circa 200 000 Todesfällen.
Eine weitaus giftigere Gruppe der Organophosphate stellen die Nervenkampfstoffe dar. Der erste Nervenkampfstoff Tabun wurde unmittelbar vor dem zweiten Weltkrieg bei der Forschung nach wirksameren Insektiziden durch den deutschen Chemiker Gerhard Schrader entwickelt [1]. In der Folgezeit wurden dann bis 1944 Soman und Sarin synthetisiert. Die Entwicklung des Nervenkampfstoffes VX erfolgte in den 1950er Jahren in Großbritannien. Seit dieser Zeit sind weltweit große Mengen an Nervenkampfstoffen hergestellt und munitioniert worden. Die deklarierten Bestände müssen gemäß des Chemiewaffenübereinkommens durch die Vertragsstaaten bis 2012 vernichtet werden. Auf Grund der großen Menge und technischer Probleme wird dieser Vorgang allerdings erst in mehreren Jahren abgeschlossen sein. Weltweit in den Fokus gerieten die Nervenkampfstoffe durch den militärisch-taktischen Einsatz im Iran-Irak-Krieg [2] und durch die terroristischen Anschläge in Matsumoto und in der Tokioter U-Bahn durch die Aum- Sekte [3], die jeweils viele Tote und Verletzte forderten. Im Jahr 2009 wurde der Einsatz des Pestizids Malathion durch Aufständische in Afghanistan gegen Schülerinnen und Studentinnen vermutet. Er konnte jedoch nicht zweifelsfrei bestätigt werden [4].
1.2 Pathophysiologie der Organophosphatvergiftung und therapeutische Grundsätze
Organophosphate wirken primär als Hemmstoffe des lebenswichtigen Enzyms Acetylcholinesterase (AChE). Eine Hemmung der AChE induziert dabei eine Anreicherung von Acetylcholin im synaptischen Spalt cholinerger Synapsen mit fortwährender Reizübertragung, die zu vielfältigen Störungen von Organfunktionen führt [5]. So bewirkt die Hemmung der AChE an muscarinergen Acetylcholinrezeptoren starkes Schwitzen, Durchfall, Bauchkrämpfen, Bradykardie, massiven Speichelfluss und eine die Atmung erschwerende Bronchorrhoe und Bronchokonstriktion. Über nicotinerge Rezeptoren ist insbesondere die Muskulatur betroffen und es entwickeln sich Faszikulationen und Muskelkrämpfe bis hin zu schwerwiegenden Muskelfunktionsstörungen. Insbesondere die Lähmung der Atemmuskulatur stellt dabei in Verbindung mit der starken Sekretion im Respirationstrakt ein unmittelbar vitales Risiko dar [6]. Eine unverzüglich mit den entsprechenden Antidoten begonnene Therapie ist essenziell für das Überleben der Betroffenen [7].
Oxime (Abb 1) und Atropin stellen seit mehreren Jahrzehnten die beiden wesentlichen Grundsäulen der Therapie von Organophosphatvergiftungen dar. Atropin bindet dabei reversibel an muscarinerge Acetylcholinrezeptoren ohne einen Reiz auszulösen und wird in aufsteigender Dosis bis zum Sistieren der cholinergen Symptome gegeben [6]. Aufgrund seines Wirkungsmechanismus ist Atropin ein rein symptomatisch wirkendes Antidot. Im Gegensatz dazu reaktivieren Oxime die durch Organophosphate gehemmte AChE und sind somit als kausal wirkende Antidote anzusehen. Dies ist vor allem von großer Bedeutung bei der Reaktivierung gehemmter AChE an nicotinergen Acetylcholinrezeptoren als Voraussetzung einer effektiven neuromuskulären Übertragung und somit der Funktion der Atemmuskulatur. Die simultane oder vorausgehende Therapie mit Atropin ist dabei die Grundlage für eine erfolgreiche Oximtherapie [8].
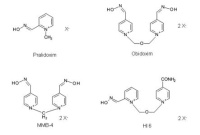
Abb 1: Strukturformeln der Oxime Pralidoxim, Obidoxim, MMB-4 und HI 6.1.3 Aktuell eingesetzte Oxime – Obidoxim und Pralidoxim
Die Entwicklung und Entdeckung der ersten Oxime geht bis in die Mitte der 1950er Jahre zurück. Unabhängig voneinander entwickelten die Amerikaner Wilson und Ginsburg [9] sowie der Brite Childs das Pralidoxim (Abb 1) [10]. Pralidoxim stellt noch heute das Standardoxim unter anderem in den amerikanischen, britischen und französischen Streitkräften dar und wird auch in zahlreichen Staaten im zivilen Bereich verwendet. Kurze Zeit später wurde von Lüttringhaus und Hagedorn in Deutschland das Obidoxim (Abb 1; Handelsname Toxogonin®) entwickelt [11]. Es bildet noch heute in Deutschland sowohl im zivilen als auch im militärischen Sektor das Standardtherapeutikum bei der Vergiftung mit Organophosphaten und ist auch in etlichen NATO-Mitgliedsstaaten das Pendant zum Pralidoxim. Pralidoxim weist eine niedrige reaktivierende Potenz und therapeutisch unzureichende Wirksamkeit bei Vergiftungen durch verschiedene Nervenkampfstoffe auf [8, 12, 13, 14]. Nach der Entdeckung von waffenfähigem Cyclosarin im ersten Golf-Krieg stellte sich heraus, dass Pralidoxim gegenüber diesem Kampfstoff weitgehend unwirksam ist [15].
Auch eine Therapie von Vergiftungen durch Organophosphat-Pestizide beziehungsweise Tabun mit Pralidoxim ist auf Grund der niedrigen Affinität gegenüber der gehemmten AChE unbefriedigend [12, 16]. In einer großen Metaanalyse zur Wirksamkeit der Pralidoximtherapie bei Pestizidvergiftungen zeigte sich kein therapeutischer Effekt im Vergleich zur Placebogruppe [17]. Dies lässt sich einerseits auf die zu niedrige Pralidoximdosis und die verzögerte Behandlung, andererseits auf die geringe reaktivierende Wirksamkeit von Pralidoxim gegen den Großteil der Pestizide zurückführen [12]. Unter Berücksichtigung der Tatsache, dass Pestizide ubiquitär verfügbar sind, muss jedoch auch ihre Verwendung zu terroristischen oder kriegerischen Zwecken insbesondere in einer asymmetrischen Kriegführung berücksichtigt werden. Deshalb besteht bei Staaten, die Pralidoxim als Antidot einsetzen, eine beträchtliche Fähigkeitslücke.
Obidoxim ist im Vergleich zu Pralidoxim bei VX, Sarin und häufig eingesetzten Pestiziden wie Paraoxon-ethyl und -methyl ein deutlich besserer Reaktivator [12]. Es zeigt von den bekannten Oximen die höchste Reaktivierungspotenz bei Tabun-gehemmter AChE. Lediglich mit einigen experimentellen Oximen kann eine höhere Reaktivierungsleistung erzielt werden. Diese Verbindungen besitzen allerdings eine hohe intrinsische Hemmaktivität gegenüber nativer AChE, die ihren therapeutischen Einsatz jedoch weitgehend unmöglich machen [18]. Obidoxim weist wie Pralidoxim eine minimale Reaktivität gegenüber Cyclosarin gehemmter AChE auf, was primär auf die geringe Affinität der beiden Oxime gegenüber dem gehemmten Enzym zurückzuführen ist. Ein Nachteil von Obidoxim gegenüber Pralidoxim ist die Bildung toxischer stabiler Phosphonyloxime in vitro. Die Bedeutung dieses Effektes in vivo ist allerdings zweifelhaft und bedarf weiterer Untersuchungen [8].
2. Methoden
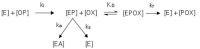
Die Wechselwirkungen zwischen der AChE, den Organophosphaten und Oximen lassen sich in vitro mit isolierter AChE verschiedener Spezies untersuchen und durch verschiedene kinetische Konstanten quantitativ beschreiben (Abb 2) [8, 9, 19]. Durch die Anlagerung von Organophosphaten (OP) an das aktive Enzym AChE (E) wird das Enzym gehemmt (EP). Dieser Vorgang wird mit der Konstante ki beschrieben. Der Komplex aus dem gehemmten Enzym (EP) kann sich spontan hydrolytisch spalten („Spontanreaktivierung“, ks). Durch eine Dealkylierungsreaktion („Alterung“; ka) wird eine Reaktivierung des gehemmten Enzyms durch Oxime unmöglich. An das gehemmte Enzym kann sich im Rahmen der Therapie das Oxim anlagern (KD) und einen Komplex aus gehemmter AChE und Oxim bilden (EPOX). In der eigentlichen Reaktivierung (kr) wird dann der Organophosphatrest unter Bildung eines Phosphonyloxims (POX) auf das Oxim übertragen. Das Enzym kann nun wieder seine physiologische Funktion aufnehmen.
Abb 2: Interaktionen von AChE, Organophosphaten und Oximen. OP: Organophosphat; E: Acetylcholinesterase (AChE); EP: gehemmte AChE; EA: gealterte AChE; EPOX: Michaelis-Komplex; POX: Phosphonyloxim; ki: Hemmkonstante; ks: Spontanreaktivierungskonstante; ka: Alterungskonstante; KD: Dissoziationskonstante; kr: Reaktivitätskonstante.Die detaillierte Kenntnis der inhibitorischen Potenz von Organophosphaten (ki), der Alterung (ka) und Spontanreaktivierung (ks) gehemmter AChE sowie der Affinität (KD) und Reaktivität (kr) von Oximen ist wesentlich, um die Wirksamkeit einer Oxim-Therapie abzuschätzen.
Geeignete Methoden zur Untersuchung kinetischer Interaktionen wurden im Institut für Pharmakologie und Toxikologie der Bundeswehr (InstPharm- ToxBw) etabliert und für die Prüfung zahlreicher Organophosphate und Oxime angewandt [8, 12, 13, 16, 18]. Mit der Entwicklung automatisierter Hochdurchsatzverfahren wird die Prüfung einer Vielzahl von AChE-, Organophosphat- und Oxim-Kombinationen möglich [29] (Abb 2). Derartige Verfahren stellen eine effektive Screeningmethode für die Vorselektion von wirksamen Verbindungen dar. Die Ergebnisse der In-vitro-Untersuchungen werden dann für die Bewertung von Ergebnissen aus Tierversuchen anderer Arbeitsgruppen verwendet und ermöglichen eine Abschätzung der Wirksamkeit von Oximen als effektive Antidote von Vergiftungen durch Nervenkampfstoffe.
Abb 3: Laborroboter: Aufbau des robotergestützten Screening-Modells Spektralphotometer mit Pipettierroboter für die automatisierte Untersuchung kinetischer Interaktionen zwischen AChE, Organophosphaten und Oximen. Abbildung aus [20].3. Ergebnisse und Diskussion
3.1 Entwicklung von Oximen
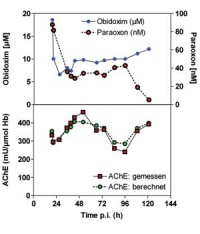
Die Entwicklung und Zulassung von neuen Oximen ist aufwendig und teuer und folglich für die Pharmaindustrie als sogenannte „orphan drugs“ wegen der niedrigen Absatzmenge unrentabel. Antidote gegen Vergiftungen durch Organophosphate werden daher nahezu ausschließlich im Auftrag der Streitkräfte entwickelt und zugelassen. Auf Grund der geringen Anzahl von Patienten mit Organophosphatintoxikationen in westlichen Ländern und der schlechten Infrastruktur in der „Dritten Welt“ ist eine Durchführung kontrollierter klinischer Studien nahezu nicht möglich. Da es starke Speziesunterschiede hinsichtlich der Reaktivierungsleistung von Oximen gibt, können Daten aus Tierversuchen nicht ohne weiteres auf den Menschen übertragen werden [21]. Deswegen wird unter anderem mit aus humanem und aus Tierblut isolierter AChE gearbeitet [22]. Mit Hilfe mathematischer Modelle können die in vitro ermittelten kinetischen Konstanten hinsichtlich ihrer Relevanz mit Invivo- Daten verglichen werden (Abb 4) [23]. Bei guter Übereinstimmung von In-vitro-und In-vivo-Daten bei verschiedenen Spezies, Organophosphaten und Oximen können die Wirksamkeit von Oximen und die erforderlichen Oxim-Dosen im Menschen weitergehend abgeschätzt werden.
Abb 4: Mathematisches Modelling: Gemessene Obidoxim- und Paraoxon- Konzentrationen im Blut (obere Teilabbildung); gemessene und berechnete AChE-Aktivitäten im Verlauf der mehrtägigen Obidoxim- Therapie (untere Teilabbildung). Hb: Hämoglobin.Die Anwendung von Computermodellen zum Abschätzen dynamischer Veränderungen der AChE-Aktivität in Anwesenheit von Organophosphaten und Oximen ist ein wesentliches Werkzeug, um die Relevanz von Ergebnissen aus Tierversuchen, vorwiegend mit Meerschweinchen [24] und Schweinen[ 25], zu bewerten. Dies ist medizinisch bedeutsam, weil beide Tierarten deutliche Unterschiede der AChE-Kinetik im Vergleich zum Menschen aufweisen [22, 26-28]. Im Laufe der letzten Jahrzehnte wurden mehr als 1 000 experimentelle Oxime entwickelt [8] und dabei im Wesentlichen drei Ansätze verfolgt:
Entwicklung möglichst hoch potenter Oxime gegen einzelne, schwer zu therapierende Nervenkampfstoffe (Cyclosarin, Soman, Tabun): Von besonderem Erkenntnisgewinn waren dabei vor allem die Synthesen homologer Reihen von Oximen, durch die sich Struktur- Wirkungsbeziehungen aufklären ließen [18].
Entwicklung eines Breitspektrum-Oxims mit einer Aktivität gegen möglichst alle relevanten Organophosphate inklusive Pestizide:
Mit dem Oxim HLö 7 gelang es 1986 Löffler, ein Therapeutikum mit breitem Wirkspektrum zu entwickeln [29]. Die Synthese von HLö 7 ist jedoch extrem schwierig, zudem ist dieses Oxim in Lösung vergleichsweise instabil. Dadurch konnten nur in geringem Umfang Untersuchungen mit HLö 7 durchgeführt werden.
Einsatz von zentralgängigen Oximen: Aktuell eingesetzte Oxime passieren auf Grund ihrer chemischen Struktur (positive Ladung, siehe Abb. 1) die Blut-Hirn-Schranke (BHS) nicht ausreichend. In einer aktuellen Studie konnte durch die Gabe von Monoisonitrosoaceton (MINA), das ebenfalls in den 1950er Jahren erstmalig synthetisiert wurde, durch Sarin gehemmte AChE im Gehirn von Versuchstieren reaktiviert werden [30]. Die Affinität dieses Oxims gegenüber gehemmter AChE ist jedoch ausgesprochen gering [31, 32] und würde den Einsatz extrem hoher Dosen erfordern. Ein anderer Ansatz beschäftigt sich mit der Kopplung von Oximen an Nanopartikel, um so ein Passieren der geladenen Oxime über die BHS zu erleichtern [33].
Nur wenige Verbindungen brachten nennenswerte Verbesserungen zu den bereits zugelassenen Oximen Obidoxim und Pralidoxim. Im Wesentlichen wird derzeit die Zulassung von zwei Oximen angestrebt. Die amerikanischen Streitkräfte betreiben die Zulassung von Meth oxim (MMB-4; Abb. 1) als Ersatz von Pralidoxim [27, 34]. MMB-4 wurde bereits 1959 synthetisiert und erstmalig getestet [35]. Die deutschen, britischen, kanadischen, niederländischen, französischen und norwegischen Streitkräften streben dagegen die Einführung von HI 6 an [34, 37], das 1968 erstmalig durch Stark und Hagedorn beschrieben wurde [36].
3.2 MMB4 und HI 6 – Vergleich der derzeit in der Zulassung befindlichen Oxime
Wirksamkeit von MMB-4 und HI 6 bei Somanvergiftungen
Die Therapie von Somanvergiftungen durch Oxime wird durch die schnelle Alterung gehemmter AChE (Halbwertszeit humaner AChE ~2 min) erschwert [19]. Diese Dealkylierungsreaktion führt dazu, dass Oxime nicht mehr in der Lage sind, das gebundene Soman von der AChE zu lösen und die Aktivität des Enzyms wieder herzustellen.
In-vitro-Untersuchungen mit humaner AChE konnten zeigen, dass HI 6 im Gegensatz zu Obidoxim und Pralidoxim initial zu einer partiellen Reaktivierung von durch Soman gehemmter AChE führt [16]. Bei direkten Vergleichsmessungen von MMB-4 mit HI 6 konnte an humaner und Affen-AChE nachgewiesen werden, dass HI 6 ein potenter Reaktivator ist [27]. In einer anderen Studie verlängerte die Gabe von HI 6 im Vergleich zu MMB-4 und Pralidoxim die Überlebenszeit von mit Soman vergifteten Primaten deutlich [38]. Dies ist von hoher Einsatzrelevanz, da die Abgabe von Antidoten in Gefechtssituationen mittels Autoinjektoren im Rahmen der Selbst- und Kameradenhilfe erfolgt. Ein initiales Überleben des Vergifteten ermöglicht es, Einrichtungen zur weiterführenden sanitätsdienstlichen Versorgung zu erreichen und führt somit zu einer verbesserten Überlebensrate nach Vergiftungen mit Soman.
Wirksamkeit von MMB-4 und HI 6 bei Cyclosarin- und Sarinvergiftungen
In einer Vielzahl der Studien mit verschiedenen In-vitro- und In-vivo-Modellen wurden Oxime hinsichtlich ihrer Wirksamkeit bei Cyclosarin- und Sarinvergiftungen verglichen. Die AChE von Pinseläffchen, Schweinen und Meerschweinchen unterschieden sich nicht wesentlich bei Versuchen mit MMB-4 als eingesetztes Oxim im Vergleich zu humaner AChE [34]. Wurde jedoch HI 6 bei Reaktivierungsversuchen mit Cyclosarin-gehemmter Meerschweinchen- und humaner AChE eingesetzt, zeigte sich ein deutlicher Speziesunterschied bei der Reaktivierung zu Gunsten der humanen AChE [22]. Diese Unterschiede auf molekularer Ebene können zumindest teilweise erklären, warum bei In-vivo-Untersuchungen, insbesondere mit Meerschweinchen als Versuchtiere, die Wirksamkeit von HI 6 bei Cyclosarinvergiftungen unterschätzt und die von MMB-4 möglicherweise überschätzt wurde [24].
Modellrechnungen mit Daten von In-vitro- Untersuchungen humaner AChE ergaben, dass zur Reaktivierung eines definierten Anteils gehemmter humaner AChE nur ein Bruchteil der von MMB-4 benötigten Konzentration an HI 6 erforderlich wäre [34]. Dies beruht auf der geringen Affinität von MMB-4 für das gehemmte Enzym. Daraus würde sich für eine etwaige Therapie eine vielfache Konzentration von MMB-4 im Vergleich zu HI 6 ableiten. Diese Ergebnisse konnten in weiteren Untersuchungen bestätigt werden (Faktor 6- bis 55- fach höher [26, 39, 40]). Sie unterstreichen noch einmal die Relevanz der ausgewählten Spezies für Untersuchungen von Reaktivierungskinetiken von Oximen in vitro und der therapeutischen Wirksamkeit von Oximen in vivo. Untersuchungen zur Wirksamkeit von MMB-4 und HI 6 bei Sarinvergiftungen konnten ebenfalls eine Überlegenheit von HI 6 gegenüber MMB-4 zeigen [34, 41].
Wirksamkeit von MMB-4 und HI 6 bei Tabunvergiftungen
Die meisten Oxime sind nur schwache Reaktivatoren von Tabun-gehemmter AChE. Dies gilt auch für die aktuell in der Zulassungsphase befindlichen Oxime MMB-4 und HI 6. HI 6 zeigte in diversen Studien keine Reaktivierung von Tabun-gehemmter AChE [42-44]. Da in einigen Studien trotzdem ein therapeutischer Effekt von HI 6 bei Tabunvergiftungen nachweisbar war [37, 45], wurde ein direkter Wirkmechanismus auf der Ebene nicotinerger Rezeptoren diskutiert [41]. Ein solcher konnte aber in einer Studie mit humaner Interkostalmuskulatur selbst mit sehr hohen HI 6- Konzentrationen nicht bestätigt werden [46]. In verschiedenen Studien war MMB-4 ein sehr schwacher Reaktivator von Tabun-gehemmter AChE sowohl in vivo als auch in vitro [26, 34, 47, 48]. Um bei Tabunvergiftungen einen therapeutischen Effekt im Sinne einer messbaren AChE-Reaktivierung zu erzielen, müssten dazu millimolare Konzentrationen an MMB-4 im Körper erreicht werden - eine Dosis bei der eine Toxizität von MMB-4 sehr wahrscheinlich ist.
Wirksamkeit von MMB-4 und HI 6 bei Vergiftungen mit Nervenkampfstoffen aus der V-Reihe
Auch bei den Untersuchungen zur Wirksamkeit von HI 6 bei VX wurde ein starker Speziesunterschied zwischen humaner, Meerschweinchenund Schweine-AChE festgestellt. Analog zu Versuchen mit Cyclosarin und HI 6 fand sich ein Unterschied bei der Reaktivierung zu Gunsten der VX-gehemmten humanen AChE, sodass gemäß Modellberechnungen deutlich höhere HI 6-Dosen bei Tieren erforderlich wären [28]. Weiterhin wurde in einem Meerschweinchenmodell festgestellt, dass MMB-4 bei VX Vergiftungen wirksamer war als HI 6 [24]. Auch hierbei war wieder ein Speziesunterschied zu beobachten, da HI 6 im Vergleich zu MMB-4 bei VX-gehemmter humaner oder Affen-AChE eine deutlich höhere Reaktivierungskonstante besaß (Faktor 15 [40] beziehungsweise 3 [39]). Ähnliche Befunde konnten für russisches VX (Faktor 13 [40] und 5,5 [26]) und chinesisches VX ermittelt werden (Faktor 5 [40]), sodass HI 6 im Vergleich zu MMB-4 beim Menschen eine überlegene Reaktivierungsleistung aufwies.
Wirksamkeit von MMB-4 und HI 6 bei Vergiftungen mit Pestiziden
Die Wirksamkeit von HI 6 bei Vergiftungen mit Pestiziden, wie zum Beispiel Paraoxon, ist unzureichend (49, 50). Die spärlichen Daten für den Einsatz von MMB-4 bei Pestizidvergiftungen erlauben bisher keine abschließende Beurteilung der diesbezüglichen Wirksamkeit. Allerdings ist aufgrund der geringen Affinität von MMB-4 gegenüber Paraoxon-gehemmter AChE zu erwarten, dass extrem hohe MMB-4-Dosen für eine wirksame Therapie erforderlich wären.
4. Schlussfolgerungen
Zusammenfassend kann festgehalten werden, dass HI 6 dem MMB-4 überlegen ist. Es stellt einen deutlichen Fortschritt bei Vergiftungen mit verschiedenen Nervenkampfstoffen dar. Insbesondere bei Vergiftungen mit Cyclosarin und russischem VX ist ein deutlich besseres Therapieergebnis zu erwarten. Dennoch muss bedacht werden, dass Obidoxim nach wie vor ein wirksames und dem HI 6 überlegenes Antidot von Tabun- und einigen Pestizidvergiftungen darstellt und nicht ohne entsprechende Wirkungseinbußen ersetzt werden kann. Um die aktuelle Fähigkeitslücke bei der Vergiftung mit Cyclosarin zu schließen und die gleichbleibende Qualität bei der Behandlung der Vergiftung durch andere Organophosphate einschließlich der Tabunintoxikation aufrechterhalten zu können, empfiehlt sich zur Erweiterung des Spektrums der kombinierte Einsatz der beiden Oxime Obidoxim und HI 6 [51].
In einer Studie konnte bereits gezeigt werden, dass die Kombination dieser Oxime sogar zu einer synergistischen Wirkung führte [13, 51]. Aufgrund der möglichen C-Gefährdung unter Einsatzbedingungen sollte ein HI 6-Kombinations-Autoinjektor bei weiterer Verwendung des Obidoxim- Kombinations-Autoinjektors zeitnah in die Bundeswehr eingeführt werden.
Literatur:
- Schrader G: Organische Phosphor-Verbindungen als neuartige Insektizide. Angew Chem 1950; 62: 471-490
- MacIlwain C: Study proves Iraq used nerve gas. NATURE 1993; 363: 3
- Suzuki T, Morita H, Ono K et al.: Sarin poisoning in Tokyo subway. Lancet 1995; 345: 980
- Winfield G: Is this it? CBRNeWORLD 2009; 6-7
- Marrs TC: Organophosphate poisoning. Pharmac Ther 1993; 58: 51-66
- Grob D: The manifestations and treatment of poisoning due to nerve gas and other organic phosphate anticholinesterase compounds. Arch Intern Med 1956; 98: 221-239
- Eyer F, Worek F, Eyer P et al.: Obidoxime in acute organophosphate poisoning: 1 - clinical effectiveness. Clin Toxicol (Phila) 2009; 47: 798-806
- Eyer P, Worek F: Oximes. In: Marrs TC, Maynard RLand Sidell FR [eds.]: Chemical Warfare Agents: Toxicology and Treatment. Chichester: John Wiley & Sons Ltd. 2007, 305-329
- Ginsburg S, Wilson IB: Oximes of the pyridine series. J Am Chem Soc 1957; 79: 481-485
- Childs AF, Davies DR, Green AL, et al.: The reactivation by oximes and hydroxamic acids of cholinesterase inhibited by organophosphorus compounds. Br J Pharmacol 1955; 10: 462-465
- Lüttringhaus A, Hagedorn I: Quartäre Hydroxyiminomethylpyridiniumsalze. Arzneim -Forsch/Drug Res 1964; 14: 1-5
- Worek F, Thiermann H, Szinicz L et al.: Kinetic analysis of interactions between human acetylcholinesterase, structurally different organophosphorus compounds and oximes. Biochem Pharmacol 2004; 68: 2237-2248
- Worek F, Eyer P, Szinicz L: Inhibition, reactivation and aging kinetics of cyclohexylmethylphosphonofluoridate-inhibited human cholinesterases. Arch Toxicol 1998; 72: 580-587
- Eyer P, Szinicz L, Thiermann H, et al.: Testing of antidotes for organophosphorus compounds: Experimental procedures and clinical reality. Toxicology 2007; 233: 108-119
- Clement JG: Efficacy of various oximes against GF (cyclohexylmethylphosphonofluoridate) poisoning in mice. Arch Toxicol 1992; 66: 143-144
- Worek F, Widmann R, Knopff O, et al.: Reactivating potency of obidoxime, pralidoxime, HI 6 and HLö 7 in human erythrocyte acetylcholinesterase inhibited by highly toxic organophosphorus compounds. Arch Toxicol 1998; 72: 237-243
- Buckley NA, Eddleston M, Li Y, et al.: Oximes for acute organophosphate pesticide poisoning. Cochrane Databasy Syst Rev 2011; CD005085:
- Wille T, Ekström F, Lee JC et al.: Kinetic analysis of interactions between alkylene-linked bis-pyridiniumaldoximes and human acetylcholinesterases inhibited by various organophosphorus compounds. Biochem Pharmacol 2010; 80: 941-946
- Talbot BG, Anderson DR, Harris LW et al.: A comparison of in vivo and in vitro rates of aging of soman- inhibited erythrocyte acetylcholinesterase in different animal species. Drug Chem Toxicol 1988; 11: 289-305
- Wille T, Thiermann H, Worek F: Development of a high-throughput screening for nerve agent detoxifying materials using a fully-automated robot-assisted biological assay. Toxicol in vitro 2010; 24: 1026-1
- Eyer P: The role of oximes in the management of organophosphorus pesticide poisoning. Toxicol Rev 2003; 22: 165-190
- Worek F, Reiter G, Eyer P et al.: Reactivation kinetics of acetylcholinesterase from different species inhibited by highly toxic organophosphates. Arch Toxicol 2002; 76: 523-529
- Worek F, Szinicz L, Eyer P et al.: Evaluation of oxime efficacy in nerve agent poisoning: development of a kinetic-based dynamic model. Toxicol Appl Pharmacol 2005; 209: 193-202
- Shih TM, Skovira JW, O'Connell JC et al.: Evaluation of nine oximes on in vivo reactivation of blood, brain, and tissue cholinesterase activity inhibited by organophosphorus nerve agents at lethal dose. Toxicol Mech Meth 2009; 19: 386-400
- Petroianu G, Hardt F, Toomes M et al.: High-dose intravenous paraoxon exposure does not cause organophosphate-induced delayed neuropathy (OPIDN) in mini pigs. J Appl Toxicol 2001; 21: 263-268
- Luo C, Tong M, Chilukuri N et al.: An In Vitro comparative study on the reactivation of nerve agent-inhibited guinea pig and human acetylcholinesterases by oximes. Biochemistry 2007; 46: 11771-11779
- Luo C, Tong M, Maxwell DM et al.: Comparison of oxime reactivation and aging of nerve agent-inhibited monkey and human acetylcholinesterases. Chem Biol Interact 2008; 175: 261-266
- Aurbek N, Thiermann H, Szinicz L et al.: Application of kinetic-based computer modelling to evaluate the efficacy of HI 6 in percutaneous VX poisoning. Toxicology 2006; 224: 74-80
- Löffler M Quartäre Salze von Pyridin-2,4-Dialdoxim als Gegenmittel für Organophosphatvergiftungen. Albert Ludwigs Universität, 1986.
- Shih TM, Skovira JW, O'Connell JC et al.: Treatment with tertiary oximes prevents seizures and improves survival following sarin intoxication. J Mol Neurosci 2010; 40: 63-69
- Davies DR, Green AL: The kinetics of reactivation, by oximes, of cholinesterase inhibited by organophosphorus compounds. Biochem J 1956; 63: 529-535
- Worek F, Thiermann H: Reactivation of organophosphate-inhibited human acetylcholinesterase by isonitrosoacetone (MINA): A kinetic analysis. Chem Biol Interact 2011; in press:
- Wagner S, Kufleitner J, Zensi A et al.: Nanoparticulate transport of oximes over an in vitro blood-brain barrier model. PLoS One 2010; 5: e14213
- Worek F, Wille T, Aurbek N, et al. Reactivation of organophosphate-inhibited human, Cynomolgus monkey, swine and guinea pig acetylcholinesterase by MMB-4: a modified kinetic approach. Toxicol Appl Pharmacol 2010; 249: 231-237
- Hobbiger F, Sadler PW: Protection against lethal organophosphate poisoning by quaternary pyridine aldoximes. Br J Pharmacol 1959; 14: 192-201
- Stark I: Versuche zur Darstellung eines LüH6 (Toxogonin) überlegenen Acetylcholinesterasereaktivators. Albert Ludwigs Universität, 1968.
- Lundy PM, Raveh L, Amitai G: Development of the bisquaternary oxime HI-6 toward clinical use in the treatment of organophosphate nerve agent poisoning. Toxicol Rev 2006; 25: 231-243
- Olson CT, Menton R, Kiser RC et al.: Characterization of soman toxicity in atropine and oxime (HI-6 and MMB-4) treated Rhesus monkeys. Defense Technical Information Center, 1991.
- Luo C, Chambers C, Pattabiraman N et al.: Y124 at the peripheral anionic site is important for the reactivation of nerve agent-inhibited acetylcholinesterase by H oximes. Biochem Pharmacol 2010; 80: 1427-1436
- Aurbek N, Thiermann H, Szinicz L et al.: Analysis of inhibition, reactivation and aging kinetics of highly toxic organophosphorus compounds with human and pig acetylcholinesterase. Toxicology 2006; 224: 91-99
- Lundy PM, Hamilton MG, Sawyer TW et al.: Comparative protective effects of HI-6 and MMB-4 against organophosphorous nerve agent poisoning. Toxicology 2011; 285: 90-96
- Clement JG: HI-6: reactivation of central and peripheral acetylcholinesterase following inhibition by soman, sarin and tabun in vivo in the rat. Biochem Pharmacol 1982; 31: 1283-1287
- de Jong LPA, Verhagen AAV, Langenberg JP et al.: The bispyridinium-dioxime HLö-7: A potent reactivator for acetylcholinesterase inhibited by the stereoisomers of tabun and soman. Biochem Pharmacol 1989; 38: 633-640
- Ekström F, Pang YP, Boman M et al.: Crystal structures of acetylcholinesterase in complex with HI-6, Ortho-7 and obidoxime: Structural basis for differences in the ability to reactivate tabun conjugates. Biochem Pharmacol 2006; 72: 597-607
- Hamilton MG, Lundy PM: HI-6 therapy of soman and tabun poisoning in primates and rodents. Arch Toxicol 1989; 63: 144-149
- Seeger T, Niessen KV, Langer P et al.: Restoration of nerve agent inhibited muscle force production in human intercostal muscle strips with HI 6. Toxicol Lett 2011; 206: 72-76
- Sevelova L, Vachek J: Effect of methoxime combined with anticholinergic, anticonvulsant or anti-HCN drugs in tabun-poisoned mice. Acta Med 2003; 46: 109-112
- Worek F, Aurbek N, Koller M et al.: Kinetic analysis of reactivation and aging of human acetylcholinesterase inhibited by different phosphoramidates. Biochem Pharmacol 2007; 73: 1807-1817
- Worek F, Kirchner T, Bäcker M et al.: Reactivation by various oximes of human erythrocyte acetylcholinesterase inhibited by different organophosphorus compounds. Arch Toxicol 1996; 70: 497-503
- Luo C, Leader H, Radic et al.: Two possible orientations of the HI-6 molecule in the reactivation of organophosphate-inhibited acetylcholinesterase. Biochem Pharmacol 2003; 66: 387-392
- Worek F, Aurbek N, Thiermann H: Reactivation of organophosphate-inhibited human AChE by combinations of obidoxime and HI 6 in vitro. J Appl Toxicol 2007; 27: 582-588
Datum: 15.02.2012
Quelle: Wehrmedizinische Monatsschrift 2011/12