Update: Melatonin – Aspekte der Chronobiologie, der onkostatischen und antioxidativen Wirkung
Aus dem Institut für Allgemeinmedizin (Geschäftsführender Direktor: Prof. Dr. S. Gesenhues) des Universitätsklinikums Essen (Ärztlicher Direktor und Vorstandsvorsitzender: Prof. Dr. J. A. Werner), Universität Duisburg – Essen
Zusammenfassung
Das Hormon Melatonin wird in der Epiphyse synthetisiert. Es sind nur einige wenige physiologische Funktionen von Melatonin beim Menschen belegt.
Diese Übersicht befasst sich mit der Melatoninsynthese und dem Melatoninstoffwechsel, dem Vorkommen von Melatonin, Aspekten der Chronobiologie und einem möglichen Zusammenhang zwischen Melatonin und zirkadianer Rhythmik. Ferner werden ein möglicher Einfluss auf Hormone und das Reproduktionsverhalten sowie eine mögliche onkostatische und antioxidative Wirkung diskutiert.
Stichworte: Zirkadianer Rhythmus, Melatoninstoffwechsel, Nachtarbeit, Zeitzonen, Tumortherapie
Keywords: circadian rhythm, melatonin metabolism, night work, time zones, tumor therapy
Einleitung
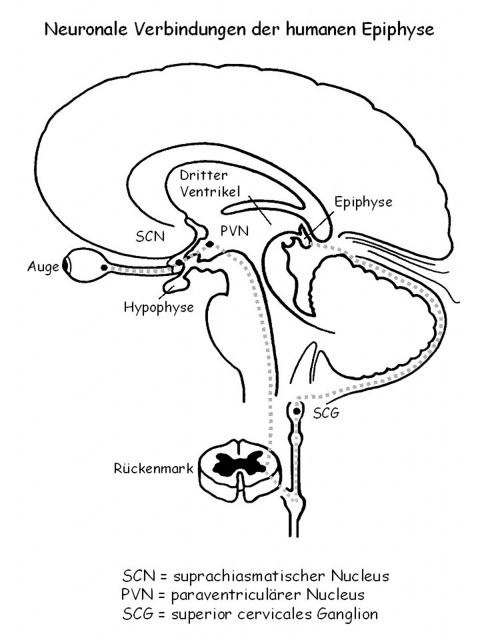
Das Pinealorgan der Wirbeltiere als Syntheseort für das Hormon Melatonin wird auch als Zirbeldrüse oder Epiphysis cerebri bezeichnet. Es entspringt ontogenetisch dem Zwischenhirn und ist anatomisch kranial vor diesem lokalisiert. Die einem Pinienzapfen ähnliche Form der Zirbeldrüse erklärt den Begriff „Corpus pineale“ [52].Galen (131 - 205) lieferte als erster eine genaue anatomische Beschreibung des Pinealorgans. Die Epiphyse ist ein unpaarig angelegter Bestandteil des Gehirns und liegt dorsal des 3. Ventrikels (Abbildung 1). Im 17. Jahrhundert vermutete der französische Philosoph Descartes (1596 - 1650) die Zirbeldrüse als Sitz der rationalen Seele [15].
Zu Beginn des 20. Jahrhunderts wurde die Eigenschaft von Zirbeldrüsengewebe, vitale Amphibienhaut zu bleichen, von MCCORD und ALLAN (1917) erstmalig beschrieben [57].
In den fünfziger Jahren des 20. Jahrhunderts gelang es dem amerikanischen Dermatologen LERNER, aus Pinealgewebe ein Indolderivat zu extrahieren [53]. Er gab der Substanz wegen der bleichenden Wirkung auf Amphibienhaut durch die Kontraktion von Melanophoren und seiner Abstammung von Serotonin den Namen Melatonin. Zur Entwicklung dieser Methode verarbeitete Lerner über 250 000 Rinderepiphysen [4, 54].
Das Interesse an dem Indolderivat nahm stetig zu. In der Folgezeit wurden Stoffwechsel und Funktion von Melatonin eingehend untersucht. Trotzdem sind bis heute nur einzelne physiologische Funktionen der Zirbeldrüse beim Menschen belegt [3].
Eine der vermuteten physiologischen Funktionen von Melatonin ist die Übermittlung von Informationen, die den Hell-/Dunkelwechsel betreffen, wodurch eine Synchronisation des Organismus auf den 24-Stunden-Rhythmus des geophysikalischen Tages erfolgt [3, 5, 29, 31].
Ein Zusammenspiel mit Hormonen wird von BRZEZINSKI (1997) beschrieben [15]. Beim Menschen wird ein möglicher Einfluss auf die Sekretion von Steroiden sowie auf Prolaktin und Lutein vermutet. Bei Tieren, die saisonal gebären, zeigt sich eine Korrelation der Fruchtbarkeit zur Länge der Hell-/Dunkelphase des geophysikalischen Tages. Experimentell kann die Fruchtbarkeit aber auch durch eine Melatonininfusion beeinflusst werden.
Melatonin beeinflusst möglicherweise auch den Zeitpunkt des menschlichen Pubertätsbeginns. CAVALLO und DOLAN (1996) fanden in ihrer Untersuchung bei Kindern mit einer in einem sehr frühen Alter beginnenden Pubertät geringere Melatoninkonzentrationen als bei zu einem üblichen Zeitpunkt pubertierenden Kindern [21]. Vermutet wird eine hemmende Wirkung von Melatonin auf das Gonadotropin-Releasing-Hormon (GnRH).
Melatonin soll als Radikalfänger und Antioxidans Krebserkrankungen vermindern und den Alterungsprozess des Organismus verlangsamen [9, 42, 61]. Verschiedene Arbeitsgruppen fanden bei unterschiedlichen Krankheitsbildern geringere Melatoninkonzentrationen im Blut im Vergleich zu gesunden Kontrollgruppen, beispielsweise bei Migräne [32], bei der Alzheimer-Erkrankung [19] und bei verminderter Immunkompetenz [42]. Tumorpatienten mit höheren endogenen Melatoninkonzentrationen zeigten eine bessere Verträglichkeit der Chemotherapie als Tumorpatienten mit geringeren Melatoninkonzen-trationen [8]. KOVÁCZ et al. (2000) erreichten durch die Gabe von Melatonin eine Neuroimmunmodulation und eine Verbesserung der Immunkompetenz [48].
Mit der Publikation von Sensationsberichten, dass Melatonin als „Allheilmittel und Wunderdroge“ lebensverlängernd wirke, Krebserkrankungen verhindere und stimmungsaufhellend wirke, wurden breite Bevölkerungsgruppen auf die Substanz aufmerksam. Durch die amerikanische Food and Drug Administration (FDA) als „food supplement“ und nicht als Arzneimittel eingestuft, wurden Melatoninpräparate in den USA frei verkäuflich und es entstand dort ein viele Millionen Dollar starker Umsatzmarkt.
Ziel dieser Arbeit ist es, einen Überblick darüber zu geben, was bei der „Wunderdroge Melatonin“ wirklich belegt ist und was eher einem Wunschdenken bzw. wirtschaftlichen Interessen von Herstellern entstammt. Dabei sollen auch Aspekte der Chronobiologie und vor allem der möglichen Bedeutung des individuellen Chronotyps auf Arbeitsleistung und Wahl des Arbeitsplatzes – auch bei der Bundeswehr – beleuchtet werden.
Synthese und Stoffwechsel von Melatonin
Synthese von Melatonin
Die Synthese von Melatonin ist durch einen ausgeprägten Tag-/Nachtrhythmus charakterisiert. Sie beginnt am frühen Abend und erreicht ihren Höhepunkt zwischen zwei und vier Uhr nachts (Akrophase). Die Konzentration im Plasma ist zu diesem Zeitpunkt am höchsten und bis zum Morgen wieder rückläufig (siehe auch Abbildung 3).
Der zeitliche Verlauf der Melatoninsynthese und die Menge des synthetisierten Melatonins unterliegen erheblichen interindividuellen und altersabhängigen Unterschieden [5, 21]. Bei einigen Individuen ab dem 65. Lebensjahr kann sogar jeglicher Tag-/Nacht-Rhythmus fehlen [42].
Am frühen Abend findet über verschiedene Signalkaskaden – nach der Aktivierung von a- und b-Rezeptoren – unter Einfluss membrangebundener Enzyme und Bildung des klassischen „Second Messenger“ cAMP eine Aktivierung der Melatoninsynthese statt [7, 70].
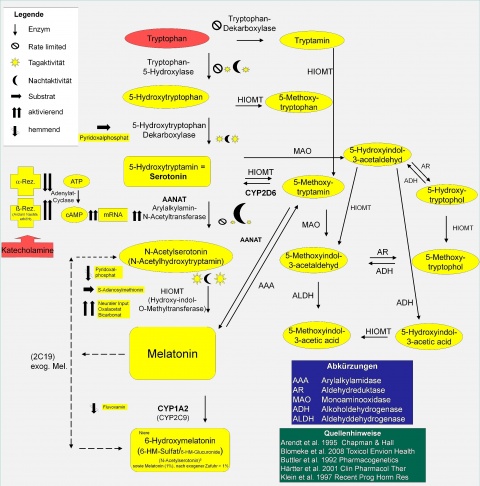
Die Ausgangssubstanz der Melatoninsynthese ist Tryptophan, eine essentielle Aminosäure, die über die Nahrung zugeführt wird. Dadurch können unterschiedliche Nahrungsmittel Einfluss auf die nächtliche Melatoninsekretion haben [66]. Durch die Tryptophanhydroxylase entsteht 5-Hydroxytryptophan. Nach einer Dekarboxylierung entsteht 5-Hydroxytryptamin (d. h. Serotonin).
Die Serotonin-N-Acetyltransferase verstoffwechselt als eines der Schrittmacherenzyme Serotonin zu N-Acetylserotonin [45]. Dieses Enzym weist eine Aktivitätsänderung in Abhängigkeit von den Lichtverhältnissen auf, deren Ausmaß als ein persönliches Merkmal gesehen wird [10]. Durch Methylierung des N-Acetylserotonin durch die Hydroxyindol-O-Methyltransferase entsteht Melatonin. Melatonin wird nicht gespeichert, sondern direkt in das Blut abgegeben (Abbildung 3).
Da die Epiphyse stark vaskularisiert ist, gelangt das Melatonin rasch in den Blutkreislauf. Aufgrund seiner Lipophilie diffundiert Melatonin bis in die Zellen und Zellbestandteile, wie z. B. Mitochondrien [19].
Melatonin ist im Blut zu 60 - 80 % an Albumin gebunden [19, 27], jedoch soll sich die Wirkung von freiem und gebundenem Melatonin nicht unterscheiden. Durch Diffusion gelangt Melatonin in den Speichel. Die Speichelkonzentration entspricht der Konzentration des freien Melatonins im Serum, also etwa 20 - 30 % seiner gesamten Plasmakonzentration [44].
Die durchschnittlichen Maximalwerte von Serummelatonin bei Erwachsenen liegen bei 50 - 70 pg/ml [6], Werte zwischen 29 - 88 pg/ml fanden MCINTYRE et al. (1987) in ihrer Untersuchung [58].
Im Speichel lagen bei Untersuchungen von GRIEFAHN et al. (2002) die nächtlichen Melatonin-Peaks bei 56 Probanden im Mittel zwischen 15 - 43 pg/ml [34]. MCINTYRE et al. (1987) fanden Werte zwischen 11 - 63 pg/ml [58].
Verstoffwechselung von Melatonin
Die Verstoffwechselung von Melatonin erfolgt hauptsächlich in der Leber durch Cytochrom P450-Enzyme [37] (Abbildung 3). Dieses gilt sowohl für exogen zugeführtes als auch für endogen gebildetes Melatonin. Endogenes Melatonin hat eine Halbwertszeit von 15 - 60 Minuten [3, 14]. Durch Hydroxylierung entsteht aus Melatonin der Metabolit 6-Hydroxymelatonin (6-OHMS), welcher zu 60 - 80 % sulfatiert und zu 13 - 27 % glucuronidiert im Urin ausgeschieden wird [17, 74]. Melatonin selbst findet man nur in geringer Konzentration im Urin (< 1 %).6-OHMS-Ausscheidung im Urin lag bei Untersuchungen von TETSUO et al. (1980) im Mittel bei 15,5 mg/24h bei Erwachsenen [74]. Bei Kindern und Jugendlichen fanden GRIEFAHN et al. (2001) 6-OHMS-Ausscheidungsmengen im Urin von im Mittel 32 mg/24h [36]. Höhere 6-OHMS-Ausscheidungsmengen bei Kindern und Jugendlichen wurden auch von SILMAN (1991) beschrieben [68].
Die Bioverfügbarkeit von Melatonin liegt nach oraler Applikation bei etwa 15 % der eingenommenen Dosis [26]. Bei einer Einnahme von 1 - 5 mg Melatonin resultieren Serumkonzentrationen, die 10 - 100-fach höher sind als die physiologischen nächtlichen Melatoninspitzen. Die höchsten Melatoninkonzentrationen im Serum werden etwa 1 Stunde nach oraler Aufnahme erreicht, gefolgt von einem kontinuierlichen Abfall über 4 - 8 Stunden [20]. 30 - 60 % der zugeführten Melatoninmenge unterliegt in der Leber einem First-Pass-Effekt. Exogen zugeführtes Melatonin hat eine Halbwertzeit von 20 - 60 Minuten. Plasmakonzentrationen nach oraler Aufnahme zeigen ebenfalls starke interindividuelle Schwankungen (25 - 28fach im Vergleich zum physiologischen Spiegel) [19, 48].
Einfluss von Licht und Körperhaltung
Zwei Faktoren beeinflussen die Melatoninkonzentration im Plasma: Licht beeinflusst die Synthese, wobei eine Lichtexposition eine Verminderung oder sogar komplette Hemmung der nächtlichen Melatoninsynthese bewirkt, abhängig von deren Zeitpunkt und Intensität [2, 12] (Abbildung 2). Die Angaben über die erforderlichen Dosen für eine komplette Unterdrückung der Melatoninsynthese beim Menschen variieren dabei in weiten Grenzen.
Ein weiterer Faktor, der die Melatoninkonzentration im menschlichen Körper beeinflusst, ist die Körperhaltung. Bei aufrechter Körperhaltung diffundiert ein Teil des Plasmavolumens ins Interstitium, es findet eine Plasmavolumenverschiebung statt. Große Proteinmoleküle, wie Albumin und daran gebundene Stoffe, diffundieren nicht in das Interstitium. Es kommt zu einer Konzentrationszunahme von an Albumin gebundenen Stoffen im Plasma. Die Melatoninkonzentration kann dadurch im Plasma um etwa 10 - 20 % ansteigen [25]. Dieser Prozess der Volumenverschiebung ist jedoch innerhalb von 20 Minuten reversibel.
Einfluss auf den Glukosestoffwechsel
In Bereich der Stoffwechselerkrankungen lassen neuste Studien in Bezug auf Diabetes mellitus auch auf das Molekül Melatonin hoffen; TUOMI et al. fanden heraus, dass eine tägliche Zufuhr von 4 mg Melatonin über 3 Monate die glukoseinduzierte Insulinsekretion bei oralen Glukosetoleranztests bei allen Studienteilnehmern im Vergleich zu den Baseline-Werten vor der Behandlung mit Melatonin signifikant reduzierte [41, 75].
Vorkommen von Melatonin
Melatonin kommt in allen Zellen des menschlichen Organismus vor. Die Konzentrationen sind in verschiedenen Geweben jedoch unterschiedlich [15, 49, 60]. Die höchsten Konzentrationen werden im Liquor gefunden. Das Vorkommen von Melatonin in Plasma, Speichel und Urin wird für wissenschaftliche und diagnostische Zwecke genutzt.
In verschiedenen Pflanzen lässt sich Melatonin ebenfalls nachweisen. Es wird vermutet, dass Melatonin in Samen und Keimlingen als Radikalfänger und Antioxidans gegen Licht und freie Radikale dient (Tabelle 1) [16, 28, 55].
Tab. 1: Nachgewiesene Melatoninkonzentrationen in essbaren Pflanzen und Samen [16, 28, 55]
Pflanze/Pflanzenteil | Melatoningehalt |
Weißer Senf | 189 ng/g |
Schwarzer Senf | 129 ng/g |
Mandeln | 39 ng/g |
Sonnenblumenkerne | 29 ng/g |
Fenchel | 28 ng/g |
Anis | 7 ng/g |
Mohn | 6 ng/g |
Kirschen | 1 ng/g |
Bananen | 470 pg/g |
Tomaten | 250 pg/g |
Gurken | 90 pg/g |
Kartoffeln | - |
Melatonin und zirkadiane Rhythmik
Die innere Uhr des Menschen hat eine natürliche Periode von 24 bis 25 Stunden, wenn externe synchronisierende Einflüsse wie Hell-Dunkel, Schlaf-Wachrhythmus sowie soziale Abläufe fehlen [33].
Unter Ausschluss jeglicher Einflüsse folgt der Organismus dann einem interindividuell erheblich variierenden, intraindividuell aber stabilen zirkadianen Rhythmus. Unter dem Einfluss von Zeitgebern wird dieser auf den 24-Stunden-Rhythmus des geophysikalischen Tages synchronisiert [31].
Licht dient als einer dieser Zeitgeber. Ist die Retina gegenüber Licht exponiert, wird diese Information über neuronale Verbindungen über den suprachiasmatischen Nukleus (SCN) zur Epiphyse weitergegeben und führt zur Hemmung der Melatoninsynthese (Abbildung 1).
Es besteht eine Abhängigkeit zu Intensität und Dauer der Lichtapplikation [2, 12]. Die Angaben über die erforderlichen Dosen für den Menschen variieren in weiten Grenzen. Ebenfalls zeigen sich erhebliche Unterschiede zwischen verschiedenen Spezies. Dabei gilt allgemein, dass die erforderliche Lichtintensität zur Suppression bei tagaktiven Spezies größer ist als bei nachtaktiven [2]. Bei nachtaktiven Nagern kann schon eine Beleuchtungsstärke von 1 lux ausreichen, um die Melatoninsynthese zu unterbrechen [13]. Tabelle 2 gibt Auskunft über die Beleuchtungsstärken verschiedener Lichtquellen [22].
Tab. 2: Angaben über die Beleuchtungsstärken verschiedener Lichtquellen [22]
Lichtquelle | Beleuchtungsstärke (lux) |
Vollmond | 0,4 |
Fernsehen mit geringer Raumbeleuchtung | 1 - 10 |
Typische Wohnzimmerbeleuchtung | 10 - 100 |
Innenraumbeleuchtung | bis 300 |
Bürobeleuchtung oder indirektes Tageslicht | 100 - 1.000 |
Bewölkter Himmel | 500 - 2.000 |
Blauer Himmel | 10.000 - 30.000 |
Sonnenlicht | ≥ 100.000 |
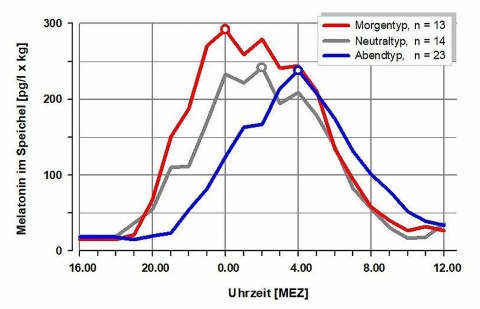
Die Melatoninsynthese beginnt am frühen Abend und erreicht ihren Höhepunkt zwischen zwei und vier Uhr nachts. Dann finden sich die höchsten Konzentrationen, die zum Morgen hin wieder abnehmen. Am Tage werden nur geringe Konzentrationen Melatonin gemessen. Die Melatoninprofile variieren inter-individuell sehr stark. Es gibt Unterschiede im Beginn der Melatoninsynthese (Onset), dem Zeitpunkt des nächtlichen Höhepunktes, der Menge des nächtlich synthetisierten Melatonins (Amplitude) und dem Ende der Synthese (Offset). Im Gegensatz dazu sind die nächtlichen Verläufe eines Individuums im zeitlichen Verlauf, in der Amplitude und im Profil weitgehend stabil [4, 67].
Chronotypen
Das individuelle Melatoninprofil ist das hormonelle Korrelat zur individuellen Rhythmik. Der Chronotyp beschreibt eine Person mit einer bestimmten Rhythmik. Es werden ein Morgen-, Neutral- und Abendtyp unterschieden. Physiologisch wird dies deutlich in einem früheren Anstieg der Melatoninkurve am Abend, einem früheren Erreichen der nächtlichen Melatoninspitzen sowie einer früheren Abnahme der nächtlichen Melatoninkonzentrationen bei Morgentypen gegenüber Abendtypen (Abbildung 3).Morgentypen stehen früh auf und gehen zeitig ins Bett. Ihr Schlafverhalten ist eher rigide, sie können nächtliche Schlafdefizite nicht durch längeres Schlafen ausgleichen. Ihre physiologischen Funktionen und psychomentalen Leistungen erreichen sie vor den Abendtypen. Insbesondere bei der Nachtarbeit ist bei Morgentypen mit erheblichen und in aufeinander folgenden Schichten kumulierenden Schlafdefiziten zu rechnen. Morgentypen eignen sich besser für die Frühschicht [29, 62].
Abendtypen zeichnen sich durch längeres Schlafen aus, sie haben Probleme mit dem frühen Aufstehen und haben ihr Leistungshoch zu einem späteren Tageszeitpunkt. Für Abendtypen sind Frühschichten besonders belastend, weil sie nicht vorschlafen können und bei dieser Schichtform ausgeprägte und kumulierende Schlafdefizite entwickeln. Abendtypen sind besser für die Nachtschicht geeignet [29, 62].
An Arbeitsplätzen, an denen Fehlhandlungen in Selbst- und Fremdgefährdung oder in erheblichen materiellen Schäden (z. B. im militärischen Umfeld) resultieren können, kann die Fähigkeit, im Zusammenhang mit der zirkadianen Phasenlage Nachtarbeit zu leisten, von besonderem Interesse sein [63, 64].
Melatonin und Körperkerntemperatur
Ein weiterer physiologischer Parameter, die Körperkerntemperatur (KKT), unterliegt ebenfalls einer Tagesrhythmik und dient üblicherweise zur Bestimmung der Phasenlage. Die KKT erreicht ihre höchsten Werte am Tage und ihre niedrigsten in der Nacht. Melatonin wird als Mediator für den Effekt von Licht auf den Verlauf der KKT vermutet. Deren zirkadianer nächtlicher Tiefpunkt ist assoziiert mit der höchsten nächtlichen Melatoninkonzentration [18]. Der Zeitpunkt der niedrigsten KKT liegt wie der Beginn der Melatoninsynthese bei Morgentypen früher als bei Abendtypen [28].
Untersuchungen haben gezeigt, dass der Verlauf der Melatoninsynthese ein besserer physiologischer Parameter zur Bestimmung der Phasenlage ist als die hierfür registrierte KKT, da diese durch viele weitere Faktoren beeinflussbar ist. Der Melatoninverlauf korreliert hoch signifikant mit der subjektiven Phasenlage, einem individuellen Persönlichkeitsmerkmal. Diese lässt sich zuverlässig mit dem von HORNE und ÖSTBERG (1997) [39] entwickelten bzw. mit der deutschen Übersetzung des Morningness-Eveningness-Questionnaire erfassen [35].
Anpassung an Nachtarbeit
Bei der regelmäßigen Ausübung von Nachtarbeit ohne eine Anpassung können zahlreiche gesundheitliche Probleme auftreten, z. B. Schlafstörungen, chronische Erschöpfung, gastrointestinale Symptome, kardiovaskuläre Erkrankungen und „hormonelle Dysregulationen“ [11, 23, 30, 40].
Einer willkürlichen Änderung des Schlaf-Wachwechsels, die z. B. bei Nachtarbeit stattfindet, folgen die Rhythmen der einzelnen physiologischen Funktionen nur sehr langsam. Eine Konditionierung der aktuellen Phasenlage durch langfristige Anpassung an vorgegebene Rhythmen ist in begrenztem Umfang möglich, es kommt jedoch nicht zu einer Maskierung des Chronotyps [62].
Möglicherweise ist eine Unterdrückung der normalen Melatoninsynthese oder eine Phasenverschiebung der Melatoninsynthese durch die nächtliche Lichtexposition am Nachtarbeitsplatz für das Auftreten von verschiedenen Krankheitsbildern verantwortlich.
Eine Untersuchung an Nachtarbeitern hat gezeigt, dass Beleuchtungsstärke und Dauer der Lichtexposition mit der Phasenanpassung korrelieren und das Vermeiden von Licht am Morgen nach der Nachtschicht eine bessere Phasenverschiebung und somit bessere Anpassung an Nachtarbeit bedingt [47]. Die Verabreichung von hellem Licht in einem definierten Zeitraum kann zu einer Verschiebung des zirkadianen Rhythmus führen, so die Annahme von ARENDT (2000) [6].
Die für eine Hemmung der Melatoninsynthese erforderlichen Lichtstärken sind jedoch an Nachtarbeitsplätzen nur schwierig zu erreichen. Bei typischen Nachtberufen, wie z. B. Lkw-Fahrer und Pförtner, ist eine Applikation von hellem Licht von vornherein nicht praktikabel, da die Arbeitsplatzverhältnisse dies nicht zulassen. Weitere Probleme, die durch helles Licht entstehen können, sind hohe Temperaturen, starke Wärmestrahlung und hohe Kosten.
Exogene Melatoninzufuhr bei Zeitzonenwechsel
Exogen zugeführtes Melatonin ist in der Lage, den zirkadianen Rhythmus zu beeinflussen. So hat man mit einer kontrollierten Gabe von Melatonin eine Synchronisation auf einen 24-Stunden-Rhythmus und eine Verminderung der Schlafstörungen bei blinden Personen mit einem unbeeinflussten (freilaufenden) circadianen Rhythmus erreicht [1].
Melatonin wird ebenfalls als potentes Mittel bei Zeitzonenwechsel zur Verminderung des daraus resultierenden Jet-Lags vorgeschlagen [69]. Bei einer Zeitzonenverschiebung von 8 Stunden in östliche Richtung liegt der Höhepunkt der Melatoninkurve bei Ankunft in der neuen Zeitzone am Tage und nicht – wie normalerweise – in der Nacht. Es folgt eine Adaption an den neuen Hell-/ Dunkelwechsel, für die mehrere Tage erforderlich sind, bis sich der Melatoninrhythmus vollständig an die neuen Lichtverhältnisse angepasst hat [56]. Man rechnet mit einem Zeitraum von 1 Tag pro Stunde verschobener Zeitzone. Bei einer Zeitzonenverschiebung in die gegensätzliche Richtung, also nach Westen, findet eine Anpassung doppelt so schnell statt [24]. Die beste Methode, um eine Zeitverschiebung zu überwinden, sehen CARDINALI et al. (2002) in der Melatoningabe zur Schlafenszeit bei möglichst starker Lichtexposition gegenüber Tageslicht des jeweils aktuellen geophysikalischen Tages sowie gleichzeitiger körperlicher Betätigung am Tage [19, 65].
In 8 von 11 Placebo-kontrollierten Studien konnte mittlerweile gezeigt werden, dass unter Melatonin-Substitution die Symptome eines Jet-Lags signifikant abnahmen. In den 3 Studien, die dies nicht zeigen konnten, wird eine zu geringe Dosis des sub-stituierten Melatonins vermutet [65].
Melatonin und Schlafstörungen
Ramelteon® ist ein Melatonin-Rezeptor-Agonist, der von der US-amerikanischen Federal Drug Administration (FDA) zur Behandlung von Schlafstörungen zugelassen ist. Kurzzeitstudien sowie eine kontrollierte 6-monatige Studie zeigten einen geringen bis moderaten Nutzen für die Zeit bis zum Einschlafen, aber keine signifikante Verbesserung der gesamten und/oder Schlafzeit nach dem Einschlafen. Die Hauptnebenwirkung war eine leichte Sedierung, die am Folgetag der Einnahme auftrat. Eine Meta-Analyse von Melatonin-Studien zur Schlaflosigkeit (in einem breiten Spektrum von Dosen und in Formen mit sofortiger Freisetzung und kontrollierter Freisetzung) zeigte geringe Vorteile für die Zeit bis zum Einsetzen des Schlafes und die gesamte Schlafzeit. Die Qualitätskontrolle von frei verkäuflichen Melatoninprodukten ist unklar [78].
Reproduktionsverhalten im Jahresrhythmus
Im Jahresrhythmus stattfindende photoperiodische Schwankungen sind gegenüber klimatischen Veränderungen präzise und darüber hinaus seit Jahrtausenden unverändert [52]. Die jahresabhängige Photoperiodik nimmt Einfluss auf die Melatoninsynthese. Eine jahreszeitlich unterschiedliche Lichtexposition spiegelt sich im Melatoninprofil wieder [3].
Im Sommer besteht eine längere Lichtexposition, die Dauer der Melatoninsynthese ist verkürzt, im Winter entsprechend entgegengesetzt [77]. Bei Tieren, bei denen ein jahreszeitlicher Rhythmus der Fortpflanzung, des Fellwechsels, des Wechsels des Gehörns sowie des Eintritts in den Winterschlaf besteht, kann man durch Lichtapplikation und Melatoningabe diese Rhythmik beeinflussen [15, 50].
Tiere, die bei einer Verkürzung der Photoperiode die Paarungsbereitschaft erhöhen, sind „Short-Day-Breeder“ (Schafe, Füchse, einige Primaten und Hirscharten), während bei Tieren, bei denen das Gegenteil die Paarungsbereitschaft fördert, „Long-Day-Breeder“ sind (Hamsterarten, Hasen, Igel usw.). Goldhamster sind im Frühjahr und Sommer fertil, im Herbst und Winter infertil, bei Schafen und Ziegen verhält es sich entgegengesetzt [76].
Ökologischer Hintergrund für die saisonale Anpassung ist beispielsweise die Tatsache, dass das Überleben von Nachkommen häufig nur dann gesichert ist, wenn diese zu einer bestimmten Jahreszeit geboren werden („saisonale Reproduktion“). Die Konsequenz aus der Tatsache, dass verschiedene Tierarten unterschiedlich lange Tragzeiten haben (wenige Wochen bis 1 Jahr) ist, dass dem Zeitpunkt der Begattung eine entscheidende Bedeutung zukommt [52].
Eine mögliche Rolle von Melatonin bei der Thermoregulation in Bezug auf das Reproduktionsverhalten wird ebenfalls diskutiert. Jahreszeitliche physiologische Anpassungen an das Nahrungsangebot hängen mit dem erforderlichen Energieumsatz zusammen, welcher klimaabhängig jahreszeitlichen Schwankungen unterliegt. Energiebevorratung in braunem Fettgewebe ist ein wichtiger Faktor, jahreszeitlichen Temperaturschwankungen bzw. Kälte entgegenzuwirken. Braunes Fettgewebe ermöglicht eine direkte Umwandlung von gespeicherter Stoffwechselenergie in Wärme und ermöglicht so ein Überleben in kalten Jahreszeiten [52].
Melatonin aktiviert beim Schaf (intravenös appliziert) im Sommer das Reproduktionssystem. Das Gegenteil wird unter denselben Bedingungen beim Hamster erreicht, dort kommt es zum völligen Kollaps der Fortpflanzungskapazität [51]. Die kommerzielle Nutzung von Melatonin bei der Fortpflanzung von Zuchttieren ist bereits in der Planung (UK, Australien) [5]. Die jahreszeitlichen Schwankungen der Melatoninsynthese spielen beim Menschen in Bezug auf die Reproduktion eine geringe Rolle, da bei diesem der biologische Rhythmus auch durch soziale Komponenten beeinflusst wird.
Melatonin und humane Spermiogenese
Das Melatonin ggf. über Nebeneffekte doch Einfluss auf die Spermiogenese haben könnte, wurde 2013 von einer Gruppe von Forschern gezeigt, die in einer Einzelfallstudie einen Mann, dessen Hypophyse entfernt wurde, mit 2 mg Circadin® täglich behandelten und dabei über einen Zeitraum von 10 Monaten seine Sexualhormone beobachteten. Die Studie konnte zwar keinen signifikanten Zusammenhang feststellen, einige Veränderungen der Sexualhormone konnten aber nachgewiesen werden; darüber hinaus wurde die Frau des Patienten innerhalb des Behandlungszeitraumes auch schwanger. Hier sind jedoch größere Studien abzuwarten [41].
Antioxidative und onkostatische Wirkung von Melatonin
Antioxidative Wirkung von Melatonin
Die Zerstörung von essenziellen Makromolekülen durch freie Radikale ist die Grundlage einiger Erkrankungen sowie Alterungsprozesse [61]. Melatonin wird die Funktion zugestanden, eine Schädigung durch freie Radikale und/oder reaktive Zwischenprodukte zu vermindern, indem es diese bindet [61]. Es soll den schädigenden Effekt von freien Radikalen, Sauerstoffradikalen sowie Stickstoffspezies sogar in subzellulären Kompartimenten verringern und Lipide, Proteine sowie nukleare und mitochondriale DNA und RNA schützen. Zusätzlich soll Melatonin aktivierende Effekte auf Enzyme, wie z. B. Glutathionperoxidase, -reduktase und -katalase, haben [43, 60], die ebenfalls beim Abbau von Karzinogenen eine Rolle spielen.
Die möglichen verschiedenen Mechanismen der Beeinflussbarkeit von Krebszellen unter In-vivo- und In-vitro-Bedingungen bei Melatoningabe sind jedoch weitestgehend unverstanden. Einerseits wird die Eigenschaft von Melatonin als Radikalfänger als Ursache für eine antitumorale Wirkung herangezogen, andererseits sind Interaktionen mit anderen Stoffen und Hormonen für die Beeinflussung des Tumorwachstums in Diskussion. Bei Ratten, denen die Epiphyse entfernt wurde, zeigte sich z. B. ein vermehrtes Wachstum von Mammakarzinomen [73].
Die physiologischen Mengen des nächtlich produzierten Melatonins reichen für eine antioxidative Wirkung nicht aus, erst seine exogene Zufuhr macht es als Antioxidans effektiv [61]. Nach oralen Standarddosen zwischen 1 und 5 mg/d resultieren Serumkonzentrationen, die 10 bis 100-fach höher sind als die physiologischen nächtlichen Melatoninspitzen [20].
Um z. B. zerebrale Schäden durch Sauerstoffminderversorgung nach einem Apoplex zu vermindern, sind pharmakologische Dosen (1 - 5 mg) von Melatonin erforderlich, damit eine antioxidative Wirkung eintritt [15, 20]. Die erforderlichen Dosen von Melatonin sind jedoch geringer als die von anderen Radikalfängern, wie Vitamin B und C. Darüber hinaus soll die Wirkung von Melatonin als Radikalfänger auf zerebraler Ebene die von Vitamin B und C übertreffen [61].
Onkostatische Wirkung von Melatonin
Antiproliferativer und proapoptotischer Effekt auf Tumorzellen sowie eine Hemmung der Tumorangiogenese durch die Hemmung der „Vascular Endothelial Growth Faktoren“ (VEGF) durch Melatonin sollen das Zellwachstum im Tumorgewebe verringern [59], wobei jedoch die Wirkung von Melatonin in Abhängigkeit vom Tumorzelltyp unterschiedlich ist. Hormonabhängige Tumore (Mamma-/ Prostatakarzinom) sind durch Melatonin besser hemmbar als hormonunabhängige [9, 71]. Auch bei anderen Tumoren wird eine positive Wirkung bei der Gabe von Melatonin beschrieben, so z. B. bei Kolontumoren [72].
Der Zeitpunkt der Applikation hat Einfluss auf die tumorhemmende Wirkung von Melatonin. Seine Gabe entgegen des natürlichen Verlaufes zeigte in Tierversuchen keine oder nur geringe Wirkungen [72]. Die Verabreichung sollte deshalb am Abend erfolgen.
Es ist möglich, dass der altersbedingte Abfall der Melatoninsekretion mit vermindertem antioxidativen Schutz, verminderter Immunkompetenz sowie weiteren Erkrankungen im Alter verbunden ist [40, 42].
Das pineale Neuroindol Melatonin übt eine außergewöhnliche Vielfalt an systemischen Funktionen aus. Einige von ihnen werden durch seine spezifischen Membranrezeptoren Typ 1 und Typ 2 (MT1 und MT2) ausgeübt, während andere durch rezeptorunabhängige Mechanismen vermittelt werden. Ein möglicher Transport von Melatonin durch unterstützende Glukosetransporter (GLUT/SLC2A) wurde in Prostatakrebszellen angenommen. Die Prostatazellen haben einen bestimmten Stoffwechsel, der sich während der Tumorprogression verändert. Während der ersten Schritte der Karzinogenese wird die oxidative Phosphorylierung reaktiviert, während der Übergang zum „Warburg-Effekt“ nur bei fortgeschrittenen Tumoren und im metastatischen Stadium erfolgt. Hier wurde untersucht, ob Melatonin den Metabolismus von Prostatakrebszellen verändern könnte. Um dies zu erreichen, wurden 13C-stabile Isotop-aufgelöste Metabolomics in Androgen-sensitiven LNCaP und -insensitiven PC-3 Prostatakrebszellen eingesetzt. Zusätzlich zur Metabolit-13C-Markierung wurden die ATP/AMP-Spiegel und die Lactatdehydrogenase- oder Pentosephosphatwegaktivität gemessen. Melatonin reduziert die Lactatmarkierung in androgensensitiven Zellen und senkt auch die 13C-Markierung von Metaboliten des Tricarbonsäurezyklus und der ATP-Produktion. Darüber hinaus reduziert Melatonin die Laktat-13C-Markierung in androgeninsensitiven Prostatakrebszellen. Die Ergebnisse zeigten, dass Melatonin die Glykolyse sowie den Tricarbonsäurezyklus und den Pentosephosphatweg in Prostata-krebszellen begrenzt, was darauf hindeutet, dass die Reduktion der Glukoseaufnahme ein Hauptziel des Indols in diesem Tumortyp ist [38].
Reduzierung des Delir-Risikos?
Melatonin und seine Analoga wurden ebenfalls untersucht, um die Inzidenz des Delirs bei hospitalisierten älteren Patienten zu reduzieren. Eine kleine, randomisierte Studie zur präventiven Verabreichung von Ramelteon® (einem Melatoninanalogon) an 67 Patienten zeigte einen signifikanten Vorteil hinsichtlich des Delir-Risikos. Ein kürzlich veröffentlichter Cochrane-Review, der Daten aus 3 Studien mit 529 Patienten zusammenfasste, kam zu dem Schluss, dass es keine eindeutigen Hinweise darauf gibt, dass die Verwendung von Melatonin oder Melatonin-Agonisten die Inzidenz von Delir im Vergleich zu Placebo senkt [56].
Fazit
Melatonin wird als Therapeutikum für unterschiedliche Krankheitsbilder und Störungen von einigen Autoren propagiert. Dennoch müssen Ergebnisse großer Studien abgewartet werden, bevor sich Nutzen und Risiko abschätzen lassen. Als pharmakologisch wirksame Substanz ist Melatonin in Deutschland verschreibungspflichtig, da Wirksamkeit und Unbedenklichkeit nicht eindeutig belegt sind. Eine unkritische Einnahme muss auf jeden Fall abgelehnt werden, da Melatonin als Hormon möglicherweise viele körpereigene Regelkreisläufe beeinflusst.
Abschließend bleibt zu sagen, dass brennend auf weitere Studien zum Thema Melatonin gewartet wird, denn es bestehen große Hoffnungen, dass diese Substanz sowohl zur Krebstherapie und als Therapeutikum bei anderen Krankheitsbildern als auch zur Verminderung von Folgeerkrankungen durch Schichtarbeit oder Arbeiten mit Zeitzonenwechseln wirksam ist.
Unabhängig davon kann eine Berücksichtigung des Chronotypen für die Wahl des Arbeitsplatzes, die Schichttauglichkeit oder das Auftreten von möglichen Erkrankungen durch Schicht- und Nachtarbeit auch für den Arbeitgeber Bundeswehr von Interesse sein. In wieweit dies jedoch praxisrelevant bzw. in die Praxis umsetzbar ist, steht auf einem anderen Blatt. Wie soll man denn letztlich bei der Personalauswahl mit der Feststellung: „Dieser Arbeitsplatz ist für Sie nicht geeignet, da Ihr Chronotyp nicht zu dem Schichtmodell passt!“ umgehen?
Bei der Beratung von Patientinnen und Patienten ist es ärztliche Aufgabe, mit dem „Mythos Melatonin“ aufzuräumen, um möglichen gesundheitlichen Folgen seiner unkontrollierten Einnahme zu begegnen. Hierzu soll dieser Beitrag Hilfestellung geben.
Literatur
- Arendt J, Deacon S, English J, et al.: Melatonin and adjustment to phase shift. J Sleep Res 1995; 4: 74 - 77.
- Arendt J, Ravault JP: Suppression of melatonin secretion in Île-de-France rams by different light intensities. J Pineal Res 1988; 5: 245 - 250.
- Arendt J: Melatonin and the mammalian pineal gland. London: Chapman & Hall 1995.
- Arendt J: Melatonin and human rhythms. Chronobiology International 2006; 23 (1&2): 21 - 37.
- Arendt J: Melatonin and the pineal gland: influence on mammalian seasonal and circadian physiology. Rev Reproduction 1998; 3: 13 - 22.
- Arendt J: Melatonin, circadian rhythms, and sleep. N Engl J Med 2000; 343: 1114 - 1116.
- Attia AM: Possible involvement of beta-adrenergic receptors in the enhancement of nocturnal pineal N-acetyltransferase activity due to parathion administration. Toxicology 2000; 142: 79 - 86.
- Bartsch C, Bartsch H, Karasek M: Melatonin in Clinical Oncology. Neuroendocrin Lett 2002; 23 (suppl 1): 30 - 38.
- Bartsch C, Bartsch H: Die Bedeutung des Melatonins bei malignen Erkrankungen. Wien Klin Wochenschr 1997; 109: 722 - 729.
- Blomeke B, Golka K, Griefahn B, Roemer HC: Arylalkylamine N-acetyltransferase (AANAT) genotype as a personal trait in melatonin synthesis. J Toxicol Envion Health A 2008; 71(31 - 14): 874 - 896.
- Bohle P, Tilley A: The impact of night work on psychological well-being. Ergonomics 1989; 32:1089 - 1099.
- Brainard GC, Levin R: Ocular input for human melatonin regulation. Neuroendocrin Lett 2002; 23 (suppl 2): 89 - 90.
- Brainard GC, Richardson BA, Petterborg LJ, et al.: The effect of different light intensities on pineal melatonin content. Brain Res 1982; 233: 75 - 81.
- Brown EN, Choe Y, Shanahan TL, et al.: A mathematical model of diurnal variations in human plasma melatonin levels. Am J Physiol 1997; 272: E506 - 16.
- Brzezinski A: Melatonin in humans. N Engl J Med 1997; 336: 186 - 195.
- Burkhardt S, Tan DX, Manchester LC, et al.: Detection and quantification of the antioxidant melatonin in montmorency and balaton tard cherries (prunus cerasus). J Agric Food Chem 2001; 49: 4898 - 4902.
- Butler MA, Lang NP, Young JF, et al.: Determination of CYP1A2 and NAT2 phenotypes in human populations by analysis of caffeine urinary metabolites. Pharmacogenetics 1992; 2: 116 - 127.
- Cagnacci A, Soldani R, Yen SSC: The effect of light on core body temperature is mediated by melatonin in women. J Clin Endocrinol Metab 1993; 76: 1036 - 1038.
- Cardinali DP, Brusco LI, Pérez Lloret S, et al.: Melatonin in sleep disorders and jet-leg. Neuroendocrin Lett 2002; 23 (suppl 1): 9 - 13.
- Carlberg C: Gene regulation by melatonin. Ann NY Acad Sci 2000; 917: 387 - 396.
- Cavallo A, Dolan M: 6-Hydroxymelatonin sulfate excretion in human puberty. J Pineal Res 1996; 21: 225 - 230.
- Cole RJ, Kripke DF, Wisbey J, et al.: Seasonal variation in human illumination exposure at two different latitudes. J Biol Rhythms 1995; 10: 324 - 334.
- Costa G, Lievore F, Casaletti G, et al.: Circadian characteristics influencing interindividual differences in tolerance and adjustment to shiftwork. Ergonomics 1989; 32: 373 - 385.
- Deacon S, Arendt J: Adapting to phase shifts, II. Effects of melatonin and conflicting light treatment. Physiol Behav 1996; 59: 675 - 682.
- Deacon S, Arendt J: Posture influences melatonin concentrations in plasma and saliva in humans. Neurosci Lett 1994; 167: 191 - 194.
- DeMuro RL, Nafziger AN, Blask DE, et al.: The absolute bioavailability of oral melatonin. J Clin Pharmacol 2000; 40: 781 - 784.
- Di W-L, Kadva A, Djahanbakhch O, et al.: Radio immunoassay of bound and free melatonin in plasma. Clin Chem 1998; 44: 304 - 310.
- Dubbels R, Reiter RJ, Klenke E, et al.: Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry. J Pineal Res 1995; 18: 28 - 31.
- Duffy JF, Dijk D-J, Hall EF, et al.: Relationship of endogenous circadian melatonin and temperature rhythms to self-reported preference for morning or evening activity in young and older people. J Investig Med 1999; 47: 141 - 150.
- Dumont M, Benhaberou-Brun D, Paquet J: Profile of 24-h light exposure and circadian phase of melatonin secretion in night workers. J Biol Rhythms 2001;16 (5): 502 - 511.
- Erren TC, Reiter JR: Melatonin: a universal time messenger. Neuroendocrin Lett 2015; 36 (3): 187 - 192.
- Gagnier JJ: The therapeutic potential of melatonin in migraines and other headache types. Altern Med Rev 2001; 6: 383 - 389.
- Gillberg M: Human sleep/wake regulation. Acta Anaesth Scan 1997; 110: 8 - 10.
- Griefahn B, Blaszkewicz M, Gerngroß H, Römer HC: Der Verlauf der Melatoninsynthese als zuverlässiger Indikator der individuellen circadianen Phasenlage. Zbl Arbeitsmed 2002; 52: 43 - 42.
- Griefahn B, Künemund C, Bröde P, et al.: Zur Validierung der deutschen Übersetzung des Morningness-Eveningness-Questionnaires von Horne und Östberg. Somnologie 2001b; 5: 71 - 80.
- Griefahn B, Remer T, Blaszkewicz M, et al.: Long-term stability of 6-hydroxymelatonin sulfate in 24-h urine samples stored at –20° C. Endocrine 2001a; 15: 199 - 202.
- Härtter S, Ursing C, Morita S, et al.: Orally given melatonin may serve as a probe drug for cytochrome P450 1A2 activity in vivo: a pilot study. Clin Pharmacol Ther 2001; 70: 10 - 16.
- Hevia D, Gonzalez-Menendez P, Fernandez-Fernandez M, et al.: Melatonin decreases glucose metabolism in prostate cancer cells: A 13C stable isotope-resolved etabolomic study. Int J Mol Sci 2017; 18: 1620
- Horne JA, Östberg O: A self-assessment questionnaire to determine morningness-eveningness in human circadian rhythms. Int J Chronobiol 1976; 4: 97 - 110.
- Jin Y, Hur T, Hong Y: Circadian Rhythm Disruption and Subsequent Neurological Disorders in Night-Shift Workers. J Lifestyle Med 2017; 7(2): 45 - 50.
- Jones PM: A Wake-up Call forType 2 Diabetes? N Engl J Med 2016; 375 (11): 1090 - 1092.
- Karasek M, Reiter RJ: Melatonin and aging. Neuroendocrin Lett 2002; 23 (suppl 1): 14 - 16.
- Karbownik M: Potential anticarcinogenic action of melatonin and other antioxidants mediated by antioxidative mechanisms. Neuroendocrin Lett 2002; 23 (suppl 1) 39 - 44.
- Kennaway DJ, Voultsios A: Circadian rhythm of free melatonin in human plasma. J Clin Endocrinol Metab 1998; 83: 1013 - 1015.
- Klein DC, Coon SL, Roseboom PH, et al.: The melatonin rhythm-generating enzyme: molecular regulation of serotonin N-acetyltransferase in the pineal gland. Recent Prog Horm Res 1997; 52: 307 - 357.
- Kocher L, Lornage J, Claustrat B: Persistence of fertility despite semen alterations in a pinealectomised patient treated with melatonin. Neuroendocrin Lett 2013; 34 (8): 763 - 766.
- Koller M, Härma M, Laitinen JT, et al.: Different patterns of light exposure in relation to melatonin and cortisol rhythms and sleep of night workers. J Pineal Res 1994; 16: 127 - 135.
- Kovács J, Brodner W, Kirchlechner V, et al.: Measurement of urinary melatonin: A useful tool for monitoring serum melatonin after its oral administration. J Clin Endocrinol Metab 2000; 85: 666 - 670-
- Kvetnoy I: Extrapineal melatonin in pathology: New perspectives for diagnosis, prognosis and treatment of illness. Neuroendocrin Lett 2002; 23 (suppl 1): 92 - 96.
- Langer M, Hartmann J, Turkof H, et al.: Melatonin beim Menschen – ein Überblick. Wien Klin Wochenschr 1997; 109: 707 - 713.
- Lerchl A, Partsch CJ, Nieschlag E: Circadian and ultradian variations of pituitary and pineal hormones in normal men: Evidence for a link between melatonin, gonadotropin, and prolactin secretion. J Pineal Res 1995; 18: 41 - 48.
- Lerchl A: Die Melatonin-Hypothese. Eine Einführung. Bonn: Forschungsgemeinschaft Funk – Edition Wissenschaft 2002.
- Lerner AB, Case JD, Takahashi Y, Lee TH, Mori W: Isolation of melatonin, the pineal gland factor that lightens melanocytes. J Am Chem Soc 1958; 80: 2587.
- Lerner AB: Melatonin – without a hype. In: J Olcese (ed.) Melatonin after four decades. New York: Kluwer Academic / Plenum Publishers 2000.
- Manchester LC, Tan DX, Reiter RJ, et al.: High levels of melatonin in the seeds of edible plants possible function in germ tissue protection. Life Sci 2000; 67: 3023 - 3029.
- Marcantonio ER: Delirium in Hospitalized Older Adults.N Engl J Med 2018; 378 (1): 96 - 97.
- McCord CP, Allan FP: Evidences associating pineal gland function with alterations in pigmentation. J Exp Zoology 1917; 23: 207 - 224.
- McIntyre IM, Norman TR, Burrows GD, et al.: Melatonin rhythm in human plasma and saliva. J Pineal Res 1987; 4: 177 - 183.
- Pawlikowski M, Winczyk K, Karasek M: Oncostatic action of melatonin: facts and question marks. Neuroendocrin Lett 2002; 23 (suppl 1): 24 - 29.
- Reiter RJ, Acuňa-Castroviejo D, Tan DX, et al.: Free radical-mediated molecular damage. Ann NY Acad Sci 2001; 939: 200 - 215.
- Reiter RJ, Tan DX, Allegra M: Melatonin: reducing molecular pathology and dysfunction due to free radicals and associated reactants. Neuroendocrin Lett 2002; 23 (suppl 1): 3 - 8.
- Roemer HC, Griefahn B, Kuenemund C, Blaszkewicz M, Gerngross H: The reliability of melatonin synthesis as an indicator of the individual circadian phase position. Mil Med 2003; 168 (8): 674 - 678.
- Roemer HC, Griefahn B: Supression of melatonin secretion by bright light and possible consequences for shiftwork. Neuroendocrin Lett 2002; 23 (suppl 2) 100.
- Roemer HC, Griefahn B, Blazkewicz M, et al.: Melatonin und Schichtarbeit. Wermed Monatsschr 2002; 46(9 - 10): 199 - 202.
- Sack RL: Jet Lag. N Engl J Med 2010; 362 (5): 440 - 447.
- Selmaoui B, Oguine A, Thibault L: Food access schedule and diet composition alter rhythmicity of serum melatonin and pineal NAT activity. Physiol Behaviour 2001; 74: 449 - 455.
- Shanahan TL, Czeisler CA: Light exposure induces equivalent phase shifts of the endogenous circadian rhythms of circulating plasma melatonin and core body temperature in men. J Clin Endocrinol Metab 1991; 73: 227 - 235.
- Silman R: Melatonin and the human gonadotrophin-releasing hormone pulse generator. J Endocrine 1991; 128: 7 - 11.
- Skene DJ, Deacon S, Arendt J: Use of melatonin in circadian rhythm disorders and following phase shift. Acta Neurobiol Exp (Warsz) 1996; 56: 359 - 362.
- Stehle JH, von Gall C, Schomerus C, et al.: Of rodents and ungulates and melatonin: creating a uniform code for darkness by different signalling mechanisms. J Biol Rhythms 2001; 16: 312 - 325.
- Stevens RG: Lighting during the day and night: possible impact on risk of breast cancer. Neuroendocrin Lett 2002; 23 (suppl 2): 57 - 60.
- Stoll S, Müller WE: Melatonin, Hormon oder Wundermittel? MMP 1996; 19: 69 - 75.
- Tamarkin L, Cohen M, Roselle D, et al.: Melatonin inhibition and pinealectomy enhancement of 7,12-dimethylbenz(a)anthracene-induced mammary tumors in the rat. Cancer Res 1981; 41: 4432 - 4436.
- Tetsuo M, Markey SP, Kopin IJ: Measurement of 6-hydroxymelatonin in human urine and it’s diurnal variations. Life Science 1980; 27: 105 - 109.
- Tuomi T, Nagorny CL, Singh P., et al.: Increased melatonin signaling is a risk for Type 2 Diabetes. Cell Metab 2016; 23(6): 1067 - 1077.
- Waldhausen F: Melatonin – Neue Modedroge oder Substanz mit definierter Wirkung. Wien Klin Wochenschr 1997; 109: 705 - 706.
- Wehr TA: The durations of human melatonin secretion and sleep respond to changes in daylength (photoperiod). J Clin Endocrinol Metab 1991; 73: 1276 - 1280.
- Winkelman, JW: Insomnia Disorder. N Engl J Med 2015; 373;15.
Für die Verfasser
Oberstarzt d. R. Dr. Hermann C. Römer,
Universitätsklinikum Essen – Institut für Allgemeinmedizin
Pelmanstrasse 81, 45131 Essen
E-Mail: [email protected]
Datum: 11.05.2018