YES, S-I-R! SENSIBILITÄTSTESTUNG NEUER ANTIBIOTIKA ERFORDERT STRENGE RICHTLINIEN
Yes, S-I-R! Susceptibility testing of a new substance requires strict rules
Aus dem Institut für Mikrobiologie der Bundeswehr, München¹ (Leiter: Oberstarzt Prof. Dr. Zöller), der Firma MerLion Pharmaceuticals GmbH, Berlin² (Geschäftsführer: Dr. A. Vente) und dem Institut für Medizinische Mikrobiologie und Infektionsepidemiologie der Universität Leipzig³ (Direktor: Prof. Dr. A.C. Rodloff)
Gelimer H. Genzel¹, Enrico Georgi¹, Andreas Vente², Sabine Schmoldt¹, Reiner Schaumann³, Holger C. Scholz¹
WMM, 58. Jahrgang (Ausgabe 2/2014; S. 47-49)
Zusammenfassung
Die Resistenztestung bakterieller Krankheitserreger unterliegt nationalen und internationalen Richtlinien. Das Institut für Mikrobiologie der Bundeswehr (InstMikroBioBw) hat diese Richtlinien im Rahmen der Akkreditierung nach DIN EN ISO 15189 im Zentralbereich Diagnostik umgesetzt. Dieser Artikel gibt einen Überblick über die wichtigsten Methoden zur Testung und beleuchtet die Herausforderungen bei der Harmonisierung divergenter nationaler Regelwerke.
Neben der routinemäßigen Testung etablierter Wirkstoffe werden am Institut auch neue Substanzen mit Wirksamkeit gegen Erreger mit Relevanz für den medizinischen B-Schutz bewertet. Eine dieser neuen Substanzen ist Finafloxacin, ein neues Fluorchinolon mit breitem Wirkungsspektrum und verbesserter antimikrobieller Aktivität in lokal azidotischen, infizierten Geweben. Die am Institut für Mikrobiologie der Bundeswehr erhobenen vorläufigen Ergebnisse zeigen, dass dieses Antibiotikum auch zur Behandlung potenzieller Bioterror-relevanter Erreger wie F. tularensis geeignet sein könnte. Diese Studien dienen nach den Richtlinien des European Committee on Antimicrobial Susceptibility Testing (EUCAST) zur Festlegung von erregerspezifischen Grenzwerten und damit zur Interpretation von Testergebnissen zu klinischen Untersuchungsproben.
Schlüsselwörter: Empfindlichkeitsprüfung, Bakterielle B-Kampfstoffe, Fluorchinolon
Summary
Antimicrobial Susceptibility Testing (AST) underlies strictly defined national and international standards. These guidelines were implemented at central diagnostic unit of the Bundeswehr Institute of Microbiology according to DIN EN ISO 15189. This article provides an overview of AST key methods and highlights the challenges of harmonizing divergent national standards.
Besides the testing with already established substances, the Bundeswehr Institute of Microbiology is investigating new antibiotics with a promising activity against biothreat agents. One of these substances is Finafloxacin (FIN), a novel fluoroquinolone, with a broad spectrum activity in local acidic inflammated tissues.
Preliminary results suggest that FIN might be a therapeutic option for infections with potential biothreat agents like F. tularensis. These studies are also suitable for defining clinical breakpoints according to the European Commitee on Antimicrobial Susceptibility Testing (EUCAST) and thus for interpretation of clinical samples.
Keywords: susceptibility testing, biothreat agents, investigational fluoroquinolone
Einführung
Eine Kernaufgabe der Medizinischen Mikrobiologie ist die Testung der Wirksamkeit von antimikrobiellen Substanzen gegenüber Infektionserregern. Die stetige Zunahme von (multi-)resistenten Bakterien aus klinischen Untersuchungsmaterialien mit unterschiedlichsten Resistenzmechanismen stellt hohe Anforderungen an die Diagnostik. Je nach eingesetzter Methode und der zu testenden Erreger ergibt sich eine unterschiedlich lange Untersuchungsdauer. Phänotypische Verfahren, die auf ein ausreichendes Wachstum der Bakterien angewiesen sind, benötigen mindestens 24h (bei langsam wachsenden Spezies sogar bis zu 48h) bis zum Ergebnis. Inzwischen stehen auch molekularbiologische Verfahren zur Verfügung, die demgegenüber innerhalb weniger Stunden den Nachweis von Resistenzgenen führen können. Da genotypische Test jeweils nur bestimmte Resistenzmechanismen nachweisen, müssen sie durch phänotypische Tests ergänzt werden.
Es sind eine Reihe verschiedener Untersuchungen zur Resistenztestung entwickelt worden. Ein weit verbreitetes Verfahren ist der Agardiffusionstest bzw. „Plättchentest“. Dabei werden mit verschiedenen Antibiotika beschickte Testplättchen auf Agarplatten aufgebracht, die zuvor mit Reinkulturen von Bakterien inokuliert wurden. Nach 24 bis 48 Stunden bilden sich charakteristische Hemmhöfe, deren Durchmesser als Maß für die Empfindlichkeit interpretiert werden können. Als Referenzmethode gilt jedoch die Ermittlung der minimalen Hemmkonzentration (MHK) in (mg/l) durch die Mikrobouillondilution. Die Durchführung dieser Methode unterliegt dabei eng definierten Standards: Eine bestimmte Menge der zu testenden Bakterienkultur (Inokulum) wird in ein festgelegtes Flüssignährmedium eingebracht, das wiederum eine definierte Konzentration des zu testenden Antibiotikums enthält. In der Praxis werden in Mikrotiterplatten geometrische Verdünnungsreihen der zu testenden Substanzen angelegt. Nach der Beimpfung mit der Bakteriensuspension wird das Wachstum nach 24 und ggf. nach 48-stündiger Bebrütung beurteilt. Entscheidend ist, welche Konzentrationen des Antibiotikums das Wachstum der Bakterienkulturen sichtbar hemmt. Diese Konzentration wird als MHK bezeichnet.
Als Ergebnis wird dem behandelnden Arzt die in-vitro Wechselwirkung zwischen Bakterium und Antibiotikum als „Sensibel“, „Intermediär“ oder „Resistent“ berichtet. Diese Beurteilung erfordert sog. Klinische Grenzwerte (clinical breakpoints), mit der die erhobenen MHK-Werte kategorisiert werden. Diesen Grenzwerten liegen verschiedene Daten, wie z. B. klinische Studien, sowie pharmakokinetische und -dynamische Daten der Substanz zu Grunde. Bakterienstämme gelten demnach als „sensibel“ gegenüber einem Antibiotikum, wenn die ermittelte MHK mit einem hohen Therapieerfolg assoziiert ist. Entsprechend gelten Bakterien als „intermediär“, bei denen der Therapieerfolg als unsicher zu werten ist. Bei resistenten Bakterienstämmen ist ein Therapieversagen höchst wahrscheinlich [1].
Um bei diesem Testverfahren eine zuverlässige Reproduzierbarkeit zu gewährleisten, wurden die erwähnten Arbeitsschritte und die Interpretation der Ergebnisse von verschiedenen Fachgesellschaften, wie z.B. EUCAST und Clinical Laboratory Standards Institute (CLSI) festgelegt [2, 3]. Problematisch ist hierbei, dass für bestimmte Erregergruppen keine oder nur ältere Verfahrensanweisungen und Grenzwerte existieren. Für B-Agenzien, wie z. B. Bacillus anthracis, Francisella tularensis und Yersinia pestis sind Testverfahren nur nach CLSI-Richtlinien festgelegt [2]. Weiterhin sind für neuere Tests, wie dem Gradientendiffusionstest als Sonderform des Agardiffusionstests, die jeweiligen Standards noch nicht endgültig definiert.
Am InstMikroBioBw wurden die existierenden Richtlinien zur Sensibilitätstestung bakterieller Erreger im Rahmen der Akkreditierung nach DIN EN ISO 15189 im Zentralbereich Diagnostik für alle B-relevanten Erreger herangezogen und etabliert. Aus dieser Erfahrung entwickelte sich das Vorhaben, diese Verfahrensanweisungen für die bakteriellen B-Agenzien weiter zu entwickeln sowie die Wirksamkeit neuerer Antibiotika, wie dem Fluorchinolon Finafloxacin, systematisch zu testen. Das Institut beteiligt sich auch an Netzwerken zur internationalen Harmonisierung von Antibiotikaresistenztestung (QUANDHIP).
Testung neuer Substanzen: Finafloxacin
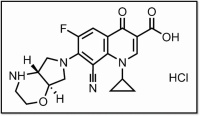
Im Rahmen bakterieller Infektionen kommt es lokal zu azidotischen Bedingungen, das Aktivitätsmaximum vieler Antibiotika liegt jedoch im neutralen pH-Bereich. Mit Finafloxacin (Abb.1) wurde ein neues Fluorchinolon identifiziert, das im Vergleich zu anderen Gyrasehemmern bereits in verschiedenen Studien eine nachweislich höhere Aktivität im sauren Milieu aufweist [4]. Funktionell wird diese neue Substanz wie Moxifloxacin der Gruppe 4 mit breitem Wirkungsspektrum gegen gramnegative und grampositive Bakterien einschließlich Anaerobiern und Biofilmbildnern zugeordnet, da neben der Topoisomerase II (Gyrase) auch die Topoisomerase IV inhibiert wird. Dadurch kann die Substanz selbst bei Ciprofloxacin-resistenten Stämmen wirksam sein [5, 6]. Bisherige Studien zeigen zudem eine deutlich stärkere Affinität zur bakteriellen Topoisomerase im Vergleich zur humanen Isoform, was mit einem günstigen Nebenwirkungsprofil einhergehen könnte. Derzeit werden für Harnwegs- und respiratorische Infektionen durch typische Krankenhauskeime parallel bereits klinische Phase II- und III-Studien zu der neuen Substanz durch den Hersteller durchgeführt.
Abb. 1: Struktur des Fluorchinolons Finafloxacin.
Im Rahmen einer in-vitro-Studie am Institut für Mikrobiologie der Bundeswehr wird untersucht, ob diese Substanz auch bei Infektionen mit hochpathogenen gramnegativen Bakterien geeignet sein könnte. Dazu wurden neben Francisella tularensis, dem Erreger der Tularämie, verschiedene Spezies von Yersinia, Burkholderia und Brucella aus der institutseigenen Stammsammlung ausgewählt und in die Studie eingeschlossen.
Methodisches Rückgrat bildet die Mikrobouillondilutionsmethode mit Bestimmung der MHK, die als Goldstandard der Empfindlichkeitsprüfung gilt. Dazu wurden spezielle Testplatten konzipiert, um standardisiert Bakterienstämme in Flüssigkulturen bei unterschiedlichen pH-Werten gegenüber verschiedenen Fluorchinolonen (Finafloxacin, Moxifloxacin und Ciprofloxacin) und über einen weiten Konzentrationsbereich zu testen. Nach einer erregerspezifischen Inkubationszeit von 24 bis 48 Stunden wird dabei die phänotypische Resistenz durch Nachweis des Wachstums in Anwesenheit verschiedener Antibiotikakonzentrationen visuell und mittels einer photometrischen Messung objektiv ausgewertet.
Die ersten vorläufigen Ergebnisse der Studie sind vielversprechend. Sie bestätigen, dass Finafloxacin auch bei hochpathogenen Bakterien eine interessante Therapieoption darstellen könnte, da niedrige MHK-Werte als Maß für die hohe Empfindlichkeit gegenüber der antimikrobiellen Substanz auch im leicht sauren Milieu erzielt werden können.
Schlussfolgerung
Die antimikrobielle Empfindlichkeitstestung bedarf eines strikten Qualitätsmanagements. Dabei bleibt die Durchführung gerade bei den oft langsam wachsenden und anspruchsvollen B-Agenzien herausfordernd, zumal die Arbeiten in Laboratorien der Sicherheitsstufe BSL3 durchzuführen sind.
Neben Krankheitsbild und Erreger schränken vor allem unerwünschte Arzneimittelnebenwirkungen und zunehmend auch (Multi-)Resistenzen die Auswahl der beim individuellen Patienten anwendbaren Antibiotika stark ein. In den letzten Jahrzehnten wurden vergleichsweise wenige innovative Substanzklassen zur Marktreife entwickelt; somit stellt die Entwicklung und Prüfung neuer Antibiotika eine der wichtigsten Aufgaben der anwendungsorientierten mikrobiologische Forschung dar.
Insgesamt weisen viele der bisherigen antimikrobiellen Wirkstoffe ein Aktivitätsmaximum im neutralen pH-Bereich auf, obwohl bakterielle Infektionen in Verbindung mit Immunabwehrmechanismen zu lokal azidotischen Verhältnissen führen. Eine interessante Ausnahme davon wurde bei der neuen Substanz Finafloxacin beobachtet, die im Vergleich zu anderen, ähnlich wirkenden Antibiotika wie Ciprofloxacin, insbesondere im leicht sauren Milieu gegenüber einigen Bakteriengattungen eine höhere Aktivität zeigt. Am InstMikroBioBw wird die Substanz derzeit systematisch getestet. Vorläufige Daten deuten darauf hin, dass sich die erhöhte Aktivität im sauren Milieu auch gegenüber B-Waffen relevanten Bakterien nachweisen lässt. Die Ergebnisse dieser anwendungsorientierten Forschung auf dem Gebiet des Medizinischen B-Schutzes sind ein wichtiger Baustein bei der Festlegung von erregerspezifischen Grenzwerten durch das EUCAST Steering Committee [7].
Interessenkonflikt: Die Verfasser erklären, dass kein Interessenkonflikt besteht.
Literatur
- Rodloff AC et al. (2008): Sensibel, Intermediär, Resistent-Wirkintensität von Antibiotika. 2008; Dtsch Arztebl 2008 105: 657 - 62.
- Clinical and Laboratory Standards Institute: Performance Standards for Antimicrobial Susceptibility Testing M100-S20. 2010.
- Mouton JW et al. (2012): The role of pharmacokinetics/pharmacodynamics in setting clinical MIC breakpoints: the EUCAST approach. 2012; Clin Microbiol Infect. 18: E37 - 45.
- Stubbings WJ et al. (2011): In vitro spectrum of activity under standard and acidic conditions of finafloxacin; a novel, pH activated fluoroquinolone. Antimicrob Agents Chemother 2011; 55:4394-7.
- Higgins PG et al. (2010): Activity of the Investigational Fluoroquniolone Finafloxacin against Ciprofloxacin-Sensitive and –Resistant Acinetobacter baumannii Isolates. Antimicrob Agents Chemother 2010; 54:1613-5.
- Emrich NC et al. (2010): Antibacterial activity of finafloxacin under different pH conditions against strains of Escherichia coli expressing combinations of defined mechanisms of fluoroquinolone resistance. J Antimicrob Chemother 2010; 65: 2530-3.
- European Committee on Antimicrobial Susceptibility Testing. Setting breakpoint for new antimicrobial agents, EUCAST SOP 1.1, 2013. http://www.eucast.org
Datum: 30.03.2014
Quelle: Wehrmedizinische Monatsschrift 2014/2