Oxidativer Stress durch hyperbare Hyperoxie und dessen Wirkung auf periphere mononukleäre Zellen (PBMC) – eine Übersicht über den aktuellen Forschungsstand am Schifffahrtmedizinischen Institut der Marine
Hyperoxia-induced oxidative stress and its impact on peripheral mononuclear cells (PBMC) – an overview about the actual status of research at the German Naval Medical Institute
Aus der Abteilung III - Gemeinsame Sektion Maritime Medizin mit der Christian-Albrechts-Universität zu Kiel (Abteilungsleiter: Flottenarzt Prof. Dr. med. A. Koch) des Schifffahrtmedizinischen Institutes der Marine (Leiter: Flottenarzt Dr. med. S. Neidhardt)
Wataru Kähler, Frauke Tillmans, Sebastian Klapa, Inga Koch, Julia Last, Andreas Koch
WMM, 60. Jahrgang (Ausgabe 2/2016; S. 50-55)
ORIGINALARBEIT
Zusammenfassung
Die extreme Hyperoxie wie beim Tauchen mit Kreislaufgeräten oder in der HBO-Therapie (Hyperbare Oxygenierung) ist ein für den Betroffenen unphysiologischer Zustand, der mit einer Reihe von Folgen auch auf zellulärer Ebene einhergeht, die mit hoher Wahrscheinlichkeit dem oxidativen Stress zugeordnet werden können. Dies lässt sich zum Beispiel durch den Anstieg von dihydroxylierten Benzoaten (DHB) im Urin nach Exposition nachweisen.
Wir konnten an peripheren mononukleären Zellen (PBMC) zeigen, dass durch Hyperoxie induzierter oxidativer Stress dosisabhängig Doppelstrangbrüche an der DNA initiiert; gleichzeitig scheint der gesunde Organismus aber in der Lage zu sein, sich bis zu einem gewissen Grade aktiv und zumindest teilweise vor den Folgen wiederholter Hyperoxie schützen zu können.
Es steht zu vermuten, dass das gesamte Bild der Wirkungen der Hyperoxie auf zellulärer Ebene sehr komplex ist, so dass hier großer Forschungsbedarf hinsichtlich der Gesundheitseffekte besteht, insbesondere bei dienstlicher Belastung von Soldaten.
Auch besteht die Möglichkeit, durch gezielte Forschung im Bereich der Hyperoxie neue und wichtige Erkenntnisse für den therapeutischen Einsatz der hyperbaren Oxigenierung zu gewinnen.
Schlüsselworte: Hyperoxie, PBMC, oxidativer Stress, Doppelstrangbrüche
Summary
Extreme hyperoxia in closed-circuit diving or in HBO-therapy (hyperbaric oxygenation) is an unphysiologic state with a number of consequences – even on the cellular level – most probably due to oxidative stress. This can be measured by an increase in the biomarker DHB (dihydroxylated benzoate) in urine after exposure.
We have shown that, depending on dose, hyperoxia-induced oxidative stress initiates breaks in the DNA-doublestrand in peripheral mononuclear cells (PBMC); healthy organisms, however, seem capable to adapt actively to repetitive hyperoxia to a certain degree and thus at least partially protect against cellular damage.
We suspect that the full picture of the effects of hyperoxia on a cellular level is rather complex; much further research into health effects is therefore required, particularly in the light of official exposure of soldiers to hyperoxia.
Moreover, targeted research in the field of hyperoxia might lead to important new insights in HBO-therapy.
Keywords: hyperoxia, PBMC, oxidative stress, double-strand--breaks
Einleitung
Beim Tauchen, insbesondere mit Kreislauftauchgeräten, in der Sauerstoff-Überdruckmedizin (HBO), aber auch zum Beispiel in der Anästhesie, wird der Mensch einer milden (pO2 > 21 kPa) bis hin zu einer extremen Hyperoxie (pO2 bis in Bereiche von 280 - 300 kPa) ausgesetzt. Im Gegensatz zum Stickstoff, der in der Tauchphysiologie als Inertgas zählt, da er primär nicht im Körper biochemisch umgesetzt wird, ist der Sauerstoff an mannigfaltigen Stoffwechselprozessen beteiligt, allen voran in der Atmungskette, wo er schrittweise zu Wasser reduziert wird und damit die aerobe Energiegewinnung überhaupt erst möglich macht.
Die unbestreitbaren und mannigfaltigen positiven Aspekte der Hyperoxie beim Tauchen wie auch in der Therapie einer Vielzahl von Erkrankungen werden allerdings zwangsläufig von den Effekten des sogenannten oxidativen Stresses begleitet. Dessen Effekte – gerade unter extremer Hyperoxie – auf der Ebene peripherer Blutzellen sind Gegenstand dieses Beitrages.
Eine vollständige Übersicht über alle nachgewiesenen bzw. postulierten Effekte der Hyperoxie auf verschieden Organsysteme ist nicht beabsichtigt und würde den Rahmen dieses Beitrags sprengen.
Eine zentrale Rolle werden bei der Betrachtung die reaktiven Sauerstoffspezies (ROS) spielen, die auch als „Sauerstoffradikale“ bezeichnet werden.
Mechanismen der ROS-Bildung unter Hyperoxie
Aerob lebende Zellen sind zur Energieproduktion in ihren Mitochondrien auf molekularen Sauerstoff angewiesen, so dass primär in der Atmungskette, aber auch in vielen anderen Stoffwechselwegen, ständig geringe Mengen ROS und auch RNS (reaktive Stickstoffverbindungen) entstehen, die als starke Oxidationsmittel oder freie Radikale schädigend auf biologische Strukturen wirken können. Dabei sind einige Vertreter der ROS durchaus als wichtige physiologische Signalvermittler im biologischen System bekannt, und werden sogar im Rahmen des „oxidative burst“ von Zellen des Immunsystems generiert
Ein bislang unwidersprochener Erklärungsansatz geht davon aus, dass O2–-Ionen (Superoxid) am Komplex II und III der Atmungskette „fehlerhaft“ bei Überangebot von Sauerstoffmolekülen entstehen oder auch direkt am Komplex IV unter Hyperoxie vermehrt verschiedene ROS gebildet werden. Hier wird angenommen, dass die schrittweise Reduktion von Sauerstoff zu Wasser bei Hyperoxie dergestalt gestört wird, dass die Übertragung der vier Elektronen teilweise nicht vollständig bis zum Wasser abläuft, sondern die in den Zwischenschritten entstehenden ROS frühzeitig von im Überfluss vorhandenen O2-Molekülen verdrängt werden, die ihrerseits nun in ROS umgewandelt werden.
Gerade die hierbei unter anderem entstehenden Superoxidanionen können dann durch die Superoxiddismutasen zu H2O2 umgewandelt werden und somit in eine metastabile Form überführt werden, die das Mitochondrium verlassen kann.
Auch extramitochondrial können intrazellulär an verschiedenen Stellen ROS gebildet oder umgewandelt werden, so zum Beispiel durch die Myeloperoxidasen oder an freien Übergangsmetalldepots in der Zelle (z. B. Fe2+-Cluster) [1].
Darüber hinaus können unter Hyperoxie auch vermehrt reaktive Stickstoffverbindungen (sogenannte RNS) entstehen; ein relevanter Vertreter ist hier das Peroxinitrit ONOO–, das aus NO und dem Superoxidradikal entsteht (O2•− + •NO → ONOO−).
Negative Aspekte der Hyperoxie
Es ist bekannt, dass Hyperoxie neben seinen physiologischen auch schädliche Einflüsse auf den Organismus haben kann. So sind eindeutige Dosis-Wirkungs-Abhängigkeiten der Hyperoxie für die Schädigung des Lungengewebes sowie für die ZNS-Toxizität bis hin zu cerebralen Krampfanfällen nachgewiesen worden. Auch scheint die individuelle Empfindlichkeit für die sauerstoffinduzierte Neurotoxizität unterschiedlich zu sein, was sich bei der Durchführung des für den angehenden Kreislaufgerätetaucher (Minentaucher, Kampfschwimmer) mandatorischen Sauer-stofftoleranztests immer wieder zeigt [2, 3].
Sehr viel weniger ist dagegen bekannt, wie sich Hyperoxie auf die zelluläre Integrität selbst auswirkt, ob also durch Hyperoxie ein relevanter ROS- und RNS-induzierter oxidativer Stress generiert wird, der in der Lage ist, zelluläre Strukturen nachhaltig zu schädigen.
Die Tatsache, dass oxidativer Stress negative biologische Wirkungen hat, ist hinlänglich bekannt; ebenso steht fest, dass die Reduktion des Sauerstoffs zu Wasser am Komplex IV der Atmungskette in den Mitochondrien über radikalische Zwischenschritte erfolgt. Die meisten ROS habe jedoch eine extrem kurze Halbwertszeit, so dass ihr ganz überwiegender Teil direkt weiter zu Wasser reduziert wird. Fehlerhaft abdiffundierende ROS werden schnell durch lokale antioxidative Systeme (Gluthationsystem, Vitamin A, C und E, Superoxiddismutasen, Katalasen) entgiftet.
Auf der anderen Seite ist Sauerstoff – auch bei Hyperoxie – nicht spontan reaktiv, sondern benötigt – in der Regel durch enzymatische Aktivierung – Aktivierungsenergie, so dass ein Überangebot an inspiratorischem Sauerstoff per se noch nicht schädlich sein sollte. Auch ist nicht zu erwarten, dass bei Hyperoxie der Umsatz an O2 am Komplex IV der Atmungskette stark gesteigert wird, solange kein wesentlich erhöhter ATP-Bedarf besteht.
Allerdings konnte in der Vergangenheit in Zelluntersuchungen gezeigt werden, dass mit zunehmender Hyperoxie nicht nur die Konzentration der Superoxidradikale, sondern auch der H2O2-Gehalt in den Mitochondrien linear zum Sauerstoffpar-tialdruck steigt. Offensichtlich führt also Hyperoxie direkt zu einer Zunahme von H2O2, das zwar kein Radikal ist, aber zu den ROS gezählt wird und metastabil ist [4, 5].
Wo liegt nun das mögliche Problem erhöhter H2O2-Spiegel infolge Hyperoxie? H2O2 per se ist nur ein relativ schwach schädigendes Agens, kann allerdings über die Fenton-Reaktion in das höchstreaktive Hydroxylradikal (OH) überführt werden, das praktisch jede zelluläre Struktur – auch DNA – sehr effektiv oxidativ angreifen und schädigen kann. Für die Fenton-Reaktion ist zwar freies Fe2+ notwendig; dieses wurde aber praktisch überall intrazellulär – auch im Nukleus – bereits nachgewiesen [6].
Damit liegt es nahe, dass Hyperoxie in der Lage sein sollte, auch empfindliche Strukturen einer Zelle wie die DNA zu schädigen und hier sogar Doppelstrangbrüche auslösen zu können.
Dihydroxylierte Benzoate zum Nachweis Hyperoxie-induzierten oxidativen Stresses
Der direkte Nachweis von ROS im Rahmen einer Hyperoxie ist fast nicht möglich, da die Halbwertszeit der Radikale teilweise extrem kurz ist. Allerdings haben sich in der Forschung eine Reihe von Biomarkern etabliert, die sich als Indikatoren für oxidativen Stress anbieten. Einen dieser stabilen Biomarker stellt die Gruppe der dihydroxylierten Benzoate (DHB) dar [7]. Ausgangssubstrat hier ist die Hippursäure, die an Glycin gekoppelte Benzoesäure, die im Körper unter anderem wahrscheinlich antioxidative Aufgaben wahrnimmt. Da die Ringstruktur der Benzoesäure durch OH-Radikale hydroxyliert werden kann, eignet sich der Nachweis der im Urin ausgeschiedenen recht stabilen deglycinierten DHB als leicht zu gewinnender und nichtinvasiver Biomarker für vor allem durch OH-Radikale vermittelten oxidativen Stress.
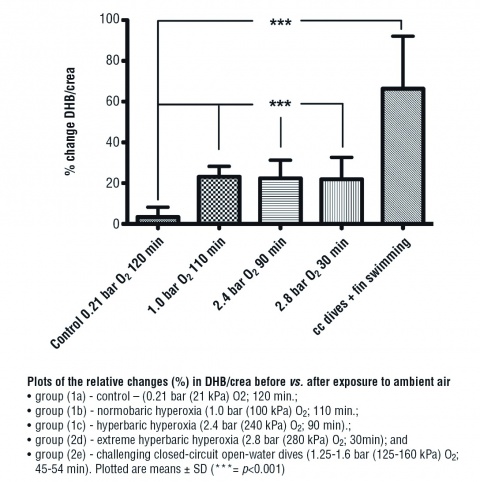
Kürzlich konnte durch unsere Gruppe nachgewiesen werden, dass es unter Hyperoxie zu einem signifikanten Anstieg der DHB im Urin kommt, hier also ein erhöhter oxidativer Stress nachzuweisen ist. Darüber hinaus zeigten Urinproben von Kampfschwimmern nach Tauchgängen mit dem geschlossenen Sauerstoff-Kreislauftauchgerät LAR V (Dräger™) Anstiege der DHB, die weit über den Werten für reine Hyperoxiebedingungen lagen. Hier ist zu vermuten, dass die erhebliche körperliche Belastung während der Tauchgänge im Freiwasser ganz wesentlich zu dem gemessenen Anstieg der DHB in der Urinprobe vom Tauchgang im Vergleich zur vorherigen Ruhephase beigetragen hat, dass also die Kombination von Hyperoxie und körperlicher Belastung zu einem überadditiven Effekt auf messbare Biomarker für oxidativen Stress führt (Abbildung 1) [8 - 10].
Effekte der Hyperoxie auf Zellen des Immunsystems
Wie oben ausgeführt, führt Hyperoxie, insbesondere in Kombination mit körperlicher Belastung, zu oxidativem Stress, der sich durch verschiedene Biomarker nachweisen lässt. Sehr viel weniger ist dahingegen bekannt, wie sich Hyperoxie-Stress auf die zelluläre Integrität auswirkt.
Gerade im Hinblick auf mögliche Auswirkungen auf die Gesundheit ist hier von großem Interesse, ob Hyperoxie relevante zellschädigende Effekte, allen voran DNA-Doppelstrang-brüche, in den mononukleären Zellen (PBMCs) des Immunsystems auslösen kann.
DNA-Doppelstrangbrüche greifen tief in die Integrität einer Zelle ein, in deren Folge eine Reparatur der Schäden erfolgen muss, die möglichst ohne Fehler ablaufen sollte, um das Risiko einer Entartung betroffener Zellen nicht zu erhöhen. An Stelle eines Reparaturprozesses kann auch die Apoptose einer Zelle eingeleitet werden, um auf diese Weise den Schaden für den Organismus zu begrenzen. Die hierzu verfügbare Literatur ist noch spärlich, aber es konnte in der Vergangenheit insbesondere nach HBO-Therapien initial ein erhöhtes Maß an DNA-Einzel- und Doppelstrangbrüchen insgesamt und auch speziell in peripheren mononukleären Zellen (PBMCs) im Comet-Assay (alkalische Einzelzell-Gelelektrophorese) nachgewiesen werden [11, 12]. Bereits 1991 konnte in diesem Zusammenhang von HALLIWELL und ARUOMA gezeigt werden, dass der Angriff von Hydroxylradikalen am Zucker-Phosphat-„Back-bone“ der DNA durch Abstraktion von Wasserstoffatomen zu Einzel- und Doppelstrangbrüchen der DNA führt [13, 14]. Allerdings war bislang nicht bekannt, ob es eine sichere Dosis-Wirkungsbeziehung zwischen Höhe des pO2 und Dauer der Hyperoxie sowie dem Ausmaß der Doppelstrangbrüche gibt, was für die Abschätzung eines potenziellen gesundheitlichen Risikos verschiedener Grade der Hyperoxie von entscheidender Wichtigkeit ist.
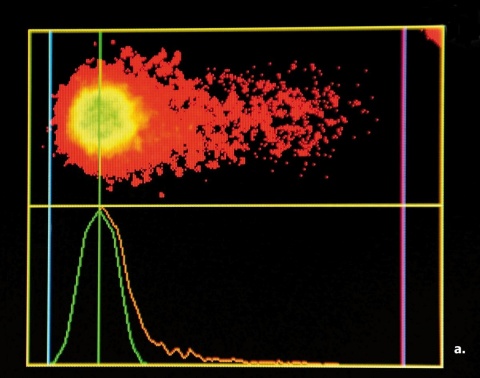
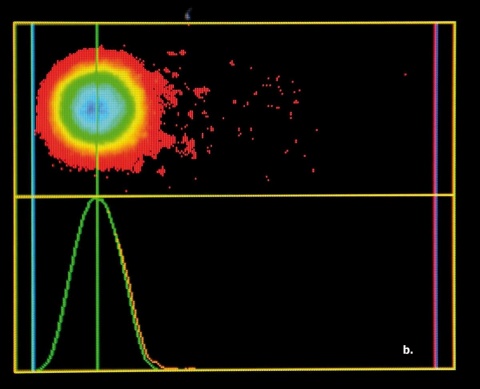
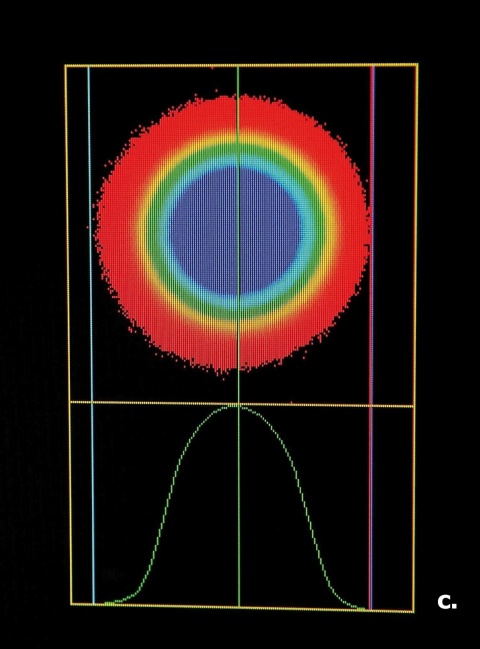
Nachweis von DNA-Doppelstrangbrüchen mit dem sogenannten Comet-Assay
Die direkte Darstellung von DNA-Doppelstrangbrüchen gelingt mit dem sogenannten Comet-Assay (Einzelzell-Gel-elektro-phorese). Zur Auswertung verwendet unsere Arbeitsgruppe bevorzugt das Yes/No-Prinzip (Abbildung 2):
200 Zellen werden pro Objektträger klassifiziert und der prozentuale Anteil an Nuklei mit sichtbaren DNA-Fragmenten dokumentiert, wobei das Ausmaß der Schädigung nicht differenziert wird. Die alternative Berechnung des Tailmoments, bei der etwas vereinfacht eine Quantifizierung der DNA-Schäden über das Verhältnis von Kometen-“kopf“ zu -„tail“ angestrebt wird, liefert ähnliche, jedoch weniger konsistente Ergebnisse.
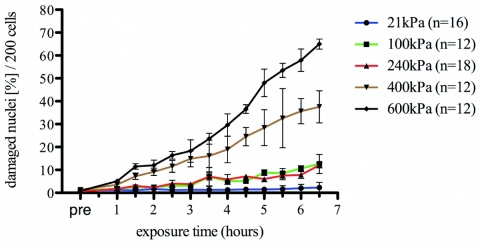
Die Dosis-Wirkungsbeziehungen zwischen pO2 und Exposi-tionsdauer der isolierten Zellen in der Experimentaldruckkammer einerseits und prozentualem Anteil geschädigter Nuklei der PBMC andererseits sind in Abbildung 3 dargestellt.
Die über weite Teile linearen Dosis-Wirkungsbeziehungen machen deutlich, dass zumindest für isolierte und ex-vivo untersuchte PBMCs extreme Hyperoxie ein schädigendes Agens auf Nucleus-Ebene darstellt. Hierbei sollte auch beachtet werden, dass bereits ein pO2 von 100 kPa, also die Gabe von 100 % Sauerstoff, ab circa drei Stunden Expositionszeit der Zellen zu relevanten Anstiegen in den Prozentsätzen von Nuclei mit DNA-Doppelstrangbrüchen führte. Die errechneten Steigungen der Regressionsgraden unterschieden sich auch hier hochsignifikant (p < 0,001) von den Kontrollbedingungen (Raumluft, 21 kPa pO2).
Der Hyperoxie-Bereich von 100 - 240 kPa Sauerstoff ist der Bereich, der für das Tauchen mit Kreislauftauchgeräten, die HBO-Therapie (hyperbare Oxigenation) und für die Notfallmedizin von besonderer Relevanz ist.
Adaptation an rezidivierende Hyperoxie
Vor dem oben beschriebenen Hintergrund erscheint es nun besonders wichtig zu untersuchen, ob es unter rezidivierendem Hyperoxie-Stress, wie er zum Beispiel beim Kreislaufgerätetauchen auftritt, oder im Rahmen einer HBO-Therapie zu adaptiven Reaktionen kommt, ob also eine Induktion von Mechanismen zur Reduktion des unter anderem DNA-schädigenden oxidativen Stresses beobachtet werden kann. Hierzu finden sich in der Literatur bisher nur wenige Angaben. Soweit den Autoren bekannt, hat nur eine Arbeitsgruppe um SPEIT im Jahre 2000 adaptive Effekte auf Hyperoxie nach HBO-Therapie nachweisen können [18].
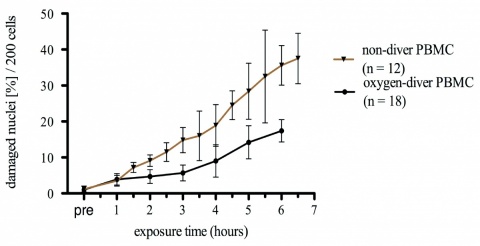
Wir untersuchten deshalb im eigenen Modell isolierte PBMCs von Nichttauchern im Vergleich zu aktiven Kampfschwimmern, die regelmäßig einer erheblichen Hyperoxie um 150 kPa pO2 mit Expositionszeiten bis zu maximal drei Stunden unter hoher körperlicher Belastung ausgesetzt sind, unter der Hypothese einer Adaptation an Hyperoxiestress.
Tatsächlich konnten für diese Soldaten hochsignifikant geringere Prozentsätze geschädigter Zellen im Comet-Assay (Hyper-oxie-Stress isolierter PBMCs mit 400 kPa pO2 über ein bis sechs Stunden) nachgewiesen werden. Der Anteil geschädigter Zellen lag teilweise bei nur circa 50 % des Anteils in der Kontrollgruppe (Abbildung 4).
Damit ließ sich im Rahmen des zur Zeit laufenden Vertragsforschungsprojektes „Hyperoxie und Immunkompetenz bei Tauchern und Kampfschwimmern“ erstmalig zeigen, dass auch jenseits eines experimentellen HBO-Ansatzes die tatsächliche durch das Kreislaufgerätetauchen bedingte Hyperoxie zur Induktion adaptiver Prozesse auf zellulärer Ebene führt, die den oxidativen Zellschaden reduzieren.
Im Zuge dieser Erkenntnis stellt sich nun die Frage, ob und, falls ja, in welchem Maße die Funktion der PBMCs als Zellen des aktiven Immunsystems oder auch deren weiteres Überleben durch Hyperoxie-Stress eventuell dennoch relevant beeinflusst wird. Auch dieser Aspekt wird aktuell im oben genannten Vertragsforschungsprojekt intensiv untersucht.
Fazit und Ausblick
Extreme Hyperoxie wie beim Tauchen mit Kreislaufgeräten oder in der HBO-Therapie (Hyperbare Oxygenierung) ist ein für den Betroffenen unphysiologischer Zustand, der mit einer Reihe von Folgen auch auf zellulärer Ebene einhergeht, die mit hoher Wahrscheinlichkeit dem oxidativen Stress zugeordnet werden können.
Dieser Hyperoxie-induzierte oxidative Stress kann offensichtlich Schäden an der DNA initiieren. Gleichzeitig aber scheint der gesunde Organismus in der Lage zu sein, sich bis zu einem gewissen Grade aktiv und zumindest teilweise vor den Folgen des oxidativen Stresses schützen zu können.
Die Frage, ob (und gegebenenfalls wie) dienstlich durch Hyperoxie belastete Soldaten – insbesondere in Kenntnis der eigenen Fähigkeit des Organismus zur Adaptation auf zellulärer Ebene – durch zusätzliche Maßnahmen vor möglicherweise negativen Effekten der Hyperoxie geschützt werden könnten und sollten, kann zur Zeit noch nicht beantwortet werden.
Es liegen aktuell zwar Daten zu PBMCs vor, es ist aber noch offen, ob andere Zellen und/oder Gewebe in ähnlicher Form reagieren, z. B. die besonders der Hyperoxie ausgesetzten Zellen des Lungengewebes. Auch der auf den ersten Blick eventuell sinnvoll erscheinende Einsatz von Antioxidantien muss sorgfältig geprüft werden, um nicht ungewollt pro-oxidative Effekte dieser Substanzen unter extremen Hyperoxie-Bedingungen auszulösen, die zusätzlich schädlich sein könnten.
Das gesamte Bild der Wirkungen der Hyperoxie auf zellulärer Ebene scheint sehr komplex zu sein, so dass hier weiterer Forschungsbedarf besteht – nicht zuletzt vor dem Hintergrund der beruflichen Exposition.
Unsere in dieser Übersicht zusammengefasst vorgestellten Ergebnisse eröffnen nicht zuletzt auch Möglichkeiten, durch gezielte Forschung auf dem Gebiet der Hyperoxie neue und wichtige Erkenntnisse für den therapeutischen Einsatz der hyperbaren Oxigenierung zu gewinnen.
Literatur
- Halliwell B, Gutteridge JM: Role of free radicals and catalytic metal ions in human disease: an overview. Methods Enzymol. 1990;186: 1-85.
- Koch AE, Koch I, Kowalski J, Schipke JD, Winkler BE, Deuschl G, et al.: Physical exercise might influence the risk of oxygen-induced acute neurotoxicity. Undersea Hyperb Med J Undersea Hyperb Med Soc Inc. 2013 Apr;40(2): 155-163.
- Koch AE, Kähler W, Wegner-Bröse H, Weyer D, Kuhtz-Buschbeck J, Deuschl G, et al.: Monitoring of CBFV and time characteristics of oxygen-induced acute CNS toxicity in humans. Eur J Neurol Off J Eur Fed Neurol Soc. 2008 Jul;15(7): 746-748.
- Turrens JF, Freeman BA, Levitt JG, Crapo JD: The effect of hyperoxia on superoxide production by lung submitochondrial particles. Arch Biochem Biophys. 1982 Sep;217(2): 401-410.
- Boveris A, Chance B: The mitochondrial generation of hydrogen peroxide. General properties and effect of hyperbaric oxygen. Biochem J. 1973 Jul;134(3): 707-716.
- Sanders SP, Zweier JL, Kuppusamy P, Harrison SJ, Bassett DJ, Gabrielson EW, et al.: Hyperoxic sheep pulmonary microvascular endothelial cells generate free radicals via mitochondrial electron transport. J Clin Invest. 1993 Jan;91(1): 46-52.
- Mályusz M, Kähler W, Gronow G: Hippurate metabolism as a hydroxyl radical trapping mechanism in the rat kidney. Kidney Blood Press Res. 2001;24(3): 149-158.
- Gronow G, Kähler W, Koch A, Klause N: Benzoate hydroxylation: a measure of oxidative stress in divers. Adv Exp Med Biol. 2005;566: 223-229.
- Kähler W, Koch I, Wohlrab C, Kowalski J, Witte J, Koch A: Influence of hyperoxia and physical exercise on *OH-radical stress in humans as measured by dihydroxylated benzoates (DHB) in urine. Undersea Hyperb Med J Undersea Hyperb Med Soc Inc. 2013 Jun;40(3): 231-238.
- Bader N, Bosy-Westphal A, Koch A, Rimbach G, Weimann A, Poulsen HE, et al.: Effect of hyperbaric oxygen and vitamin C and E supplementation on biomarkers of oxidative stress in healthy men. Br J Nutr. 2007 Oct;98(4): 826-833.
- Dennog C, Hartmann A, Frey G, Speit G: Detection of DNA damage after hyperbaric oxygen (HBO) therapy. Mutagenesis. 1996 Nov;11(6): 605-609.
- Rothfuss A, Stahl W, Radermacher P, Speit G: Evaluation of mutagenic effects of hyperbaric oxygen (HBO) in vitro. Environ Mol Mutagen. 1999;34(4): 291-296.
- Balasubramanian B, Pogozelski WK, Tullius TD: DNA strand breaking by the hydroxyl radical is governed by the accessible surface areas of the hydrogen atoms of the DNA backbone. Proc Natl Acad Sci U S A. 1998 Aug 18;95(17): 9738-9743.
- Halliwell B, Aruoma OI:. DNA damage by oxygen-derived species. Its mechanism and measurement in mammalian systems. FEBS Lett. 1991 Apr 9;281(1-2): 9-19.
- Nguyen J, Ma Y, Luo T, Bristow RG, Jaffray DA, Lu Q-B: Direct observation of ultrafast-electron-transfer reactions unravels high effectiveness of reductive DNA damage. Proc Natl Acad Sci U S A. 2011 Jul 19;108(29): 11778-11783.
- Chatterjee A, Koehl P, Magee JL: Theoretical consideration of the chemical pathways for radiation-induced strand breaks. Adv Space Res Off J Comm Space Res COSPAR. 1986;6(11): 97-105.
- Witte J, Kähler W, Wunderlich T, Radermacher P, Wohlrab C, Koch A: Dose-time dependency of hyperbaric hyperoxia-induced DNA strand breaks in human immune cells visualized with the comet assay. Undersea Hyperb Med J Undersea Hyperb Med Soc Inc. 2014 Jun;41(3): 171-181.
- Speit G, Dennog C, Eichhorn U, Rothfuss A, Kaina B: Induction of heme oxygenase-1 and adaptive protection against the induction of DNA damage after hyperbaric oxygen treatment. Carcinogenesis. 2000 Oct;21(10): 1795-1799.
Kernsätze
- Extreme Hyperoxie, wie beim Tauchen mit Kreislaufgeräten oder in der HBO-Therapie, führt zu oxidativem Stress.
- Oxidativer Stress lässt sich z.B. durch den Anstieg von dihydroxylierten Benzoaten (DHB) im Urin nachweisen.
- Hyperoxie-induzierter oxidativer Stress führt dosisabhängig zu Doppelstrangbrüchen an der DNA.
- Der gesunde Organismus scheint in der Lage zu sein, sich teilweise aktiv vor den Folgen wiederholter Hyperoxie schützen zu können.
- Die Wirkungen der Hyperoxie auf Zellebene erscheinen sehr komplex, so dass noch großer Forschungsbedarf bei dienstlich tauchenden Soldaten besteht.
Originalarbeit
Manuskriptdaten:
Eingereicht: 4.11.2015
Revidierte Fassung angenommen: 27.01.2016
Zitierweise:
Kähler W, Tillmanns F, Koch I, Last J, Koch A: Oxidativer Stress durch hyperbare Hyperoxie und dessen Wirkung auf periphere mononukleäre Zellen (PBMC) – eine Übersicht über den aktuellen Forschungsstand am Schifffahrtmedizinischen Institut der Marine. Wehrmedizinische Monatsschrift 2016; 60(2): 50-55
[1]
Nach dem niederländischen Arzt ITE BOEREMA benanntes Behandlungsschema in der Überdruckkammer.
Datum: 23.02.2016
Quelle: Wehrmedizinische Monatsschrift 2016/2













