NOSOKOMIALE BEDROHUNG IM KRANKENHAUS
Eine Einführung in das Problemfeld und Erkenntnisse aus der Versorgung libyscher Patienten
Circa 17 Millionen Patienten werden jährlich in deutschen Krankenhäusern behandelt, circa 3,5 – über 8 % erwerben während ihres Aufenthaltes eine Infektion. Bei ca. 4 % der betroffenen Patienten ist diese Infektion primäre Todesursache. Der überwiegende Teil wird durch multiresistente Keime verursacht. Exakte Daten sind schwer ermittelbar. Der ständigen Herausforderung, nosokomiale Infektionen zu vermeiden, müssen sich auch die Bundeswehrkrankenhäuser stellen.
Das Ziel ist erreichbar wenn ausreichend Fachpersonal zur Verfügung steht und zuvorderst ausgeprägtes Hygienebewusstsein das tägliche Handeln bestimmt. Der vorliegende Artikel soll in das Problemfeld und die gesetzlichen Vorgaben einführen. Der sich anschließende Beitrag von Oberstarzt Dr. Klein stellt die daraus resultierenden Maßnahmen für die Versorgung libyscher Patienten im Bundeswehrkrankenhaus Hamburg und gewonnene Erkenntnisse einer Empfehlung künftigen Handelns dar.
Unter einer nosokomialen Infektion (aus dem altgriechischen nósos „Krankheit“ und komein „pflegen“) versteht man eine in einer stationären oder ambulanten Einrichtung des Gesundheitswesens (Krankenhaus, Praxis) erworbene, klinisch manifeste Infektion, soweit die Infektion nicht schon vorher bestand. Nosokomial ist nicht gleichbedeutend mit iatrogen und beides bedeutet nicht zwangsläufig „schuldhaft verursacht“. Die enorme Anzahl der von nosokomialen Infektionen in deutschen Krankenhäusern betroffenen Patienten (die Deutsche Gesellschaft für Krankenhaushygiene spricht von ca. 600 000 Patienten/ Jahr) wird nicht nur mit zusätzlichem Leid und Schmerzen, erheblichen Folgeschäden bis hin zur Todesfolge belastet, die dadurch verursachten direkten und indirekten Kosten bewirken für Kliniken und Kassen, und damit für jeden einzelnen Versicherungsnehmer, einen wirtschaftlichen Schaden in Milliardenhöhe. Zusätzliche intangible Kosten sind kaum bezifferbar. Die European Association of Hospital Managers, Brüssel, beziffert den ökonomischen Schaden auf rund 5,5 Milliarden Euro pro Jahr alleine in Europa. Schon die aufwändigere Therapie kann die Behandlungskosten pro betroffenem Patienten durch entsprechend teuere Antibiotikaverabreichungen und wesentlich längere zusätzliche Verweilzeiten um 30 – 100 % ansteigen lassen. Dementsprechend resultieren aus Krankenhausinfektionen ca. zwei Millionen zusätzliche Krankenhausverweiltage pro Jahr und hohe zusätzliche Kosten aus daraus entstehenden Einnahmeverlusten. Eine britische Studie zu sozioökonomischen Folgen nosokomialer Infektionen aus den 90er Jahren ermittelte eine Erhöhung der Krankenhauskosten auf das 2,8-fache, insgesamt für Großbritannien zusätzliche Krankenhauskosten von 930 Mio. Pfund pro Jahr. Aus Deutschland liegen dazu leider keine aktuellen Berechnungen vor.
Soweit zu hier nur kurz angeschnittenen Punkten einer ökonomischen Betrachtung. Im klinischen Vordergrund stehen zunächst die Erkennung einer nosokomialen Infektion, deren systematische Erfassung und, in Folge, die resultierenden Maßnahmen zur Verhinderung einer Weiterverbreitung oder eines Ausbruches. Um Aussagen zu Häufigkeit, Verteilung und Vergleichbarkeit auf nationaler und internationaler Ebene tätigen zu können, bedarf es detaillierter Definitionen für die verschiedenen Arten nosokomialer Infektionen, z. B. für Harnwegsinfektionen oder postoperative Wundinfektionen. Die meisten Erfassungssysteme weltweit bedienen sich diesbezüglich der, in den 70er Jahren von den Centers for Disease Control and Prevention (CDC), USA beschriebenen und kontinuierlich weiterentwickelten Definitionen. In Deutschland werden seit 1997 darauf basierende Daten durch das vom Nationalen Referenzzentrum für Krankenhaushygiene und dem Robert-Koch-Institut aufgebauten Krankenhaus–Informations–Surveillance–System (KISS) erfasst. Zielsetzung von KISS ist es, für die kontinuierliche Überwachung von nosokomialen Infektionen einheitliche Methoden vorzugeben und mit Hilfe von teilnehmenden Krankenhäusern Referenzdaten zu erzeugen. Hierbei muss angemerkt werden, dass die Teilnahme an KISS auf freiwilliger Basis geschieht, die Daten sind anonymisiert und öffentlich zugänglich und können auch von nicht teilnehmenden Kliniken als Orientierung für eigenes, internes Qualitätsmanagement genutzt werden. Auch die Bundeswehrkrankenhäuser sind bei KISS beteiligt.
Eine nosokomiale Infektion entsteht, wenn ein wo auch immer angesiedelter Keim bei einem Patienten in einer Sanitätseinrichtung zu einer Infektion führt. Dabei spielt es keine Rolle, ob der Patient an seinem „eigenen“ mitgebrachten Keim erkrankt oder ihn direkt oder indirekt von einem anderen Patienten erhält. Eine reine Besiedlung ohne Infektionszeichen ist keine nosokomiale Infektion, man spricht hier von einer Kolonisierung. Kolonisiert sein können Patienten wie auch gesunde Menschen außerhalb des Krankenhauses, Daten darüber sind äußerst spärlich vorhanden. So kann ein Patient, der mit einer Oberschenkelhalsfraktur ins Krankenhaus eingeliefert wird, zusätzlich mit einem multiresistenten Keim, beispielsweise einer Klebsielle, besiedelt sein. Bezüglich des Keimes ist er dann noch kein Patient. Kommt es im Verlauf des Klinikaufenthaltes jedoch zu einer Infektion, beispielsweise einer Pneumonie mit dieser Klebsielle, so hat der Patient eine nosokomiale, weil im Krankenhaus erworbene, Infektion. Bezüglich des Ursprungs handelt es sich hier um eine endogene, weil aus der eigenen Körperflora stammenden, Infektion. Bei einer von einer äußeren Infektionsquelle übertragenen nosokomialen Infektion spricht man von exogener Infektion. Ihr Anteil beträgt etwa ein Drittel aller nosokomialen Infektionen. Diese exogenen Infektionen können durch geeignete Präventivmaßnahmen im Hygienemanagement und -handeln idealerweise vollständig zurückgedrängt werden. Bei endogenen Infektionen liegen noch keine belastbaren Daten zur Reduzierbarkeit vor. Konsequent angewandte antibakterielle Maßnahmen wie z. B. antiseptische Waschungen der Patienten können aber sehr wohl einen positiven Einfluss auf die Vermeidung von iatrogenen Infektionen haben. Dies wird in der Abhandlung der Hygienemaßnahmen bei Versorgung der libyschen Patienten im Bundeswehrkrankenhaus Hamburg im nächsten Artikel noch eingehend unterlegt.
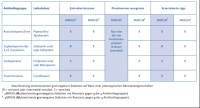
Compliance der Händesedinfektion, Autor: FItlA Helm.
Besondere Bedeutung haben klinisch erworbene nosokomiale Infektionen in den letzten Jahrzehnten durch die Tatsache erhalten, dass sich das auslösende Keimspektrum mit steigender Tendenz in Richtung multiresistenter Erreger (MRE) verschoben hat. Die Bezeichnung MRE bezieht sich hier auf Keime, die gegen eine oder mehrere Antibiotika-Stoffgruppen Resistenzen erworben haben. Natürliche Resistenzen, wie sie beispielsweise Enterokokken gegen Cephalosporine oder Anaerobier gegen Aminoglykoside besitzen, finden in diesem Zusammenhang keine Beachtung. Im mikrobiologischen Labor können Erreger unter dem Mikroskop anhand ihrer unterschiedlichen Anfärbbarkeit mit einer GRAM Färbetechnik in GRAM positive und GRAM negative Keime, aufgrund ihres phänotypischen Erscheinungsbildes in u. a. Stäbchen und Kokken unterteilt werden. Der in deutschen Kliniken wohl bekannteste MRE ist MRSA (Methicillin resistenter Staphylokokkus aureus), eine GRAM positive Kokke. MRSA ist heute in nahezu allen medizinischen Einrichtungen weltweit zu finden. Da dieser Keim auch gegen alle anderen ß-Lactam-Antibiotika resistent ist, wird er häufig auch multiresistenter St. aureus genannt. Eine andere Bezeichnung ist ORSA (Oxacillin resistenter St. aureus). Innerhalb Europas ist für diesen Keim ein starkes Prävalenzquotengefälle von Süd nach Nord festzustellen, Daten hierzu erhält das ECDC (European Centre for Disease Prevention and Control) kontinuierlich von europäischen Laboren im Rahmen des EARS-Netzwerkes (European Antimicrobial Resistance Surveillance Network). So liegt der Anteil an MRSA von allen gefundenen St. aureus in skandinavischen Ländern unter 1 %, in südlichen Ländern wie beispielsweise Griechenland oder Italien bei 40 – 50 % und höher. Deutschland bewegt sich derzeit bei ca. 22 %. Gründe für die geringe Quote in Skandinavien sind unter anderem in stark reglementierten Antibiotikaverordnungen, personell und materiell hoch ausgebautem Hygienemanagement und einer konsequent durchgeführten „search and destroy“-Strategie zu finden, bei der von jedem stationär aufgenommenen Patienten nach Zuordnung zu einer entsprechenden Risikogruppe noch am Aufnahmetag Nasen-, Rachen- und Leistenraumabstriche genommen werden. Bis zum Vorliegen des Ergebnisses bleiben die Patienten in Einzelzimmern isoliert und werden so behandelt, als seien sie bereits positiv getestet. Erkannte MRSA kolonisierte Patienten bleiben bis zum erfolgreichen Abschluss einer Sanierung weiter in Isolation, für negativ getestete Patienten wird die Isolierung aufgehoben. Auf diese Weise wird eine potentielle MRSA Übertragung im Krankenhaus bereits im Vorfeld erstickt. In Deutschland sind die Krankenhäuser durch das IfSG (Infektionsschutzgesetz) angewiesen, den fachlichen Empfehlungen des RKI (Robert Koch-Institut) zum screening von MRSA Risikopatienten zu folgen und bei diesen einen Nasen- und Rachenabstrich durchzuführen, ähnlich der in Skandinavien durchgeführten Strategie. Der wesentliche Unterschied besteht jedoch in der fehlenden vorsorglichen Isolierung der Patienten. Diese geschieht erst nach Vorliegen eines positiven Befundes. In der Zwischenzeit kann eine Übertragung auf andere Patienten oder Personal bereits stattgefunden haben. Dieses Intervall kann durch eine Probennahme direkt bei Aufnahme und Anwenden der PCR Technologie auf wenige Stunden verkürzt werden, bei einem falsch positiven Ergebnis kann nach Vorliegen des kulturellen Befundes (ca. 3 Tage) eine Isolierung wieder aufgehoben werden. Zu einer, wie in den Niederlanden praktizierten, präventiven räumlichen Abtrennung aller ins Krankenhaus gelangender MRSA Risikopatienten existieren in Deutschland viel zu wenig Patientenzimmer, ein infrastruktureller Mangel mit entscheidenden Folgen. Die Notwendigkeit eines Aufnahmescreenings lässt sich mit Daten des Nationalen Referenzzentrums aus dem Jahr 2010 belegen: Demnach traten an 268 am MRSA-KISS teilnehmenden Krankenhäusern ca. 41.000 MRSA Fälle auf, von denen nur 16 % nosokomial bedingt waren. 84 % der MRSA kamen mit den Patienten ins Krankenhaus. Bei den hiervon geplant in die Klinik aufgenommenen Patienten kann die Detektion auf MRE bei einer vorstationären Behandlung durchgeführt werden, MRSA positive Patienten können außerklinisch saniert und das Risiko eines Keimeintrages ins Klinikum verringert werden. Zumindest bei einer Sanierung zugänglichen Keimen (MRSA) wäre hiermit eine enorme Reduzierung der Keimlast zu erreichen. Nun muss jedoch angemerkt werden, dass mit der strikten Beachtung von Standardhygienemaßnahmen bei der Behandlung jedes Patienten eine Isolierung zur Vermeidung einer Keimübertragung durch Krankenhauspersonal eigentlich nicht notwendig wäre. Lediglich für wenige, aerogen oder durch Tröpfchen übertragbare Keime (A-Streptokokken-Pharyngitis, Influenza, Mumps, offene Tbc d. Atemwege u. a.), ist die Isolierung in einem Zimmer mit Unterdruck eine sinnvolle Maßnahme. Die bedauerliche Tatsache, dass nach wie vor, trotz intensivster Schulungen und Fortbildungen von in erster Linie Ärzten, in geringerem Maße auch von Pflegepersonal eine Verinnerlichung der notwendigen Hygienemaßnahmen, beispielsweise der Händedesinfektion, nicht stattgefunden hat, macht die Isolierung von MRE belasteten Patienten leider unumgänglich. Die Fakten sprechen für sich: In einer 2002 publizierten deutschen Studie wurde gezeigt, dass beispielsweise nur bei 55,2 % der Tätigkeiten, in denen eine hygienische Händedesinfektion erwartet wird, auch entsprechend reagiert wird. In Tab. 1 wird ein entsprechend schlechtes Hygieneverhalten mit erschreckenden Daten belegt. Sie zeigt den prozentualen Anteil von Intensivstationspersonal, das sich die Hände vor und nach der jeweiligen händedesinfektionspflichtigen Tätigkeit desinfiziert hat. Und die Akteure waren sich der Beobachtung bewusst!
Der Anteil von 60 % Händedesinfektion vor Arbeit an einem zentralen Venenkatheder ist besonders verantwortungslos! Hier bewirkt auch die Isolierung von MRE Patienten nichts. Die aufwendige Prozedur des Anlegens der Schutzkleidung vor Betreten des Isolierzimmers kann die Akteure zumindest an die minimalsten Hygienebasics erinnern.
Der hohe Stellenwert, der der Hygiene in skandinavischen Ländern eingeräumt wird, zeigt sich auch in der personellen Ausstattung mit Hygienefachpersonal. So beschäftigt in den Niederlanden jedes einzelne Krankenhaus einen hauptamtlichen Arzt für Mikrobiologie und Krankenhaushygiene, der täglich Visiten durchführt und auch über Antibiotikaverordnungen entscheidet. In Deutschland wird dagegen nur jedes 20. Krankenhaus von einem vollzeitbeschäftigten Facharzt für Hygiene und Umweltmedizin betreut.
Die o. a. „search and destroy policy“ verhindert wirkungsvoll eine MRSA Übertragung innerhalb des Krankenhauses, der niedrigen Prävalenzquote allgemein ist jedoch die Tatsache geschuldet, dass in Skandinavien seit Jahrzehnten eine äußerst restriktive Antibiotika Verordnungspraxis durchgeführt wird. Durch eine wo immer möglich unterlassene Antibiotikaverabreichung und, wenn notwendig, ausgewählte, exakt am nachgewiesenen oder zu erwartendem Keim orientierte Antibiotikagabe nach mikrobiologischer und hygienischer Empfehlung wird der Selektionsdruck auf die Keime erniedrigt, in Folge verringert sich die Anzahl neu entstehender Resistenzen.
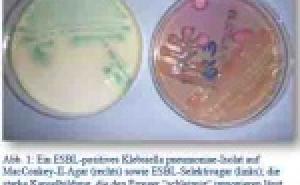
Innerhalb der MRE gewinnen neben den oben dargestellten MRSA und dessen Präventions- und Bewältigungsstrategien gramnegative Keime eine immer größere Bedeutung. Betroffen sind vorwiegend die Spezies Acinetobacter baumanii, Enterobacteriaceae wie Enterobacter cloacae, Escherichia coli, Klebsiella ssp. u.a. und sogenannte Nonfermenter wie Pseudomonas und Stenotrophomonas. Problematisch ist die Sanierung von mit Enterobacteriaceae kolonisierten Patienten, da die Keime als normale Darmbewohner einer vollständigen Eliminierung nicht zugänglich sind. Hier ist zur Vermeidung von Übertragungen peinlichste Hygiene gefordert. Bei der Einteilung solcher multiresistenter gramnegativen Erreger (MRGN) bedient man sich international der in Tab. 2 dargestellten Klassifikation, in der auch natürliche Resistenzen aufgeführt sind. Sie wurde auch bei den gefundenen Keimen der libyschen Patienten angewandt.
An dieser Stelle soll auf die verschiedenen Resistenzmechanismen und Antibiotikainaktivierungen durch bakterielle Enzyme wie beispielsweise Betalaktamasen nicht näher eingegangen werden.
Klassifizierung MRGN (Epidemiologisches Bulletin 36/2011)
In der letzten Änderung des Infektionsschutzgesetzes § 23 (August 2011) wird der großen nosokomialen Bedrohung nun in mehreren Bereichen die notwendige Aufmerksamkeit gezollt: Beim Robert Koch-Institut wird eine Kommission Antiinfektiva, Resistenz und Therapie (ART) eingerichtet. Die Kommission erstellt Empfehlungen mit allgemeinen Grundsätzen für Diagnostik und antimikrobielle Therapie, insbesondere bei Infektionen mit resistenten Krankheitserregern. Die Empfehlungen der Kommission werden unter Berücksichtigung aktueller infektionsepidemiologischer Auswertungen stetig weiterentwickelt und vom Robert Koch-Institut veröffentlicht. Weiterhin wurde festgelegt, dass die Leiter von Krankenhäusern, Einrichtungen für ambulantes Operieren, Arztpraxen u. a. sicherzustellen haben, dass die nach dem Stand der medizinischen Wissenschaft erforderlichen Maßnahmen getroffen werden, um nosokomiale Infektionen zu verhüten und die Weiterverbreitung von Krankheitserregern, insbesondere solcher mit Resistenzen, zu vermeiden. Die Einhaltung des Standes der medizinischen Wissenschaft auf diesem Gebiet wird vermutet, wenn jeweils die veröffentlichten Empfehlungen der Kommission für Krankenhaushygiene und Infektionsprävention und der ART beim Robert Koch-Institut beachtet worden sind. Zusätzlich haben die Leiter von Krankenhäusern und von Einrichtungen für ambulantes Operieren sicherzustellen, dass die vom Robert Koch-Institut festgelegten nosokomialen Infektionen und das Auftreten von Krankheitserregern mit speziellen Resistenzen und Multiresistenzen fortlaufend in einer gesonderten Niederschrift aufgezeichnet, bewertet und sachgerechte Schlussfolgerungen hinsichtlich erforderlicher Präventionsmaßnahmen gezogen werden und dass die erforderlichen Präventionsmaßnahmen dem Personal mitgeteilt und umgesetzt werden. Darüber hinaus haben sie sicherzustellen, dass die festgelegten Daten zu Art und Umfang des Antibiotika-Verbrauchs fortlaufend in zusammengefasster Form aufgezeichnet, unter Berücksichtigung der lokalen Resistenzsituation bewertet und sachgerechte Schlussfolgerungen hinsichtlich des Einsatzes von Antibiotika gezogen werden und dass die erforderlichen Anpassungen des Antibiotikaeinsatzes dem Personal mitgeteilt und umgesetzt werden.
Im Geschäftsbereich des Bundesministeriums der Verteidigung obliegt der Vollzug dieses Gesetzes den zuständigen Stellen der Bundeswehr (§ 70 IfSG), z. Zt. noch durch die Kommandohygieniker repräsentiert. Sie sind gewissermaßen das Gesundheitsamt der Bundeswehr.
In der neuen Struktur wird diese Tätigkeit durch vier Überwachungsstellen für öffentlich-rechtliche Aufgaben des Sanitätsdienstes der Bundeswehr (ÜbwStÖRAufgSanDstBw Nord, Ost, Süd und West) wahrgenommen. Fachlich werden sie durch den ltd. Amtsarzt der Bundeswehr im Kommando Sanitätsdienst UAbt VI PrävMed/VorbeugGesSch geführt. Die Rechtsaufsicht findet sich beim Sanitätsdienst im BMVg bei FÜ SK II 7.
Mit dem Wissen um die drohende Gefahr einer Keimeinschleppung in BwKrhs und unter Beachtung der gesetzlichen Vorgaben und fachlichen Empfehlungen zur Vermeidung von nosokomialen Infektionen bereiteten sich im Oktober 2011 alle fünf Bundeswehrkrankenhäuser auf die Ankunft von 38 libyschen und tunesischen Patienten vor. Verletzungsmuster waren schwere Schuss- und Sprengverletzungen, Amputationen, Weichteilverletzungen, Augenverletzungen u. ä. Über einen vermuteten mikrobiellen Besiedelungszustand der Wunden war zunächst nichts bekannt. Auf Grund fehlender Surveillance und schwacher wissenschaftlicher Datenlage in den Heimatländern wurden Erfahrungen aus unseren Einsatzlazaretten (EinsLaz) und Rettungszentren (Rz) in Afghanistan sowie amerikanische Daten aus dem Irak den Bewältigungsstrategien zugrundegelegt. In einer prospektiven Studie aus einem saudi-arabischen Militärkrankenhaus (2004) wurde über eine über 48 %-ige nosokomiale Infektionsrate berichtet. Aus Libyen und Tunesien waren keine Daten eruierbar. Exemplarisch für alle Bundeswehrkrankenhäuser wird im nachfolgenden Artikel das Vorgehen im Bundeswehrkrankenhaus Hamburg und die aus der Versorgung gewonnenen Erkenntnisse einer Empfehlung künftigen Handelns dargestellt.
Datum: 26.03.2013
Quelle: Wehrmedizin und Wehrpharmazie 2013/1