„Gute“ Viren für zukünftige Pandemien
100 Jahre Erfahrung mit Bakteriophagen
C. Willy, J. Bugert
Antibiotikaresistenzen sind eine der größten Bedrohungen für die menschliche Gesundheit und die sichere Produktion von Lebensmitteln. Schätzungen zufolge werden bis 2050 durch die als „chronische Pandemie“ anzusehenden Infektionen mit multiresistenten (AMR) Erregern mehr als 10 Millionen Menschen pro Jahr (mehr als durch maligne Erkrankungen) sterben, wenn keine Gegenmaßnahmen ergriffen werden können. Im Jahr 2016 erkannten die Vereinten Nationen an, dass die aktuelle Krise der antimikrobiellen Resistenz vor allem auf den unsachgemäßen Einsatz antimikrobieller Medikamente im öffentlichen Gesundheitswesen, im Tier-, Lebensmittel-, Landwirtschafts- und Aquakultursektor, den mangelnden Zugang zu Gesundheitsdiensten und das Vorhandensein von antimikrobiellen Rückständen in Boden, Nutzpflanzen und Wasser zurückzuführen ist.
Sie verpflichteten sich daraufhin, auf nationaler, regionaler und globaler Ebene zu arbeiten, um die Entwicklung neuer antimikrobieller Wirkstoffe und Therapien zu unterstützen. Im Jahr 2017 veröffentlichte die Weltgesundheitsorganisation eine Liste mit arzneimittelresistenten Bakterien, für die dringend neue Antibiotika benötigt werden. In der Folgezeit wurde für die hiervon relevantesten Bakterien das Akronym „ESKAPE“-Erreger geprägt (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa), um zu betonen, dass sie die Mehrzahl der Krankenhausinfektionen verursachen und häufig der Wirkung von antibakteriellen Medikamenten effektiv „entgehen“. Vor diesem Hintergrund fördert die WHO die Forschung und Entwicklung zu AMR. Obwohl sich einige neue Antibiotika in der Entwicklung befinden, wird deren Ergebnis dem aktuellen medizinischen Bedarf nicht gerecht. Daher konzentrieren sich Wissenschaftler und Kliniker mit großem Nachdruck auf eine weitere antimikrobielle Strategie – die Bakteriophagen-Therapie.
Bakteriophagen
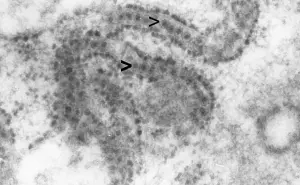
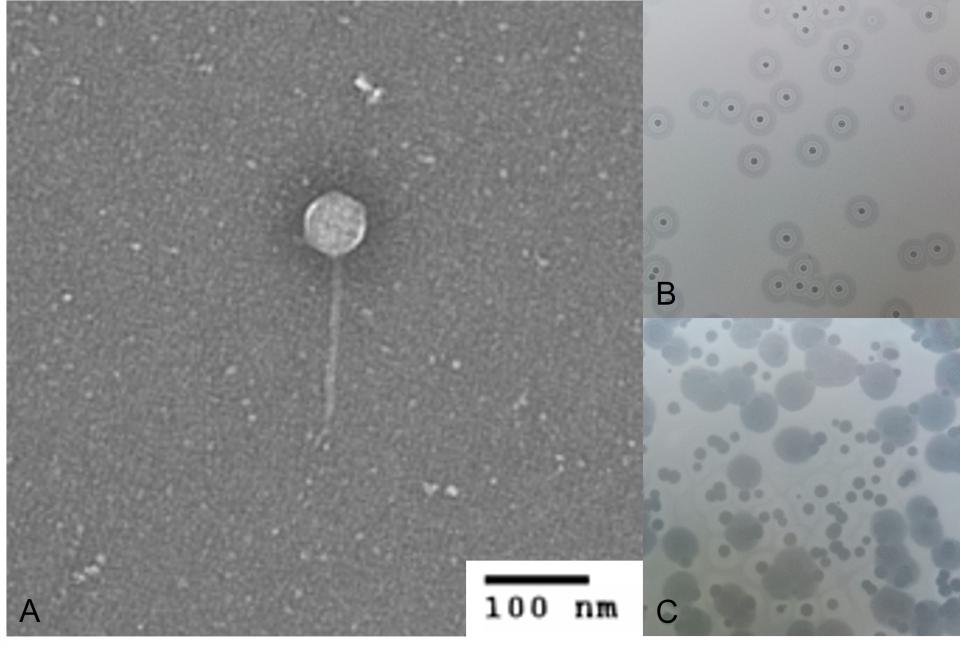
Bakteriophagen (Phagen) sind Viren von Bakterien, deren Entdeckung in den Jahren 1915 (durch den Engländer Frederick Twort) und 1917 (durch den Frankokanadier Félix Hubert d‘Hérelle) der Entdeckung von Antibiotika vorausging. Phagen wirken nur gegen Bakterien, und auch hier meist nur gegen eine einzelne Spezies. Die im Gegensatz zu Antibiotika fehlende Breitspektrumaktivität birgt den Vorteil, dass bei einer Therapie nur das „Target“-Bakterium getötet wird, alle anderen Bakterien jedoch überleben und somit keine Kollateralschäden an der Begleitflora (zum Beispiel Darm- und Hautmikrobiom) entstehen.
Bisherige Erfolge der Phagentherapie
Über erste Erfolge war bereits vor 100 Jahren berichtet worden. So behandelte d‘Hérelle erstmals erfolgreich mehrere Kinder, die an schwerer Ruhr litten, im Pariser Hôpital des Enfants Malades mit Phagen, die er am Pasteur-Institut zuvor aus dem Stuhl von Soldaten isoliert hatte. Der Nutzen von Phagen für die Behandlung bakterieller Infektionen wurde schnell erkannt und bereits in den 1920er und 1930er Jahren produzierten deutsche Firmen wie Behring und Eli Lilly in den USA Phagenpräparate gegen Streptokokken, Staphylokokken und Escherichia coli. Während des Zweiten Weltkriegs setzten sowohl die Wehrmacht als auch die alliierten Streitkräfte die Phagentherapie gegen die Ruhr ein. Verschiedene Faktoren, darunter die Einführung von Antibiotika in den 1940er Jahren, ein unsachgemäßer Phagen-Gebrauch, Unsicherheit über die Natur der Phagen und Probleme bei der Herstellung führten zu ihrem Niedergang im Westen.
Im geopolitischen Osten hingegen wurde weiterhin die Produktion, Forschung und im Vergleich zur Antibiotikatherapie die preiswertere Therapie von Phagen fortgeführt. Naturgemäß trugen nachfolgende wissenschaftliche Veröffentlichungen in anderen Sprachen als Englisch und das Klima des Kalten Krieges zur westlichen Skepsis und dem schwindenden Interesse an der Anwendung von Phagen zur Bekämpfung von Infektionen bei. Wenn auch bis in die 1980er Jahre hinein in Frankreich Phagenforschung und -anwendung fortgesetzt worden waren, führte erst die Suche nach Ausweitung antimikrobieller Strategien unter dem Druck der AMR zum neuen Interesse an der Phagentherapie. Aufwind erfahren heute diese Bemühungen durch im wahrsten Sinne des Wortes bahnbrechende Effekte der Phagentherapie in der Behandlung einzelner Patienten, die in wissenschaftlichen Zeitschriften sehr detailliert geschildert sind.
So wurde am Universitätsklinikum in San Diego ein Patient mit einer mit herkömmlichen Mitteln vollkommen austherapierten nekrotisierenden Pankreatitis, verursacht von einem multiresistenten acinetobacter baumannii-(ACB)-Stamm, erfolgreich mit einem Phagencocktail (9 Phagen) behandelt. In Großbritannien überlebte am Great Ormond Street Kinderkrankhenhaus in London ein fünfjähriger Mukoviszidosepatient eine schwere arzneimittelresistente Mycobacterium-Infektion der Lunge nach vollständiger Erregereradikation durch einen gentechnisch optimierten Mycobakterienphagencocktail. Neben diesen Berichten weisen mittlerweile auch immer mehr aktuelle klinische Belege und Übersichtsarbeiten auf die Effektivität der Bakteriophagentherapie bei einer Vielzahl von Infektionskrankheiten hin. Beispielsweise zeigen die beiden jüngsten Übersichtsarbeiten aus dem Jahre 2020, die auf 43 ausgewerteten Artikeln basieren, anhand der Behandlung von insgesamt 1 432 Patienten, dass durch den Einsatz von Bakteriophagen in 80,8 % eine klinische Heilung erreicht werden konnte und in 10,7 % eine Besserung sowie in 8,5 % keine Besserung eintrat. So wird zunehmend offensichtlich, dass die Bakteriophagentherapie in zahlreichen klinischen Situationen das Potenzial hat, einen ernsthaften Beitrag zur globalen AMR-Krise zu leisten.
Europaweit ist derzeit das belgische Queen-Astrid Militärkrankenhaus in Brüssel das führende Phagentherapiezentrum.

Herausforderungen
Für eine in der Klinik etablierte Phagentherapie stellt die hohe Wirtsspezifität die behandelnde Einrichtung vor Herausforderungen. Sie verlangt nämlich, dass gegen jede relevante Erregerspezies Phagen isoliert und in ausreichender Menge produziert werden. Zudem reicht es nicht aus, nur einen Phagen pro Bakterienspezies isoliert zu haben. Vielmehr benötigt man für eine wirksame Therapie eine Kombination aus mehreren Phagen (Phagencocktail). Die Wirksamkeit und Stabilität der Kombination gegen das individuelle Patientenisolat muss vor Verabreichung mithilfe eines Phagogramms sichergestellt werden.
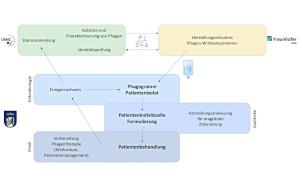
Für eine in der Zukunft erfolgreiche Phagentherapie wird der Aufbau großer Phagenbanken benötigt, in der eine möglichst große Menge an Phagen für viele der kritischen Erreger gelagert sind sowie eine stete Aktualisierung dieser Bank, um den über die Zeit hinweg auftretenden genetischen Veränderungen der bakteriellen Krankheitserreger entgegenwirken zu können. Nach Infektdiagnose und Isolierung des Problemerregers ist es für eine personalisierte Therapie erforderlich, zeitnah die für diesen Erreger wirksame Phagenkombination zu identifizieren und sie auf Rezeptierung durch den behandelnden Arzt in ausreichender Menge unter Reinraumbedingungen in der Krankenhausapotheke aus vorhandenen Phagenstöcken anzusetzen.
Dieser Weg der sogenannten magistralen Herstellung soll in dem vom Innovationsfond des Gemeinsamen Bundesausschusses geförderten Forschungsprojekt „PhagoFlow“ (www.phagoflow.de, Konsortionalführung Unfallchirurgie Bundeswehrkrankenhaus Berlin, geplanter Behandlungsbeginn August 2021) auf seine Praktikabilität hin untersucht werden. Bis zur Etablierung dieses Herstellungswegs zur Verwendung in zukünftigen Phagenambulanzen muss heute übergangsweise noch auf käufliche Phagencocktails aus Ländern wie beispielsweise Georgien, Ukraine und Russland zurückgegriffen werden. Nachteil dieser herstellerseitig fertig gemischten Präparate, die in Deutschland als nicht zugelassene Arzneimittel nur im Rahmen des individuellen Heilversuchs eingesetzt werden können, ist, dass die Lyseaktivität der enthaltenden Phagen möglicherweise nicht optimal ist und hohe Endotoxinkonzentrationen vorliegen können. Eine vielversprechende neue Herstellungsweise von Phagen, an der auch das Institut für Mikrobiologie der Bundeswehr in München beteiligt ist, ist die in vitro-Herstellung von Phagen in sterilen Enzym-Substratgemischen, wodurch die Kontaminationsproblematik bei der klassischen Herstellung in AMR Erregerisolaten vermieden wird.
Bakteriophagen in einem Konzept der „Guten Viren“
Dennoch werden nicht nur die fehlende arzneimittelrechtliche Zulassung, das Fehlen weiterer Studien sondern auch die jahrzehntelange Unvertrautheit mit Phagen als antibakterieller Wirkstoff zunächst noch eine Barriere für die Anerkennung der Phagentherapie sein. Hinzu kommt, dass der therapeutische Einsatz von Phagen als „Viren“ – gerade in Pandemiezeiten – emotional stark negativ besetzt sein kann, als wären sie in gewisser Weise gleichwertig mit viralen Erregern, die menschliche Krankheiten verursachen. Tatsächlich wäre es erforderlich, auf die Sprachidee und das Wirkkonzept der „guten Bakterien“ zurückzugreifen, die so überzeugend in Bezug zum Beispiel auf Joghurt oder für die gesunde Haut-, Darm- oder Vaginalflora akzeptiert sind, um so durch Aufklärung auch die Phagentherapie mit der Vorstellung von „guten Viren“ zu verbinden. Dies kann vielleicht dadurch gelingen, in dem wir uns bewusst machen, dass unser Organismus ein untereinander verwobenes Netzwerk aus 30 Billionen menschlichen Zellen, 40 Billionen Bakterien und 300 Billionen Bakteriophagen ist (siehe auch INFOBOX). Letztlich sind wir das Ergebnis eines gigantischen fortwährenden Informationsaustausches - der im Idealfall zu einem gesunden „ICH“ führt.
Ohne die Zusammenarbeit zwischen dem BwKrhs Berlin und dem InstMikrobioBw (https://orcid.org/0000-0002-0556-3211) wäre sowohl der vorliegende Beitrag als auch die aktuelle Entwicklung hin zur klinischen Phagentherapie nicht möglich gewesen.
Wehrmedizin und Wehrpharmazie 2/2021
Für die Verfasser:
Oberstarzt Prof. Dr. C. Willy
Bundeswehrkrankenhaus Berlin
Scharnhorststraße 13, 10115 Berlin
E-Mail: [email protected]