DENGUE-VIRUS-INFEKTION – EINE GLOBALE HERAUSFORDERUNG
Das klassische Dengue-Fieber (DF) sowie die lebensbedrohlichen Verlaufsformen des schweren Dengue-Syndroms, auch als Hämorrhagisches Dengue-Fieber (DHF) und Dengue-Schock-Syndrom (DSS) bezeichnet, sind klinische Manifestationen einer durch Arthropoden übertragenen Infektion, die wahrscheinlich schon seit Jahrhunderten in tropischen und subtropischen Regionen heimisch ist, in den vergangenen 50 Jahren aber dramatisch an Bedeutung gewonnen hat und zunehmend in Gebiete vordringt, die bisher von der Infektionskrankheit verschont waren.
Nach Angaben der Weltgesundheitsorganisation WHO sind etwa zwei Fünftel der Weltbevölkerung vom Dengue-Fieber bedroht.
Hervorgerufen wird die Infektion durch die vier Serotypen DENV-1 bis DENV-4 des Dengue-Virus-Komplexes. Dengue-Viren sind RNA-Viren und gehören zur Familie Flaviviridae. Mit den anderen Vertretern dieser Familie - dazu zählen Gelbfieber-, Japanische Encephalitis-, West-Nil- und Tick Borne-Encephalitis-Virus – teilen sie einige strukturelle Gemeinsamkeiten. Zwischen den Flaviviren bestehen Antigengemeinschaften, die serologische Kreuzreaktionen hervorrufen.
Der Mensch ist das weitaus wichtigste, wenn auch nicht das einzige Reservoir für das Virus. Wesentlicher Infektionsweg ist die Übertragung von Mensch zu Mensch durch den Stich weiblicher Mücken der Gattung Stegomyia (ehemals Aedes). Effizientester Überträger ist die Gelbfiebermücke St. aegpti, in geringerem Maße auch die Asiatische Tigermücke St. albopicta sowie einige andere Arten. Die Vektoren leben zumeist in unmittelbarer Nähe des Menschen im Sinne einer peridomestischen Synanthropie. Die Mücken sind tagaktiv, stechen bevorzugt in den frühen Morgenstunden und am Spätnachmittag, und gelten als „nervous feeders“, die bereits bei kleinsten Bewegungen des Wirtes den Saugakt unterbrechen und danach auf anderen Wirten ihre Blutmahlzeit fortsetzen. Die Tatsache, dass Eiablage und Larvenreifung dieser Insekten in kleinsten Wasseransammlungen wie etwa in Straßenpfützen, Autoreifen, weggeworfenen Getränkedosen und Plastiktüten erfolgen, ist eine wesentliche Erklärung für das gehäufte Auftreten von Dengue-Ausbrüchen in zahlreichen urbanen Ballungsgebieten der Tropen und Subtropen. Dort, wo in geeigneten Klimazonen Vektorverbreitung, Virusendemizität und problematische hygienische Verhältnisse aufeinander treffen, ist die Gefahr von Dengue-Ausbrüchen besonders hoch.
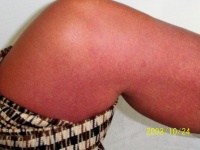
Abb. 1: Dengue-Exanthem. (Mit freundlicher GEnehmigung von Oberfeldarzt Dr. Hinrich Sudeck.)
Zeitgenössische Berichte aus früheren Jahrhunderten deuten darauf hin, dass das Dengue-Fieber bereits vor langer Zeit in China, Nordamerika und Ägypten präsent gewesen sein könnte. Heute konzentriert sich die Verbreitung der Dengue-Virus-Infektionen im Wesentlichen auf die tropischen und subtropischen Regionen Afrikas, Asiens, Amerikas, Australiens, Ozeaniens und der Karibik zwischen dem 35. nördlichen und 35. südlichen Breitengrad.
Während in der Zeit vor dem 2. Weltkrieg in den Dengue-Endemiegebieten jeweils einer der vier Virus-Serotypen übertragen wurde, kommt es seit wenigen Dekaden – vor allem bedingt durch den internationalen Fernreiseverkehr – in verschiedenen Regionen der Welt zunehmend zu einer Kozirkulation, also zum gleichzeitigen Auftreten mehrerer Serotypen. Dieses Phänomen scheint für die dramatischen Ausbrüche in südamerikanischen und südostasiatischen Großstädten bedeutsam zu sein. Besorgnis erregend ist, dass, beginnend mit der DHF-Epidemie in Manila 1953/54, auch die lebensbedrohlichen Verlaufsformen des Dengue-Fiebers immer häufiger epidemisch auftreten. Die Ausbreitung der Dengue-Virus-Infektionen in den letzten 50 bis 60 Jahren ist offenbar ein Begleitphänomen bestimmter sozioökonomischer Entwicklungen. Die unkontrollierte Urbanisation als Folge eines ungebremsten Bevölkerungswachstums mit den konsekutiven Problemen beim Frisch- und Abwassermanagement sowie bei der Abfallentsorgung schaffen in den betroffenen subtropischen oder tropischen Gebieten ideale Bruthabitate für die Überträger-Mücken.
Die Pathogenese der Dengue-Virusinfektion ist ein komplexer Prozess, der sowohl den humoralen wie auch den zellulären Bereich des Immunsystems betrifft. Zielzellen der Viren sind in erster Linie mononukleäre Abwehrzellen wie epidermale Dendritische Zellen, Keratinozyten, Monozyten und Makrophagen, in denen sich das Virus vermehren kann und durch die es im Wirtsorganismus verbreitet wird.
In die Krankheitsentstehung des schweren Dengue-Syndroms, also des hämorrhagischen Dengue-Fiebers (DHF) und des Dengue-Schocksyndroms (DSS), sind neben dem Immunsystem besonders Leber und Gefäßendothel beteiligt. Vor allem sind aber auch das Komplementsystem und zahlreiche Zytokine involviert, die über eine massive Freisetzung löslicher Faktoren Störungen der Blutgerinnung und der Endothelfunktion verursachen. Kennzeichen des schweren Dengue-Syndroms sind daher Thrombozytopenie, Gerinnungsstörungen und ein massiver Plasmaaustritt in den Extravasalraum. Die Funktionsstörung des Endothels beruht nicht auf einer dauerhaften strukturellen Schädigung, sondern ist Ausdruck einer kurzdauernden Zytokinwirkung, die bei rechtzeitiger Einleitung geeigneter therapeutischer Maßnahmen folgenlos überstanden werden kann. Welche Faktoren für einen lebensbedrohlichen Krankheitsverlauf prädestinieren, ist seit vielen Jahren Gegenstand intensiver Forschung. Eigenschaften des Wirtes (Lebensalter, genetische Faktoren, wie z. B. TNF-a-Polymorphismen oder Glucose-6-Phosphat-Dehydrogenase-Mangel) wie auch Virulenzfaktoren des Erregers (z. B. höhere Replikationsrate einzelner Virus-Genotypen) scheinen eine Rolle zu spielen.
Im Mittelpunkt des wissenschaftlichen Interesses steht seit mittlerweile über 40 Jahren das von S.B. Halstead 1970 beschriebene Phänomen des „antibody-dependent enhancement“ (ADE). Danach stellt der Zweitkontakt mit einem anderen Virus-Serotyp als dem, der die Primärinfektion hervorgerufen hat, einen Risikofaktor für das Auftreten eines schweren Dengue-Syndroms dar, da die kreuzprotektive Wirkung der heterotypischen Antikörper offenbar nur von kurzer Dauer ist. Sie verstärken im Gegenteil sogar Virusaufnahme und -replikation in Immunzellen und können über eine überschießende Zytokinproduktion ein Schocksyndrom auslösen. Die ADE-Hypothese ist nicht unumstritten, da schwere Krankheitsverläufe auch bei Primärinfektionen beobachtet werden. Allerdings bietet sie ein viel beachtetes Erklärungsmodell für die Zunahme von DHF-Ausbrüchen in solchen Regionen, in denen nach Einwanderung neuer Virus-Serotypen mehrere Serotypen kozirkulieren.
Die Klinik der Dengue-Virus-Infektionen ist vielgestaltig. Meist verlaufen die Infektionen klinisch inapparent oder oligosymptomatisch im Sinne einer unspezifischen grippalen Reaktion. Nur etwa 10 bis 20 Prozent der Erkrankten zeigen das Bild des klassischen Dengue-Fiebers, etwa 2 bis 5 % entwickeln ein schweres Dengue-Syndrom.
Die Inkubationszeit des Dengue-Fiebers beträgt zwei bis sieben, längstens 14 Tage. Das klassische Dengue-Fieber ist gekennzeichnet durch die Trias Fieber, Schmerzen und Exanthem. Das Fieber tritt abrupt auf, erreicht rasch Werte zwischen 39 und 41 °C und hält in der Regel vier bis sieben Tage an. Muskel- und Knochenschmerzen sind mitunter so ausgeprägt, dass der Erkrankte eine schmerzbedingte Schonhaltung einnimmt („break-bone fever“). Häufig wird über heftige retrobulbäre Kopfschmerzen berichtet. Ein makulopapulöses Exanthem erscheint zwischen dem zweiten und sechsten Krankheitstag und persistiert für zwei bis drei Tage. Es beginnt am Stamm und setzt sich Richtung Extremitäten und Kopf fort. Haemorrhagische Symptome (Petechien, Zahnfleischbluten, Epistaxis, Menorrhagien) sind nicht selten. Nach einer Krankheitsdauer von drei bis sieben Tagen verschwinden die Symptome von selbst. Die Rekonvaleszenz verläuft häufig protrahiert.
Das klinische Erscheinungsbild des schweren Dengue-Syndroms unterscheidet sich zunächst nicht von der des Dengue-Fiebers oder anderer fieberhafter Erkrankungen. Als kritische Phase gilt der Fieberabfall zwischen dem zweiten und siebten Erkrankungstag. Hier können die von der WHO 2009 als „Warnzeichen“ definierten Symptome Abdominalschmerz, persistierendes Erbrechen, Hepatomegalie, Schleimhautblutungen, Hämatokritanstieg und Thrombozytenabfall auf die bevorstehende Komplikation hindeuten. Gekennzeichnet ist das schwere Dengue-Syndrom durch einen Abfall der Thrombozytenzahl auf unter 100.000/µl, Gerinnungsstörungen und einen massiven Plasmaaustritt aus den Blutgefäßen, vor allem in Pleura- und Bauchraum. Das intravasale Plasmavolumen ist dabei um bis zu 20 % vermindert. Die Letalität der Erkrankung ist sehr variabel und beträgt in Abhängigkeit von der epidemiologischen Situation bis zu 15 %; sie kann durch eine frühzeitige und adäquate Behandlung auf unter 1 % gesenkt werden (Abb. 1).
Für einen spezifischen Infektionsnachweis werden als direkte Nachweisverfahren Virusisolierung und -anzüchtung angewendet, die allerdings wegen ihres methodischen Aufwandes Speziallaboratorien vorbehalten bleiben. Ähnliches gilt für die molekularbiologische Detektion, die – wie auch die Virusanzucht - vor allem in der Frühphase einer Infektion, d.h. während der ersten fünf bis sieben Tage nach Auftreten der klinischen Symptome, erfolgversprechend ist. Nukleinsäure-Amplifikationsverfahren ermöglichen nicht nur den Erregernachweis, sondern auch eine nähere Charakterisierung des Virus (Serotyp, Subtyp, geographische Zuordnung). Schließlich stehen für die akute Infektionsphase auch Antigen-Assays im ELISA-Format und sowie immunchromatographische Schnelltests zum Nachweis des viralen Nicht-Struktur-Proteins 1 zur Verfügung.
Die Antikörperantwort auf eine Dengue-Virus-Infektion kann mit verschiedenen Verfahren nachgewiesen werden, wobei sich vor allem ELISA-Teste und Immunfluoreszenz-Assays durchgesetzt haben. Mögliche Kreuzreaktivitäten mit anderen Flaviviren sind bei der Bewertung der Testergebnisse zu beachten. Im Gegensatz dazu gelten Antikörper-Neutralisationstests als sehr sensitiv und spezifisch. Sie sind jedoch aufwändig und bleiben Speziallaboratorien vorbehalten. Für die Diagnose einer akuten Infektion sind diese Tests nur eingeschränkt geeignet.
Obwohl antivirale Substanzen Gegenstand intensiver Forschungsvorhaben sind, steht eine kausale antivirale Therapie gegenwärtig nicht zur Verfügung. Supportive Therapiemaßnahmen basieren auf einer klinischen und Hämatokrit-gestützten Risikobewertung des Erkrankten entsprechend den aktuellen „Dengue-Guidelines for Diagnosis, Treatment, Prevention, and Control“ der WHO (2009). Im Mittelpunkt steht der Ersatz von Flüssigkeit, Elektrolyten und Zucker, der so lange wie möglich oral erfolgen sollte. Schmerzzustände sollten mit Paracetamol behandelt werden, nicht mit Acetylsalisylsäure oder Ibuprofen. Bei schweren Blutungskomplikationen kommen auch Erythrozyten- oder Thrombozyten-Transfusionen zum Einsatz. Weitere intensivtherapeutische Maßnahmen können in Abhängigkeit vom Schweregrad der klinischen Symptomatik erforderlich werden.
Da gegenwärtig weder Impfstoffe noch antiviral wirksame Medikamente zur Verfügung stehen, sind die verschiedenen Möglichkeiten der Vektorkontrolle die wichtigsten Ansatzpunkte, das epidemische Auftreten des Dengue-Fiebers zu verhindern und zu bekämpfen. Im Rahmen der individuellen Expositionsprophylaxe wird vor allem die Anwendung von DEET und die Imprägnierung der Kleidung und von Moskitonetzen von der WHO empfohlen. Schließlich ist es vor allem in endemischen und hyperendemischen Gebieten erforderlich, funktionierende Surveillance-Systeme zu etablieren, um sowohl bei sporadischen Einzelfällen wie auch bei Ausbrüchen von Dengue-Virus-Infektionen schnell und umfassend reagieren zu können.
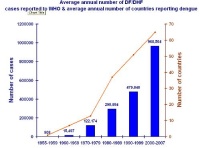
Abb. 2: Anzahl der durchschnittlichen gemeldeten Dengue-Fieber-/DHF-Fälle pro Jahr und Anzahl der meldenden Staaten. WHO 2008.
Obwohl mit der Entwicklung von Vakzinekandidaten bereits in den vierziger Jahren des 20. Jahrhunderts begonnen wurde, steht ein Impfstoff gegenwärtig noch nicht zur Verfügung. Allerdings zeigt der Verlauf einiger klinischer Studien mit verschiedenen Impfstoffen, dass mit der Markteinführung einer Vakzine in den nächsten Jahren zu rechnen ist. Alle Impfstoffe, die sich derzeit in klinischen Studien befinden, sind als tetravalente Substanzen konzipiert, um gegen die vier Dengue-Virus-Serotypen zu schützen. Wegen ihrer Immunogenität werden attenuierte Lebendvakzinen bevorzugt. Besonders vielversprechend verläuft die Erprobung von Chimärvakzinen. Hier werden in das Genom eines sogenannten „Back bone virus“ – Anwendung finden der Gelbfiebervirus-Impfstamm YFV 17 D und der Dengue-Virus-Serotyp DENV-2 PDK 53 – die Gene für verschiedene Strukturproteine aus der Hülle aller DENV-Serotypen implantiert. Am weitesten fortgeschritten ist die Erprobung des Chimärimpfstoffs ChimeriVax® der Firma Sanofi Pasteur, der in mehreren Phase III-Studien in Australien, Asien und Lateinamerika getestet wurde und eine protektive Wirksamkeit nach Impfung von 4 000 thailändischen Kindern gezeigt hat. Allerdings wurden die Erwartungen an den Impfstoff nicht in vollem Umfang erfüllt. Jüngsten Medienberichten (New York Times, 10.09.2012) zufolge ist die Schutzwirkung dieses Impfstoffs vor allem gegen DENV-2 unbefriedigend, so dass mit einer verzögerten Markteinführung zu rechnen ist. Eine andere Chimärvakzine, DENVax® der Firma Inviragen, befindet sich in der Phase II-Erprobung in Puerto Rico, Kolumbien, Singapur und Thailand. Ähnliches gilt für ein Kooperationsprodukt der US National Institutes of Health und des brasilianischen Instituto Butantan. Weitere Vakzinekandidaten – ein rekombinanter Subunit-Impfstoff von Merck und Hawaii Biotech, ein aufgereinigter inaktivierter Impfstoff von GlaxoSmithKline, der U.S. Army und des Oswaldo Cruz-Instituts in Rio de Janeiro sowie eine attenuierte Lebendvakzine des indischen Herstellers Panacea – befinden sich in der Phase I-Erprobung.
Angesichts der enormen Anstrengungen, die im Rahmen der Impfstoffentwicklung unternommen werden und der damit verbundenen Kosten – allein für den Aufbau einer speziellen Produktionsstätte in Frankreich wurden von SanofiPasteur mehr als 350 Millionen EURO investiert - ist die Frage angezeigt, ob der betriebene Aufwand überhaupt gerechtfertigt ist. Die epidemiologischen Daten der WHO sowie verschiedene Untersuchungen zu den wirtschaftlichen Auswirkungen der Dengue-Virus-Infektionen geben eine eindeutige Antwort:
Weltweit leben zwei bis drei Milliarden Menschen in Dengue-Endemiegebieten. Etwa 120 Millionen Reisende exponieren sich jährlich im Rahmen des internationalen Ferntourismus oder während beruflicher Aufenthalte gegenüber den Krankheitserregern. Von den etwa 50 bis 100 Millionen Infizierten pro Jahr entwickeln annähernd 36 Millionen eine klinische Symptomatik; 500 000 Hospitalisationen sind wegen schwerer Verlaufsformen erforderlich. In etwa 24 000 Fällen jährlich endet die Krankheit tödlich, wobei Kinder besonders häufig betroffen sind.
Die Dynamik, mit der sich die Dengue-Virus-Infektionen zu der bedeutendsten Arbovirose unserer Zeit entwickelt haben, ist beeindruckend. So betrug die Anzahl der gemeldeten Erkrankungsfälle 1979 weltweit etwa 110 000. Im Jahr 2002 hatte sich diese Zahl mit 1,3 Millionen etwa verzwölffacht. Dabei werden in besonderer Weise einige Gebiete Südostasiens und Süd- und Mittelamerikas vom Dengue-Fieber heimgesucht. Vietnam erlebte 1998 eine besonders schwere Epidemie mit mehr als 200.000 gemeldeten Erkrankungsfällen. Thailand war 2001 und 2002 von zwei großen Ausbrüchen in Folge betroffen mit jeweils mehr als 100 000 Fällen. Wie kein anderes Land wird aber Brasilien vom Dengue-Fieber heimgesucht: In dem südamerikanischen Staat erkrankten 1998 mehr als 500 000 Menschen an Dengue, 2002 sogar annähernd 800 000 (alle Daten: WHO DengueNet).
Auch hinsichtlich der geographischen Ausbreitung zeigt Dengue eine Besorgnis erregende Entwicklung. Während nach Angaben des tropenmedizinischen Netzwerks TropIKA.net 1973 nur 12 Staaten weltweit über Dengue-Fälle berichteten, waren es 2002 über 70 Staaten. Mittlerweile gelten mehr als 100 Staaten als Dengue-Risikogebiete. Dabei werden von der Infektionskrankheit Gebiete erreicht, die bisher frei von Dengue waren oder zwischenzeitlich als Dengue-frei galten, z. B. bestimmte Regionen Mittelamerikas.
Die ökonomische Bedeutung von Dengue ist erheblich. Ein epidemiologischer Indikator, der Krankheitsdauer, krankheitsbedingte Einschränkung der Lebensqualität und verlorene Lebensjahre durch krankheitsbedingten vorzeitigen Tod einschließt, ist das Behinderungsbereinigte Lebensjahr, DALY (disability-adjusted life year). Nach Schätzungen der WHO führt die Dengue-Last weltweit im Durchschnitt zu einem Verlust von 750.000 DALY pro Jahr. Die Kosten für die Behandlung eines Dengue-Patienten sind ebenfalls beeindruckend. Einer Modellrechnung von Shepard et al aus dem Jahr 2011 zu Folge betragen die Kosten für ambulant behandelten Dengue-Fälle in den Staaten des amerikanischen Kontinents im Durchschnitt 472 US-Dollar, für eine stationäre Behandlung sogar 1.227 US-Dollar (Shepard DS et al.: Am J Trop Med Hyg 84 (2), 2011). Insgesamt werden auf dem Kontinent jedes Jahr durchschnittlich 2,1 Milliarden US-Dollar für die Therapie von Dengue-Patienten eingesetzt. Angesichts dieser finanziellen Dimension ist erklärlich, dass zahlreiche Staaten in den epidemiologischen Brennpunktregionen mit großem Interesse die Impfstoffentwicklung beobachten und hoffen, in den Kreis der „First-to-introduce countries“ aufgenommen zu werden. Allerdings sind dazu nach den Beschlüssen des regionalen Dengue Prevention Boards der Dengue Vaccine Initative vom 17. Juli 2012 zahlreiche Voraussetzungen zu erfüllen, um nach der Lizensierung des Impfstoffs frühzeitig in den Genuss der Vakzinezuteilung zu kommen. Für die Impfstoffhersteller scheint das Engagement auf dem Dengue-Sektor ein lukratives Geschäft zu werden. Medienberichten zu Folge kann beispielsweise SanofiPasteur mit jährlichen Umsätzen von über 1 Milliarde US-Dollar rechnen (New York Times, 10.09.2012) (Abb. 2).
Ist das Dengue-Fieber für uns in Deutschland eine Bedrohung? In den vergangenen Jahren wurden dem Robert-Koch-Institut jährlich zwischen 260 und 300 Fälle von Dengue-Fieber gemeldet, 2010 sogar 594 Fälle. Es handelte sich dabei fast ausschließlich um importierte Infektionen, vor allem aus Thailand, Indien und Brasilien, also beliebten Urlaubszielen, die zu den Dengue-„Hot spots“ gehören. 2010 wurden allerdings die ersten beiden autochthonen DF-Fälle in Südfrankreich registriert. Zudem infizierte sich im selben Jahr ein deutscher Tourist in Kroatien. Schließlich verstarb kürzlich ein 84-jähriger Grieche in Patras an einer Dengue-Infektion, die er allem Anschein nach in seiner Heimatstadt am Ionischen Meer akquiriert hatte. Da sich im Zuge des Klimawandels die Asiatische Tigermücke Stegomyia albopicta, ein potenzieller Vektor, bereits in verschiedenen Regionen Süd- und Westeuropas festgesetzt hat, wird zukünftig auch in Deutschland mit autochthonen Dengue-Virus-Infektionen gerechnet werden müssen. Das Dengue-Fieber, einst eine lästige, aber vergleichsweise harmlose Erkrankung in den Tropen und Subtropen, hat sich, nicht zuletzt durch Faktoren, die der Mensch selbst verursacht hat, zu eine der größten infektiologischen Herausforderungen unserer Zeit entwickelt. Durch die Ausbreitung der Vektoren auch in gemäßigte Klimazonen und dem erkennbaren – derzeit noch sporadischen – Auftreten autochthoner Infektionen in diesen Gebieten handelt es sich nicht mehr um eine „Tropenkrankheit“, sondern um eine Infektion von globaler Bedeutung. Der Sanitätsdienst der Bundeswehr hält sowohl in den Einsatzlaboratorien wie auch in den mikrobiologischen Laboratorien im Inland diagnostische Möglichkeiten bereit, um eine Dengue-Virus-Infektion nachweisen zu können.
Datum: 18.01.2013
Quelle: Wehrmedizin und Wehrpharmazie 2012/4