Akutes Nierenversagen und Nierenersatztherapie
Carsten Veit, Maja F. Iversen (Bundeswehrkrankenhaus Hamburg, Klinik X – Anästhesie, Intensiv- und Notfallmedizin, Schmerztherapie)
Zusammenfassung
Das akute Nierenversagen gehört zu den häufigen Komplikationen bei Patienten in der Intensivtherapie und nach großen Operationen. Das zunehmend höhere Lebensalter der behandelten Patienten ist dabei ein beitragender Faktor.
Seine eigenständige prognostische Relevanz unterstreicht die Bedeutung einer frühen Erkennung des akuten Nierenversagens und die Berücksichtigung dieses bedrohlichen Zustandes auch bei der Wahl der zur Behandlung eingesetzten Arzneimittel im Hinblick auf deren Nierentoxizität.
In diesem Beitrag werden die grundlegenden Definitionen, diagnostischen und differenzialdiagnostischen Überlegungen sowie die Grundsätze der Prävention und Therapie des akuten Nierenversagens zusammengefasst vorgestellt. Ferner wird auf die Möglichkeiten der Nierenersatztherapie eingegangen.
Schlüsselwörter: Niere, akutes Nierenversagen, Glomeruläre Filtrationsrate, Nierentoxizitiät, Dialyse
Keywords: kidney, acute kidney injury, acute renal failure glomerular filtration rate, nephrotoxicity, dialysis
Einleitung
Das akute Nierenversagen „ANV“ (angelsächsisch acute kidney injury – AKI) umfasst unterschiedliche Syndrome, die mit einem plötzlichen, jedoch grundsätzlich reversiblen Ausfall der exkretorischen Nierenfunktion einhergehen. In der heutigen Intensivtherapie sind Patienten nach großen Operationen und mit Multiorganversagen die zahlenmäßig bedeutsamste Gruppe mit der Diagnose ANV. Etwa 25 % der Intensivpatienten und 50 % aller Patienten mit Sepsis entwickeln ein akutes Nierenversagen [16]. Die demografische Entwicklung und der Tatsache geschuldet, dass mit zunehmendem Lebensalter die Nierenfunktion und die glomeruläre Filtrationsrate (GFR) nachlassen, führen zu einer steigenden Inzidenz dieses Krankheitsbildes [28].
Das ANV besitzt eine eigenständige prognostische Relevanz. Aufgrund seiner schlechten Prognose besitzt die frühzeitige Erkennung eines sich entwickelnden ANV einen hohen Stellenwert. Leider führt die oftmals vergessene exponentielle Beziehung zwischen Serumkreatinin und GFR zu einer regelmäßigen Unterschätzung der Schwere der Nierenfunktionsstörung.
Früherkennung, geeignete Prävention und ohne Zeitverzug einsetzende Therapie sind deshalb unbedingt sicherzustellen.
Akutes Nierenversagen
Definition
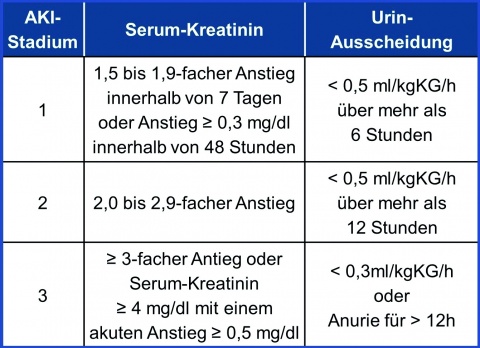
In der Literatur gab es lange Zeit unterschiedliche Definitionen des ANV, die sich alle am Kreatininwert im Blut und am Urinvolumen orientierten. Aktuell ist die Definition von der „KDIGO AKI Guideline Work Group“ international festgelegt und von der „Ad-hoc working group of European Renal Best Practice“ und der „europäischen nephrologischen Gesellschaft“ im Wesentlichen übernommen worden [15].Ein akutes Nierenversagen liegt vor bei
- Anstieg des Serumkreatinin um mehr als 0,3 mg/dl innerhalb von 48 h oder
- 1,5-fachem Anstieg des Serumkreatinin vom Ausgangswert innerhalb 7 Tagen oder
- Verminderung der Harnausscheidung auf 0,5 ml/kg/h über 6 h
Diese einheitliche Definition ermöglicht nunmehr eine bessere Erkennung des ANV im klinischen Alltag. Ebenso führt damit auch die Bewertung internationaler Studienergebnisse zu valideren Aussagen.
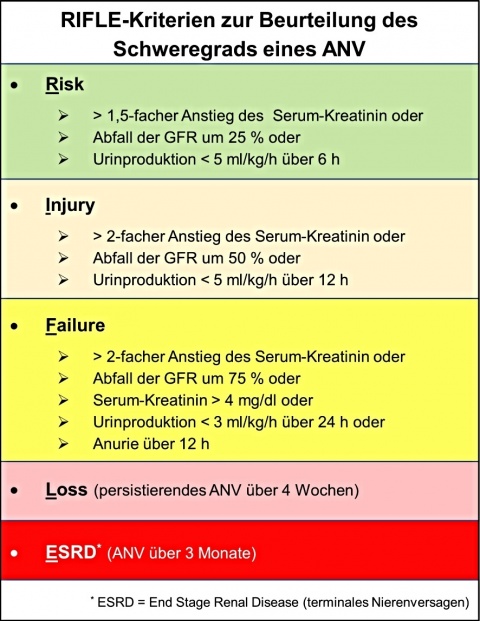
Um den Schweregrad des ANV besser beurteilen zu können, wurden die sog. RIFLE-Kriterien eingeführt und mehrfach validiert (Abbildung 1).
Risikofaktoren
Neben dem hohen als unabhängigem Risikofaktor für ein ANV kann das Ausmaß der Proteinurie zur Risikostratifizierung herangezogen werden. Eine Registerstudie von LEE et al. zeigte, dass Patienten mit niedriger GFR und relevanter Proteinurie das größte Risiko einer bleibenden dialysepflichtigen Niereninsuffizienz nach ANV hatten [18]. Eine kanadische Studie konnte ermitteln, dass bei Personen mit einer ermittelten GFR ≥ 60 ml/min/1,73m2 das Risiko für ein ANV viermal höher war, wenn eine höhergradige Proteinurie im Streifentest festgestellt wurde. Das ANV hatte in dieser Studie eine hohe Vorhersagekraft sowohl für das Überleben als auch für bleibende Nierenschädigungen [13].Eine weitere epidemiologische Studie untersuchte zwischen 2000–2009 die Inzidenz des dialysepflichtigen ANV. Die Arbeit zeigte einen Anstieg von etwa 10 % pro Jahr, dabei waren Alter und männliches Geschlecht die wichtigsten prädisponierenden Faktoren [12].
Eigenständige prognostische Relevanz des ANV
Das ANV ist nicht als eine weitere Komplikation zu betrachten, sondern besitzt eigenständige prognostische Relevanz. Patienten mit ANV sterben doppelt so häufig wie vergleichbar Kranke ohne ANV [16]. Es liegen auch Daten zum Langzeitüberleben nach ANV vor. Anhand einer retrospektiven Studie von LAFRANCE und MILLER über insgesamt 864 933 hospitalisierte Patienten, von denen 82 711 ein ANV entwickelten und mindestens 90 Tage nach Entlassung noch lebten, verstarben im weiteren Untersuchungszeitraum 17,4 %. Die Mortalität der Patienten mit ANV war signifikant höher als bei denen ohne ANV (28,6 % vs. 16,1 %) [17].
Von den Patienten, die ein ANV überleben, bleiben ca. 5 % auf Dauer dialysepflichtig. Eine Meta-Analyse von COCA et al. fasste 13 Kohortenstudien zusammen [5]. Die Ergebnisse zeigten, dass – im Vergleich zu Patienten ohne ANV–Erkrankte mit ANV ein 8,8-fach erhöhtes Risiko, eine chronische Niereninsuffizienz zu entwickeln, aufwiesen. Das Risiko zur Ausbildung einer terminalen Niereninsuffizienz war bei den Patienten mit ANV 3,1-fach erhöht, das Mortalitätsrisiko war doppelt so hoch.
Neuere Studien, die sich mit Ursachen höherer kardiovaskulärer Morbidität und Mortalität von Patienten mit ANV beschäftigten, bestätigen, dass es selbst nach Wiedererlangen einer normalen GFR zu gestörter Volumenreagibilität kommt und infolgedessen langfristig eine arterielle Hypertonie sowie kardiovaskuläre Ereignissen (z.B. Herzinsuffizienz) auftreten können [11, 23].
Aus diesen Gründen wird in den aktuellen europäischen Leitlinien [14] gefordert:
Patienten sind nach stattgehabtem ANV innerhalb von 2 Monaten auf ihre Nierenfunktion zu überprüfen, um bleibende Schädigungen frühzeitig zu erkennen.
Ursachen und Diagnostik des ANV
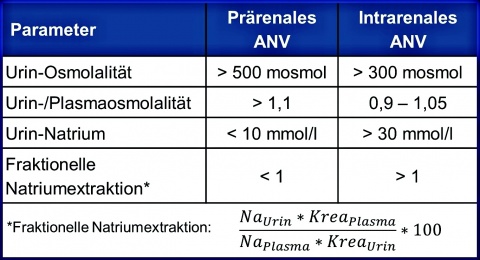
Die häufigsten Ursachen des ANV bei Intensivpatienten sind das prärenale Nierenversagen durch Hypotonie oder Volumenmangel und die akute ischämische Tubulusnekrose (ischämisch – Schockniere, embolisch, vaskulitisch oder toxisch – hepatorenales Syndrom, Sepsis, Medikamente).Der Ausschluss eines postrenalen Nierenversagens durch Sonografie ist obligat.
Eine Differenzierung zwischen prärenalem und intrarenalem ANV ist u.a. laborchemisch möglich (Tabelle 2) .
Die neuen Kriterien sind gegenüber früher deutlich sensitiver geworden; unabhängig davon bleibt Serumkreatinin unzuverlässig bei der genauen Beurteilung der Nierenfunktion. Wiederholte Messungen lassen möglicherweise bessere Rückschlüsse zu.
Cystatin C
Der Marker Cystatin C zeigt insbesondere im „kreatinin-blinden“ Bereich zuverlässiger als Kreatinin eine Einschränkung der Nierenfunktion an. Eine Meta-Analyse von ZHANG e al. zeigte für eine serielle Messung von Cystatin C ein früheres Erkennen eines ANV als mit der Bestimmung von Serumkreatinin.
Cystatin C ist für die Früherkennung des ANV nutzbar [34].
NGAL
Ein weiterer verfügbarer Marker ist das neutrophilengelatinase-assoziierte Lipocalin (NGAL). Im Unterschied zu Cystatin C und Kreatinin ist NGAL nicht von der Nierenfunktion bzw. GFR abhängig, sondern zeigt – analog zur CK bei Herzmuskelzellen – den Untergang von Nierengewebe an (Freisetzung bei der Schädigung von Tubuluszellen). HAASE et al. fassten in einer Meta-Analyse aus 10 prospektiven Studien an 2 322 Patienten als Ergebnis zusammen, dass NGAL in Abwesenheit eines signifikanten Serumkreatininanstiegs ein ANV vorhersagen kann [9]. Die 2016 veröffentlichte AKINESIS-Studie zeigte für NGAL bei Patienten mit akuter kardialer Dekompensation einen prädiktiven Wert ähnlich dem Serumkreatinin [20]. Der routinemäßige Einsatz von NGAL ist aufgrund der hohen Untersuchungskosten und des relativ geringen zusätzlichen Erkenntnisgewinns gegenüber etablierten klinischen diagnostischen derzeit noch nicht gerechtfertigt.
Therapie des ANV
Die konservative Intensivtherapie umfasst als wichtigstes Maßnahmenbundle nach einer zuverlässigen diagnostischen Früherkennung des ANV (mittels Kreatininentwicklung und Harnzeitvolumen entsprechend der KDIGO, siehe Tabelle 1) und der Identifikation von Risikopatienten
- die Vermeidung nephrotoxischer Medikamente,
- einen adäquaten Volumenstatus mittels zielgerichteter, körpergewichtsorientierter kristalloider Flüssigkeitstherapie und
- die Gewährleistung adäquater Perfusionsdrücke von 60–70 mmHg, ggf 80-85mmHg (z.B. im septischen Schock oder vorbestehender chronischer Hypertonie).
Bei vorliegender Normovolämie sind Katecholamine entgegen früherer Annahmen nicht schädlich, sondern wirken protektiv, Noradrenalin ist das bevorzugte Katecholamin der Wahl.
Diuretika sind keine therapeutische Option beim Nierenversagen, sondern lediglich zur Flüssigkeitsbilanz einzusetzen
Eine Volumenüberladung ist ebenfalls zu vermeiden. U.a. wirken interstitielles Ödem der Niere, tubuläre Zellschwellung und venöse Kongestion relevant verschlechternd auf die u.U. bereits eingeschränkte Nierenfunktion.
Prophylaxe ?
Zur Fragestellung einer prophylaktischen Gabe von N-Acetylcystein bei Kontrastmittelexposition wurden diverse kontrollierte Studien aufgelegt. Sowohl die ACT-Studie als auch die REMEDIAL II-Studie hielten fest, dass nach derzeitiger Datenlage die orale Gabe von N-ACC obsolet und für die intravenöse Gabe kein gesicherter Effekt zu erkennen war. In der bisher größten randomisierten Studie (PRESERVE-Studie) zur Gabe von N-ACC und/oder Bikarbonat für ein kontrastmittel-induziertes ANV 5 177 Patienten mit hohem Risiko nach Angiographie untersucht. Die Studie wurde vorzeitig abgebrochen, weil sich die Gruppen hinsichtlich der primären Endpunkte (Tod, Notwendigkeit einer Nierenersatztherapie, anhaltender Serumkreatininanstieg > 50 %) nicht unterschieden [29].
Eine Studie von WILHELM-LEES et al. verglich Daten von Patienten mit und ohne Kontrastmittelgabe. Generell fand sich kein signifikanter Unterschied in der Rate eines konsekutiven ANV [30]. Ähnliche Ergebnisse erbrachte die systemische Analyse bei intensivpflichtigen Patienten von EHRMANN et al. [6].
Grundsätzlich ist anzumerken, dass die Risikoprofile der modernen isoosmolaren Kontrastmittel entsprechend der aktuellen Studienlage einen Verzicht auf kontrastmittelabhängige, indizierte Untersuchungen auch beim kritisch kranken Intensivpatienten nicht rechtfertigen.
Selbstverständlich ist auf einen adäquaten Hydratationszustand zu achten und die Option alternativer Diagnostikverfahren zu prüfen.
Die Gabe von Statinen zur Vermeidung kontrastmittel-induzierter ANV wurde in tierexperimentellen Studien erfolgreich getestet und mittlerweile auch in kleinen klinischen Studien überprüft. Deren Ergebnisse wurden in einer rezenten Meta-Analyse zusammengefasst [19]. Die Autoren kamen zu dem Schluss, dass ein kleiner, jedoch signifikanter positiver Effekt für die hochdosierte Statingabe gegenüber der niedrigen Dosierung oder Placebogabe nachweisbar war. Es fehlen jedoch große randomisierte Studien, um einen generelle Empfehlung aussprechen zu können. Dem folgend wurde eine große doppel-blind kontrollierte Studie mit Artovastatin aufgelegt. Diese musste ohne positiven Effekt vorzeitig gestoppt werden, weil statin-naive Patienten mit vorbestehender Niereninsuffizienz vermehrt ein ANV aufwiesen [3].
Ein weiterer Ansatz ist die Entfernte (remote) ischämische Präkonditionierung (RIC). Dieser einfach durchzuführende Ansatz wurde in einer größeren Studie überprüft [7]. Dabei erfolgte die Präkonditionierung mittels 5-minütiger Ischämie der oberen Extremität, gefolgt von 5-minütiger Erholungsphase über 4 Zyklen. Es zeigten sich eindeutig positive Ergebnisse ohne signifikante Nachteile für die Patienten. Demgegenüber zeigten die Ergebnisse einer großen deutschen multizentrischen Studie keine Unterschiede bei der Inzidenz des ANV [22]. Auch ein zusammenfassender Cochrane-Review konnte keinen Vorteil zeigen. Zusammenfassend kann keine klinische Empfehlung für eine RIC ausgesprochen werden [33].
Eine strikte Kontrolle des Blutzuckerspiegels scheint dagegen vorteilhaft für die Prophylaxe eines ANV zu sein [26].
Nierenersatztherapie
Indikation zur Nierenersatztherapie
Absolute Indikationen zum Beginn einer Nierenersatztherapie sind [14]:
- Hyperkaliämie,
- therapierefraktäre Azidose,
- Flüssigkeitsüberladung,
- urämische Perikarditis,
- Neuropathie und Enzephalopathie,
- therapierefraktärer Hypertonus sowie
- Vergiftung mit dialysablen Toxinen/Medikamenten.
Abgesehen davon gibt es für Intensivpatienten derzeit keine Standardkriterien für eine Therapieentscheidung, sondern lediglich einen Trend, der zu einem frühzeitigen Beginn einer Nierenersatztherapie anhält.
Insbesondere die häufig praktizierte Diuretikagabe scheint die Niereninsuffizienz durch Verschlechterung der prärenalen Komponente negativ zu beeinflussen [21].
Den Beginn eines Nierenersatzverfahrens an Harnstoff-Werten festzumachen erscheint schwierig, weil insbesondere dieser Laborwert sehr vielen Einflussfaktoren unterliegt (z. B. Herzinsuffizienz, Dehydratation, gastrointestinale Blutungen, Sepsis, Verbrennung, Zellzerfall, Hämatome, Steroidgabe, Alimentation, Katabolie, Lebererkrankungen, Schwangerschaft).
Bei der Bewertung des bereits im Vorfeld erläuterten Kreatinin-Wertes muss bedacht werden, dass die messbare Erhöhung in der Regel bereits eine deutliche Schädigung der GFR beinhaltet. Ebenso nehmen viele Faktoren auf den Kreatinin-Absolutwert Einfluss ( z.B. Rhabdomyolyse, Schilddrüsenfunktion, Medikamentinteraktion, Bilirubinerhöhung, Muskelatrophie, Alter, Leberfunktion, Gewicht, Ernährung).
Zum Thema einer frühen prophylaktischen Nierenersatztherapie wurden bis dato zwei prospektive Studien mit widersprüchlichen Ergebnissen publiziert. Die ELAIN-Studie von ZARBOCK et al. erbrachte inklusive der Langzeitergebnisanalyse ein Absenken der Mortalität durch frühen interventionellen Behandlungsbeginn [31]. Demgegenüber stehen die Ergebnisse bei 620 schwerstkranken, beatmungspflichtigen Patienten mit ANV (KDIGO Stadium 3, siehe Tabelle 1) ohne signifikanten Unterschied der 60Tage-Mortalität im Behandlungsarm [8].
Letztendlich werden die Kenntnis einer eventuell besseren Prognose bei frühzeitiger Therapie bzw. die Erfüllung harter Kriterien den Entscheidungsprozess zugunsten einer Nierenersatztherapie tragen.
Therapieverfahren
Intermittierende und kontinuierliche Verfahren, Hämofiltration (Konvektion) und Hämodialyse (Hämofiltration) sind nach gegenwärtigem Stand als gleichwertig zu betrachten und die Entscheidung sollte individuell und anhand klinischer Besonderheiten und Erfahrung getroffen werden (z.B. Kreislaufsituation); neue Hybridtechniken wie die SLEDD („Sustained low efficiency daily dialysis“) sind dabei eine mittlerweile etablierte Alternative [14].
Derzeit wird eine Intensität der Nierenersatztherapie bei kritisch kranken Patienten mit ANV von mindestens 3x wöchentlich für die intermittierende Hämodialyse (IHD) und mindestens 20 ml/kg/h Austauschvolumen für die kontinuierliche veno-venöse Hämofiltration (CVVH) bzw. Hämodialyse (CVVHD) [21]. Eine Nachanalyse der Studiendaten ergab allerdings, dass unabhängig von der Art der verabreichten Nierenersatztherapie die Patienten mit einer größeren täglichen negativen Volumenbilanz eine bessere Überlebenschance hatten. Dies unterstreicht erneut die Bedeutung einer optimalen Volumenbilanz bei intensivpflichtigen Patienten. Eine höhere Intensität der Nierenersatztherapie ist durch evidenzbasierte Studienergebnisse nicht gestützt [25].
Aufgrund von Fluss- und Oberflächenspezifika kommt es im Rahmen einer Nierenersatztherapie zu einer gesteigerten Thrombogenität (aktivierte Monozyten, FXIIa), die bis auf wenige Ausnahmen (z.B. Thrombozytopenie) eine Antikoagulation notwendig werden lässt. Die Dosierung der Antikoagulantien muss individuell erfolgen, dabei müssen sowohl die plasmatische als auch die zelluläre Gerinnung überwacht werden.
Grundsätzlich sollte initial ein Basis-Gerinnungslabor vorliegen. Die standardmäßig eingesetzten Antikoagulantien sind bis dato ist hoch- bzw. niedermolokulare Heparine (HMH/NMH). Na-Zitrat-Antikoagulation ist eine sichere und effektive Alternative und auch im Bundeswehrkrankenhaus etabliert. Ergebnisse früher Studien legten die Vermutung nahe, dass die regionale Zitrat-Antikoagulation Überlebensvorteile für intensivpflichtige Patienten haben könnte [24]. Diese Ergebnisse konnten in einer folgenden prospektiv randomisierten Multizenterstudie nicht komplett bestätigt werden. Diese Arbeit zeigte zwar ein niedrigeres Blutungsrisiko und längere Filterlaufzeiten, aber keinen Unterschied in der Mortalität [10]. Diese Ergebnisse konnten von STUCKER et al. in einer rezenten Studie bestätigt werden und bilden auch unsere klinischen Erfahrungen ab [27].
Zitratfiltration
Die regionale Antikoagulation mittels Tri-Na-Zitrat im zuführenden Schenkel des Dialysegerätes bildet mit dem Calcium des Blutes ein Chelat. Zielwert für das Ca2+ in der Maschine ist 0,25–0,35 mmol/l. Calcium wird anschließend patientennah dem rückführenden Schenkel wieder zugegeben (normwertige Ca-konzentration systemisch). Initial ist eine häufige Messung von Calcium systemisch und in der Maschine notwendig – im steady state etwa noch einmal pro Schicht.
Zitrat wird nach ca. 12 h in Leber und Muskulatur zu Bikarbonat metabolisiert. Bei Leberfunktionsstörungen, Hypoxämie und Schock kann eine mangelnde Metabolisierung und Kumulation des Zitrat zu einer Acidose führen, infolge fehlender Freisetzung aus dem Ca-Zitrat-Komplex zu erniedrigten ionisierten systemischen Calciumwerten und durch die daraufhin gesteigerte Ca-Substitution zu einem erhöhten Gesamtcalciumwert, der als Prädiktor dafür nutzbar ist.
Unter adäquater Metabolisierung würde das aus Zitrat entstehende Bikarbonat zu einer metabolischen Alkalose führen und wird deshalb durch veränderte Bikarbonat-Konzentration in der Filtrations-/Dialyselösung dem Patientenblut wieder entzogen. Es ist therapeutisch möglich, durch Regulierung der Filtrations- und Dialysatflüsse Einfluss auf die metabolische Situation zu nehmen. Die Zitrat- und folglich auch die Ca-Belastung kann neben den Feinabstimmungen (Zitratdosis, Kalziumausgleich) vor allem über den Blutfluss reguliert werden.
Hypernatriämien werden durch eine reduzierte Na-Konzentration im Filtrat zumeist vermieden. Des Weiteren bildet Zitrat mit Magnesium und Phosphat Komplexe, eventuell sind eine zusätzliche Substitution nach Überwachung von Säure-Basen-Haushalt und Elektrolyten notwendig.
Fazit
Das akute Nierenversagen ist eine häufige Komplikation beim Intensivpatienten und ein unabhängiger negativ prognostischer Prädiktor. Insbesondere unter limitierten Ressourcen eines Einsatzszenarios gilt es, das die Ausbildung eines Nierenversagen frühzeitig und präventiv zu bekämpfen:
Oberstes Gebot ist die Sicherstellung der renalen Perfusion, eines adäquaten Volumenaushaltes bei gleichzeitiger Vermeidung einer Volumenüberladung. Nephrotoxisch wirkende Substanzen sollen vermieden werden. Die Beachtung dieser Grundregeln ist besonders bedeutsam, da KEINE spezifischen medikamentösen Maßnahmen zur Nephroprotektion zur Verfügung stehen.
Verfasser
Flottillenarzt Dr. Carsten Veit
Flottillenarzt Dr. Maja Florentine Iversen
Bundeswehrkrankenhaus Hamburg – Klinik für Anästhesie, Intensiv- und Notfallmedizin, Schmerztherapie
Lesserstrasse 180, 22049 Hamburg
E-Mail: [email protected]
Literatur beim Verfasser
Datum: 02.03.2020