Verändertes Keimspektrum von Komplexwunden bei der Behandlung von Verletzten aus Konfliktländern in Deutschland
Aus der Klinik für Unfallchirurgie und Orthopädie, Septische und Rekonstruktive Chirurgie, Sporttraumatologie (Leitender Arzt: Oberstarzt Prof. Dr. B. Friemert) des Bundeswehrkrankenhauses Ulm (Chefarzt: Oberstarzt Dr. R. Hoffmann)
Zusammenfassung
Hintergrund: Die Anzahl von in Deutschland häufig in Bundeswehrkrankenhäusern behandelten Verletzten aus Konfliktländern mit durch multiresistente Erreger kontaminierten Wunden nimmt zu. Bei unzureichender Vorbehandlung liegt bei diesen Patienten häufig eine hohe Keimbelastung mit seltenen Krankheitserregern vor. Deshalb erfolgte eine Überprüfung der aktuellen Richtlinien und Datenbanken in Bezug auf Krankheitserreger bei komplexen Traumawunden in Deutschland im Vergleich zu Patienten mit Wunden und multiresistenten Erregern aus Konfliktländern, die in Deutschland behandelt werden.
Material und Methoden: Es erfolgte ein PubMed-Suche hinsichtlich aller multiresistenten Erreger, Antibiotika-Resis-tenzen und Richtlinien in Deutschland über Ver-öffent-lichungen in der Zeit von 2005 bis 2015. Datenbanken und Empfehlungen des Robert-Koch-Instituts, der Paul-Ehrlich- Gesellschaft und des Nationalen Referenzzentrums für Surveillance von nosokomialen Infektionen wurden analysiert und die Screening-Ergebnisse der verletzten Patienten aus Konfliktländern, die im Bundeswehrkrankenhaus Ulm behandelt wurden, ausgewertet.
Ergebnisse: Das Erregerspektrum nosokomialer Infektionen änderte sich nicht, sehr wohl aber das Verhältnis der Krankheitserreger zueinander. Infektionen mit Methicillin-resistentem Staphylococcus aureus (MRSA) gingen zurück, -Vancomycin-resistente Enterococcus (VRE)-Infektionen nahmen hingegen kontinuierlich zu; und Enterococcus -faecium (E. faecium) ist heute der häufigste VRE. Multiresistente Gram-negative (MRGN)-Erreger spielen bei Verletzten aus Konfliktländern die Hauptrolle, wobei die Datenbanken noch keine Daten in Bezug auf die relativ neue Klassifizierung der MRGN-Krankheitserreger liefern können.
Diskussion: In den letzten zehn Jahren traten Änderungen im Resistenzmuster und im Verhältnis multiresistenter Krankheitserreger zueinander auf. Trotz Rückgangs der -MRSA-Infektionen stieg der Einsatz von Reserveantibiotika an. Infektionen mit VRE werden häufiger, und sogar einige Reserveantibiotika haben ihre Wirksamkeit verloren – zurückzuführen auf die stete Zunahme eines zu unkritischen Einsatzes moderner Antibiotika. Bezüglich 3- und 4-MRGN gibt es noch keine validen deutschen Daten. Diese Erreger spielen die Hauptrolle bei in Deutschland behandelten Verletzten aus Konfliktländern. Routine-Screening und umfassende Hygienemaßnahmen einschließlich Isolierung sind hier von entscheidender Bedeutung. Die chirurgische Wundtherapie tritt gegenüber dem unkritischen, teuren und zunehmend ineffizienten Einsatz von Antibiotika mehr und mehr in den Vordergrund.
Schlüsselwörter: Multiresistente Erreger, Antibiotikaresistenz, Wunden, Konfliktländer, KISS, KRINKO
Keywords: multiresistentant pathogens, antibiotic resistance, wounds, conflict countries, KISS, KRINKO
Hintergrund
Unfallchirurgen und militärische Einsatzchirurgen werden mit zunehmender Tendenz seit einigen Jahren mit wechselnden (multi-)resistenten Keimen bei Komplexwunden von Patienten aus Konfliktgebieten konfrontiert. Das Keimspektrum ist damit einer nicht außeracht zu lassenden Veränderung unterworfen. Der Bedeutung dieser Entwicklung belegt auch die weltweit wachsende Zahl an Publikationen zu dieser Problematik.
Eine PubMed-Recherche (http://www.ncbi.nlm.nih.gov/pubmed, Stand: 15.02.2016) nach den Begriffen „infection + wound“ lieferte ein Ergebnis von 34 144 Artikeln allein in den letzten zehn Jahren, wobei sich die Anzahl der Publikationen von 797 im Jahr 2005 bis auf 3 982 im Jahr 2014 gesteigert hat. Betrachtet man die wachsende Sensibilität für das Thema „multiresistente Keime“ seitens der behandelnden Ärzte, aber auch die finanziellen Konsequenzen bei der Behandlung solcher Patienten für die Krankenhausbetreiber, erkennt man die Wichtigkeit des immer mehr zur Routine werdenden Screenings von Risikopatienten im Zuge der stationären Aufnahme.
Aufgrund des breiter werdenden Keimspektrums und zunehmender Resistenzlage spielt die multimodale Wundtherapie unter interdisziplinärer Beteiligung von Chirurgen, Mikrobiologen, Pharmazeuten, Pflegekräften und Krankenhaushygienikern eine immer größer werdende Rolle. Verschärft wird die Problematik häufig noch durch Begleitfaktoren, wie Patientenalter, Multimorbidität und Begleitverletzungen sowie prolongierte suboptimale chirurgische und antibiotische Vorbehandlungen.
Bundeswehrkrankenhäuser (BwKrhs) werden als Kliniken der Maximalversorgung im Routinebetrieb regelmäßig mit Patienten konfrontiert, die aus anderen Krankenhäusern oder Pflegeheimen zuverlegt werden und – bei längerer Vorbehandlung chronischer Wunden – entsprechende Antibiotikaresistenzen aufweisen.
Eine besondere Herausforderung stellen jedoch verletzte Patienten aus den Krisenregionen Libyen, Syrien, Irak und Ukraine dar, deren Behandlung die politische Führung Deutschlands angeboten hat und die von den BwKrhs umgesetzt wird. Diese sind oftmals schwerstverletzt, weisen bei allgemeiner Schwäche der Immunlage tiefe und große Wunden auf, sind oft unfallchirurgisch und mikrobiologisch unzureichend vorbehandelt und kommen aus Ländern mit kritischerer Antibiotikaresistenzlage und häufig ungewohnt hoher Keimlast seltener Erreger im Vergleich zu Patienten aus Deutschland.
Grundsätzlich ist zwischen einer Kolonisation, d. h. Besiedelung mit normalen Hautkeimen ohne primären Krankheitswert, der Wundinfektion durch antibiotikasensible Keime und schließlich der Entzündung von Wunden durch multiresistente Erreger zu differenzieren. In diesem Zusammenhang ist es hierbei ferner von praktischer Bedeutung, ob es sich um eine Kolonisation/Infektion bei einem Patienten auf einer Normal- oder Intensivstation bzw. aus dem ambulanten Bereich oder einem Pflegeheim handelt [11].
Gemäß Infektionsschutzgesetz (IFSG) § 23 ist jedes Krankenhaus verpflichtet, eine Surveillance, d. h. Beobachtung und Aufzeichnung von definierten Erregern mit besonderen Resistenzen, durchzuführen und den Patienten testgerecht zu behandeln. Mit Hilfe eines sogenannten. Krankenhaus Infektions Surveillance Systems (KISS) und verschiedenen Untersuchungsmodulen (SARI, ITS-, STATIONS-, MRSA- und NEO-KISS) wird die geforderte Erregeraufzeichnung und -überwachung durchgeführt. Auf dieser Datengrundlage lassen sich Veränderungen im Verhalten und Auftreten von MRE darstellen und auswerten [23].
Ziel dieser Arbeit ist es, sowohl über eine Literaturrecherche den Wandel des Keimspektrums unfallchirurgischer Komplexwunden in Deutschland in den vergangenen zehn Jahren, als auch die aktuelle Datenlage eigener Patienten mit komplexen Wunden aus Konfliktländern darzustellen. Im Focus standen dabei die auf gängige Antibiotika-multiresistenten Erreger (MRE), die im klinischen Sprachgebrauch auch als „Problemkeime“ bezeichnet werden.
Material und Methoden
In diese Arbeit sind die Ergebnisse einer PubMed-Recherche zu den Suchbegriffen „MRSA“, „VRE“, „ESBL“, „MRGN“, „Antibiotikaresistenz“, „Epidemiologie“, „KISS“, „KRINKO“ aus Deutschland unter besonderer Beachtung des sich wandelnden Keimspektrums in den letzten zehn Jahren sowie unsere Erfahrungen aus der komplexen Behandlung kriegsverletzter kurdischer Peshmerga-Kämpfer aus Syrien und dem Irak sowie Patienten aus der Ukraine, die in den letzten Jahren im BwKrhs Ulm versorgt wurden, eingeflossen. Hier erfolgte ein Screening auf sämtliche multiresistenten Erreger von den empfohlenen Stellen (neben Wunden Rektum, Urin, Mund-/Nasen-/Rachenraum, Respirationstrakt und großflächige Areale der Haut), dessen Ergebnis nach entsprechender Bebrütung einbezogen wurde. Darüber hinaus haben wir gezielt die Empfehlungen und Datenbanken des Robert-Koch-Instituts, der Paul-Ehrlich-Gesellschaft sowie des Nationalen Referenzzentrums für Surveillance von nosokomialen Infektionen im Hinblick auf die in Deutschland vorkommenden Keime bei Wunden analysiert.
Ergebnisse
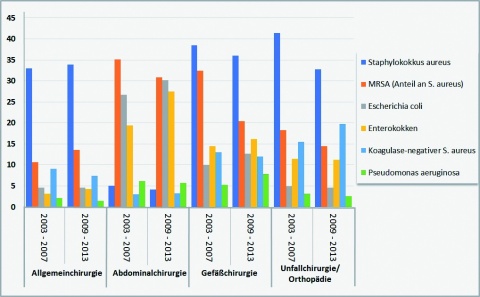
Vergleichenden Auswertungen der Zeiträume 2003 - 2007 und 2009 - 2013 des Nationalen Referenzzentrums für Surveillance von nosokomialen Infektionen [5] – auszugsweise wiedergegeben in Tabelle 1 und Abbildung 1 – zufolge hat sich das Erregerspektrum bei nosokomialen Infektionen in den untersuchten Zeiträumen nicht verändert, sehr wohl jedoch das Verhältnis der einzelnen Keime zueinander [7, 13].
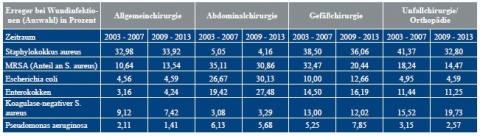
In Orthopädie und Unfallchirurgie ist eine Abnahme von Staphylococcus (S.) aureus-Infektionen (41,4 % auf 32,8 %) zu beobachten; dies gilt auch für MRSA (18,2 % auf 14,5 %) [14, 15, 16, 19]. S. aureus hat als Wundkeim der Abdominalchirurgie aufgrund der im Vergleich zu anderen chirurgischen Fachgebieten unterschiedlichen Darmflora zwar eine untergeordnete Bedeutung (5,1 % bzw. 4,2 %), im Falle einer Infektion erweisen sich jedoch mehr als 30 % dieses Erregers als multiresistent. Infektionen durch Koagulonase-negative Staphylokokken (KNS) nehmen hingegen zu (15,5 % auf 19,7 %). Während die Bedeutung von Enterokokken als Infektionserreger in Orthopädie und Unfallchirurgie gleich bleibt (11,4 % zu 11,3 %), ist in der Auswertung aller Fachgebiete zusammen ein Anstieg an Infektionen zu verzeichnen [3, 21, 22]. Insgesamt ist eine Zunahme an gramnegativen Keimen zu beobachten (Abbildung 1).
Entwicklung der allgemeinen Resistenzlage
Bezogen auf das beschriebene Keimspektrum zeigt die Prävalenzstudie Deutschland 2011 zur Antibiotikaresistenzlage für Methicillin-/Oxacillin-resistente Keime (Vier-Jahres-Antibiotika-Resistenz-Surveillance (ARS)) auf, dass in den Vergleichsjahren 2009 und 2012 sowohl in der allgemeinen stationären Versorgung (24,2 % auf 21,3 %) als auch auf Intensivstationen (26,7 % auf 21,7 %) der Anteil an MRSA bezogen auf den Gesamtnachweis von S. aureus abgenommen hat. Einschränkend muss jedoch festgestellt werden, dass die Vier-Jahres-ARS nicht allein die Wundinfektion wiedergibt, sondern auch andere Infektionen (z. B. Nachweis in Blutkulturen) inkludiert [12]. Entgegen dem abnehmenden Trend von MRSA-Infektionen nimmt der Anteil Vancomycin-resistenter Enterokokken (VRE) an nosokomialen Infektionen stetig zu. Überdies hinaus hat sich die Verteilung von E. faecalis zu E. faecium in den letzten 10 Jahren verschoben. E. faecium wiederum macht nunmehr den größten Anteil der VRE aus (8 - 15 %), E. faecalis lediglich <1 % [19, 20, 22].Multiresistente gramnegativen Stäbchenbakterien (MRGN) zeichnen sich durch ihre Resistenz gegen mehrere Antibiotikagruppen aus: Einerseits führt die Fähigkeit, das Enzym Extended-Spectrum-β-Lactamase (ESBL) zu produzieren, was zu einer Resistenz gegen β-Lactam Antibiotika führt, andererseits können auch Carbapeneme eliminiert werden.
Die Klassifizierung der MRGN ergibt sich aus der Resistenz gegen die vier Antibiotikaklassen:
- Penicilline,
- Cephalosporine,
- Chinolone und
- Carbapeneme.
ESBL-Klebsiellen gescreent worden, so werden nunmehr alle Stationen und zusätzlich auch 3- und 4-MRGN sowie weitere Keime erfasst.
Die zunehmende Resistenz gegen Antibiotika gilt im Speziellen für die gramnegativen Stäbchenbakterien Pseudomonas aeruginosa, Acinetobacter baumannii sowie Escherichia coli und Klebsiella pneumoniae [6, 8].
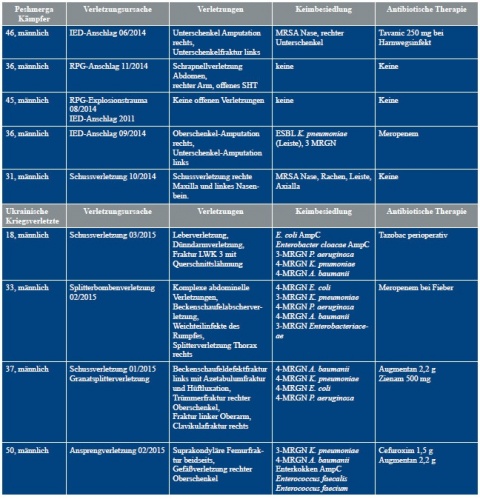
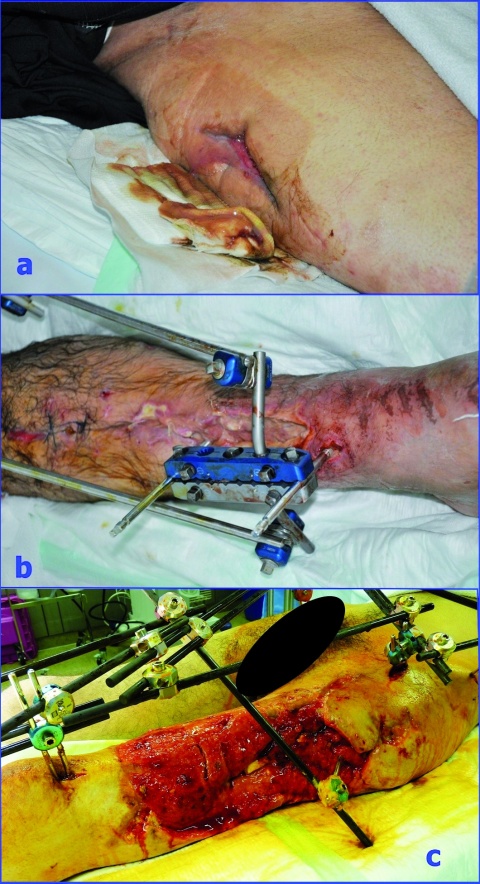
Tabelle 2 zeigt die Verletzungsursachen und die Keime, die bei den Verletzten aus Konfliktländern (hier: Irak, Syrien, Ukraine) nachgewiesen wurden. Es zeigt sich, dass sich vor allem MRSA, 2- und 3-MRGN Pseudomonas aeruginosa sowie 3- und 4-MRGN Klebsiella pneumoniae in den Screenings und Wunden nachweisen ließen. Zusätzlich konnte die Besiedlung von 4-MRGN Acinetobacter baumannii an unterschiedlichsten Lokalisationen detektiert werden. Hinzu kamen sensible Keime, wie Citrobacter freundii oder Proteus mirabilis. Auch 3-MRGN Morganella morganii war in Drainagesekreten vorhanden. Die Wunden waren somit überwiegend mit 3- und 4-MRGN-Keimen kontaminiert (Abbildung 2).
Diskussion
Keimspektrum und Resistenzlage
Wir konnten anhand der Daten aktueller Erhebungen, insbesondere des Robert-Koch-Instituts, der Paul-Ehrlich-Gesellschaft sowie des Nationalen Referenzzentrums für Surveillance, von nosokomialen Infektionen sowie der eigenen Behandlung von Patienten mit kritischen Wunden aus Konfliktregionen zeigen, dass sich weniger das Erregerspektrum in den vergangenen Jahren, sondern vielmehr das Verhältnis der einzelnen Keime zueinander sowie die Resistenzlage verändert haben [7, 13]. Wie aufgezeigt, hat sich das Verhalten der resistenten Keimbesiedelungen vom MRSA hin zu deutlich resistenteren Keimen mit wachsendem Anteil wie VRE und MRE (3-/4-MRGN) hin verschoben. Der Nachweis von MRSA an nosokomialen S. aureus-Infekten ist zwar im untersuchten Zeitraum (1997 - 2012) des KISS signifikant zurückgegangen, darf aber nicht völlig außer Acht gelassen werden, da zunehmend auf Reserveantibiotika oder Kombinationen verschiedener Antibiotikagruppen ausgewichen werden muss [7, 11, 13, 23].
Gibt es für die MRSA-Keime bei Resistenzen gegen Ciprofloxacin (93 %) und Moxifloxacin (91 %) noch Therapiemöglichkeiten mit Rifampicin (Resistenz von 1,7 %), können jedoch auch günstige Wirksamkeitsprofile für Kombipräparate mit Cotrimoxazol + Fusidinsäure-Na+ oder Fosfomycin eine Alternative darstellen. Resistenzen sind auch gegen Glykopeptide und Daptomycin gezeigt worden [10].
Demgegenüber musste jedoch ein Anstieg der Vancomycin-resistenten Keime (VRE), hier im Speziellen des E. faecium, verzeichnet werden [3, 19, 22]. Seitens der VRE ist vor allem die Behandlung von Infektionen mit E. faecium zur Herausforderung geworden. Hat sich das Verhältnis von E. faecalis zu E. faecium von 90 % zu 10 % auf 60 % zu 40 % geändert, so ist zugleich auch ein absoluter Anstieg beider Keime zu verzeichnen [11, 12, 13, 21, 23]. Wesentlich dabei ist jedoch, dass nahezu alle VRE resistent gegen Ampicillin sind. Zusätzlich weisen bestimmte Stämme von E. faecium Hochresistenzen gegen Aminoglycoside (Gentamycin, Streptomycin) auf. Betrachtet man die Reserveantibiotika, so bestehen bereits geringe Therapielücken für Tigecyclin und deutliche Resistenzen gegenüber Linezolid [19]. Die Selektion von VRE erklärt sich am ehesten durch den vermehrten Einsatz moderner Antibiotika mit einer sogenannte „Enterokokken-Lücke“ (z. B. Fluorchinolone, Cephalosporine). Auch die Zunahme geriatrischer, multimorbider Patienten einer alternden Bevölkerung trägt zur absoluten Steigerung an VRE-Infektionen bei [3, 4, 19, 21, 22]. Als Risikobereiche neben der Hämatologie/Onkologie, Neurologie und Urologie wie auch Intensivmedizin gelten insbesondere auch die chirurgischen Disziplinen.
Herausforderung: Gram-negative Keime
Noch kritischer wird die Betrachtung der 3- und 4-MRGN-Keime. Diese wurden bisher nicht im Rahmen des KISS erfasst, und somit bestehen auch noch keine validen Langzeitdaten. Diese Keime stellen mittlerweile einen nicht unwesentlichen Anteil an nosokomialen Kontaminationen dar und schränken durch i mentösen therapeutischen Möglichkeiten gravierend ein.
Diese in der Literatur beobachtete Zunahme Gram-negativer Keime und die damit verbundene Resistenzlage lässt sich auch durch unsere eigenen Erfahrungen bestätigen [6, 8]. Die in dieser Untersuchung behandelten Verletzten aus Konfliktländern boten ein Spektrum an resistenten und hochresistenten Keimen, das in diesem Ausmaß sonst in Deutschland so nicht vorkommt. Dies zeigt uns, dass wir uns dieser Herausforderung nicht nur stellen, sondern bereits jetzt unbedingt auf diese neue Situation reagieren müssen, um die Entwicklungen in diesem Bereich nicht zu verpassen.
Schlüsselrolle: Krankenhaushygiene
Der Wandel der Resistenzlage lässt gängige Antibiotika häufig ineffektiv werden, was die Bedeutung grundsätzlicher und spezieller hygienischer Vorkehrungsmaßnahmen unterstreicht. Um eine nosokomiale Ausbreitung zu verhindern, hat die Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut (RKI) eine einheitliche Kennzeichnung dieser Erreger (im Speziellen der MRGN) vorgeschlagen und die daraus abzuleitenden spezifischen Hygienemaßnahmen für Krankenhauspatienten definiert, vor allem auch deswegen, weil Infektionen mit diesen Erregern mit einer höheren Morbidität und Mortalität einhergehen [17]. Zu den grundsätzlichen Maßnahmen („Basismaßnahmen der Krankenhaushygiene“) für alle Patienten zählen gemäß KRINKO die Händedesinfektion, das Tragen von Arbeits- und Bereichskleidung im Sinne des Selbstschutzes und der Verhinderung der Erregerübertragung und die regelmäßige Schulung der Mitarbeiter (nach §23 Abs. 8 Nr. 5 IfSG) [1, 2, 18].
Screening bei Risikopatienten
Eine weitere Säule des risikobasierten Maßnahmenbündels bei MRGN gemäß RKI stellt das MRGN-Screening für Patienten mir Risikofaktoren dar: Wie die in Abbildung 2 dargestellten Bilder verdeutlichen, handelt es sich regelhaft um kritisch tiefe und große Wunden; zumindest eine Mischkontamination liegt grundsätzlich vor. Neben den offensichtlichen Abstrichen aus der Wundregion sollten darüber hinaus im Rahmen des Hygienescreenings folgende Regionen mit Screening-Abstrichen adressiert werden: Rektum, Urin, Mund-/Nasen-/Rachenraum, Respirationstrakt und großflächige Areale der Haut. Nur damit ist möglichst frühzeitig eine umfassende Aussage zum Keimspektrum zu erhalten. Dies sollte auch auf einheimische Patienten übertragen werden, die aus anderen Krankenhauseinrichtungen, Altersheimen, Pflegeinrichtungen oder mit entsprechender Auslandsanamnese stationär aufgenommen werden.
Spezielle Hygienemaßnahmen
Hinsichtlich der dritten Säule – spezielle Maßnahmen, die abhängig von Erreger und Resistenz zu treffen sind – gilt es, verschiedene Aspekte zu beachten. Die Unterbringung von kontaminierten Patienten mit 3- bzw. 4-MRGN sollte in Einzelzimmern oder Kohorten erfolgen; auch die pflegerische Betreuung sollte hiernach ausgerichtet organisiert werden.
Krankentransporte sind auf das notwendige Minimum zu beschränken, als Einzeltransport durchzuführen und eine Keimverbreitung durch Desinfektion von Bett und Transportmitteln möglichst zu verhindern. Wunden sind durch geeignete Wundabdeckungen verschlossen zu halten. Soweit vertretbar und technisch möglich, sollten therapeutische und diagnostische Maßnahmen möglichst im Zimmer durchgeführt werden; nach Beendigung ist das vorzugsweise benutzte Einwegmaterial zu entsorgen und Gerätschaften durch Wischdesinfektion zu dekontaminieren – was bei der Anwendung „klassischer“ Medizingeräte eine erhebliche Herausforderung ist [9]. Therapeutische Eingriffe an Patienten mit multiresistenten Erregern im Operationssaal erfordern höchste Hygienemaßnahmen und sollten ans Ende des Tages – gefolgt von einer sorgfältigen Flächendesinfektion – gestellt werden, um das Risiko der Übertragung zu minimieren. Dies gilt auch, wenn ein eigens dafür vorgesehener (septischer) OP-Bereich verfügbar ist [17].
Focus: Chirurgische Wundbehandlung
Die ungünstiger werdende Resistenzlage gegen gängige Antibiotika lässt somit einerseits allgemeine und spezielle Präventionsmaßnahmen sowie die Früherkennung mittels Screening-Untersuchungen in den Vordergrund rücken. Andererseits steht auch nicht die oft unkritisch eingeleitete und teure Antibiotika-Therapie bei der Behandlung von chronischen und infizierten Wunden im Mittelpunkt: Hier sollte sich auf die chirurgische Behandlung kontaminierter Wunden, ggf. mit radikalem Debridement und mehrfacher Wundkonditionierung, besonnen werden.
Gesundheitsökonomische Aspekte
Allein die zuletzt stattgehabte, stationäre Behandlung von ukrainischen Patienten wurde im Schnitt mit nur etwa 13 000 - 46 000 € je Patient und Aufenthalt entsprechend der „Diagnosis Related Group“ abgegolten, obgleich die durchschnittliche Liegezeit deutlich länger war als im Fallpauschalenkatalog vorgesehen und mit mehrfachen Operationen und u. a. langwieriger antibiotischer Therapie mit Reserveantibiotika einherging. Eine Kostendeckung lag somit nicht vor.
Die Flüchtlinge und Asylwerber aus Ländern mit für uns ungewohntem Keimspektrum und hoher Keimlast stellen seit der „Flüchtlingskrise“ eine Realität in Deutschland und unseren Krankenhäusern dar. Zu wissen, was die Behandler hier erwartet, kann der entscheidende Vorteil für den Patienten, das Krankenhauspersonal und die Mitpatienten sein, um die optimale Behandlung sicherzustellen und sämtliche Vorgaben der Krankenhaushygiene korrekt und ohne Kompromisse umsetzen zu können.
Kernaussagen / Fazit
- Von der Entwicklung der Resistenzlage nosokomialer Infektionen in der letzten 10 Jahren sind im chirurgischen Fachgebiet vor allem chronische Wunden betroffen.
- Einem statistisch relevanten Rückgang von MRSA-Infektionen steht eine besorgniserregende Zunahme von Infektionen mit VRE und vor allem 3- und 4-MRGN-Erregern gegenüber; notwendige Antibiotikatherapien werden damit immer selektiver, teurer und ineffektiver.
- Neben allgemeinen und spezifischen hygienischen Vorkehrungen sollte eine Rückbesinnung auf die chirurgische Wundsanierung als wesentliche therapeutische Maßnahme bei infizierten Wunden erfolgen.
- Rationaler und kritischer Umgang mit Antibiotika sowie gute Basishygiene, einschließlich Frühscreening von Risikopatienten, sind die wichtigsten Präventionsmaßnahmen gegenüber nosokomialen Infektionen.
Literatur
- Arbeitsmedizin BFaU: Technische Regel für Biologische Arbeitsstoffe 250. In: Arbeitsmedizin BfAu (ed) [http://www.baua.de/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/TRBA-250.html]. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Gemeinsames Ministerialblatt 2015: p 577.
- stoffe 500. In: Arbeitsmedizin BfAu (ed) [http://www.baua.de/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/TRBA-500.html]. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Gemeinsames Ministerialblatt 2012: p 373 - 379.
- Bourdon N, Fines-Guyon M, Thiolet JM et al.: Changing trends in vancomycin- resistant enterococci in French hospitals, 2001 - 08. J Antimicrob Chemother 2011; 66: 713 - 721.
- Diazgranados CA, Zimmer SM, Klein M et al.: Comparison of mortality associated with vancomycin-resistant and vancomycin-susceptible enterococcal bloodstream infections: a meta-analysis. Clin Infect Dis 2005; 41: 327 - 333.
- Infektionen NRFSVN: MRSA-KISS. In: Nationales Referenzzentrum für Surveillance von nosokomialen Infektionen. 2015.
- Kaase M:Carbapenemases in gram-negative bacteria. Current data and trends of resistance resulting from the work of national reference centres. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012; 55: 1401 - 1404.
- Kock R, Mellmann A, Schaumburg F et al.: The epidemiology of methicillin-resistant Staphylococcus aureus (MRSA) in Germany. Dtsch Arztebl Int 2011; 108: 761 - 767.
- Kuenzli E, Jaeger VK, Frei R et al.: High colonization rates of extended-spectrum beta-lactamase (ESBL)-producing Escherichia coli in Swiss travellers toSouth Asia- a prospective observational multicentre cohort study looking at epidemiology, microbiology and risk factors. BMC Infect Dis 2014; 14: 528.
- Lange SG, Foroutan B, Kating W: Apparative Diagnostik unter Bioschutz-Stufe 3+-Isolationsbedingungen – eine bislang nicht beachtete Herausforderung in der Behandlung hochkontagiöser Infektionskrankheiten. Wehrmedizinische Monatsschrift 2015; 59(11): 371.
- Layer F, Cuny C, Strommenger B et al.: Current data and trends on methicillin-resistant Staphylococcus aureus (MRSA). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012; 55: 1377 - 1386.
- Meyer E, Schroder C, Gastmeier P et al.: The reduction of nosocomial MRSA infection in Germany: an analysis of data from the Hospital Infection Surveillance System (KISS) between 2007 and 2012. Dtsch Arztebl Int 2014: 111: 331 - 336.
- Noll I, Schweickert B, Abu Sin M et al.: Antimicrobial resistance in Germany. Four years of antimicrobial resistance surveillance (ARS). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012; 55: 1370 - 1376
- Ott E, Saathoff S, Graf K et al.: The prevalence of nosocomial and community acquired infections in a university hospital: an observational study. Dtsch Arztebl Int 2013; 110: 533 - 540.
- Paul-Ehrich-Gesellschaft: Resistenzdaten . In:Paul-Ehrlich-Gesellschaft für Chemotherapie e. V. 2013 [ http://www.p-e-g.org/econtext/resistenzdaten].
- Robert-Koch-Institut: ARS – Antibiotika-Resistenz-Surveillance. [https:/www.ars.rki.de] 2015.
Bildquellen: BwKrhs Ulm – Klinik für Unfallchirurgie und Orthopädie, Septische und Rekonstruktive Chirurgie , Sporttraumatologie
Für die Verfasser:
Oberfeldarzt Dr. Hans-Joachim Riesner
Klinik für Unfallchirurgie und Orthopädie, Septische und Rekonstruktive Chirurgie, Sporttraumatologie
Bundeswehrkrankenhaus Ulm
Oberer Eselsberg 40, 89081 Ulm
E-Mail: [email protected]
Datum: 04.04.2017
Quelle: Wehrmedizinische Monatsschrift 2017/2-3