RISIKO GESUNDHEITLICHER SCHÄDEN NIEDRIGER STRAHLENDOSEN - GENEXPRESSIONSUNTERSUCHUNGEN AN STRAHLENEXPONIERTEN KOHORTEN
Health risk after low level radiation - Gene expression changes observed in radiation exposed cohorts
Aus dem Institut für Radiobiologie der Bundeswehr in Verbindung mit der Universität Ulm, München (Leiter: Oberstarzt Prof. Dr. med. V. Meineke)
Michael Abend
WMM, 58. Jahrgang (Ausgabe 5/2014, S. 173-177)
Zusammenfassung
Hintergrund: Wir untersuchten, ob Strahlenexposition zu einer Neueinstellung der genomischen Aktivität führt, diese Änderungen persistieren und ob sie mit dem Auftreten chronischer Erkrankungen korrelieren.
Methoden: Gesamt-RNA wurde aus 63 Schilddrüsentumoren/-normalgewebe (Chernobylkohorte), sowie aus Blutproben von 150 Majak-Arbeitern isoliert. Mittels 2-Phasen-Studiendesign wurden die Proben zum Screening des gesamten Genoms (Phase I) und zur anschließenden Validierung von Kandidatengenen mittels qRT-PCR (Phase II) hälftig verwendet.
Ergebnisse: In beiden Kohorten konnten bis zu 2 Jahrzehnte nach Bestrahlung persistierende Dosis-Wirkungsbeziehungen z. T. der gleichen Gene (30 %) gefunden werden, die signifikant mit z. B. atherosklerotischen Erkrankungen korreliert sind.
Schlussfolgerungen: Die Identifikation persistierender strahleninduzierter Gene in verschiedenen Kohorten unter Verwendung unterschiedlicher Verfahren und Materialien repräsentiert u. U. die Basis für eine neuartige Diagnostik (auch im Wehrdienstbeschädigungsverfahren) und neue therapeutische Ansätze.
Schlagwörter: Chernobyl, Majak-Arbeiter, Genexpression, Gesamt-Genomanalyse, Mikroarray, qRT-PCR
Summary
Background: We examined radiation induced gene expression changes persisting many years after exposure and their association with chronic diseases.
Material and Methods: Total RNA was isolated from 63 papillary thyroid cancer biopsies and associated normal thyroid tissues (Chernobyl project) as well as from 150 blood samples derived from Majak workers exposed to external-gamma rays and internal plutonium incorporation. According to a 2-phase study design we divided the samples for screening of the whole genome in phase I and validation of selected candidate genes in phase II.
Results: We observed in both cohorts persistent and significant gene-dose associations of genes (similar in 30 %) up to 2 decades after radiation exposure which partly correlated significantly with e. g. atherosclerotic diseases.
Conclusion: Identifying persistent radiation-induced genes in different cohorts, using different methods and materials might provide the base for a new kind of diagnostic and therapeutic regimen.
Key words: Chernobyl, Majak-worker, gene expression, whole genome analysis, microarray, qRT-PCR
Einführung
Anruf eines Truppenarztes beim Institut für Radiobiologie der Bundeswehr (InstRadBioBw): „Herr Oberstarzt, heute stellten sich ein Soldat und eine Soldatin bei mir vor. Beide befanden sich im Auslandseinsatz. Sie inspizierten eine zerbombte Fabrik. Einer von ihnen trug ein Dosimeter. Nach Auswertung des Dosimeters wurde eine Dosis von 2 mSv gemeldet. Die Soldaten sind verunsichert, zumal sich mittlerweile herausstellte, dass die Soldatin bereits schwanger war, als sie exponiert wurde. Wie gefährlich ist die Strahlung? Sind bleibende gesundheitliche Schäden zu erwarten?“
Anrufe wie diese erreichen das InstRadBioBw regelmäßig und stehen im Besonderen mit unklaren Expositionslagen während des Auslandseinsatzes in Verbindung. Sie zielen häufig in dieselbe Richtung: Wie gefährlich ist die Exposition mit „kleinen“ Strahlendosen?
Epidemiologische Studien an Erwachsenen belegen zweifelsfrei eine Erhöhung der Tumormortalität mit steigender Strahlendosis ab einer Exposition von ca. 200 mSv. Über einen Anstieg nach Expositionen <100 - 200 mSv kann nur spekuliert werden. Die zusätzlichen strahleninduzierten Erkrankungen über der Spontanrate lassen sich nur dann statistisch erfassen, wenn sehr große Kollektive über Dekaden untersucht werden. So sind z. B. zur statistischen Erfassung des Mamma-Ca-Risikos nach z. B. 8 mSv (entspricht der Strahlenexposition einer Mammographie oder etwa der dreifachen Jahresdosis der natürlichen Strahlenexposition) ca. 100 000 000 Brusttumorträger und eine gleiche Anzahl an Kontrollen über Jahrzehnte zu untersuchen [1]. Mit den klassischen analytischen Werkzeugen der Epidemiologie können diese kleinen Risiken nicht erfasst und solche Kohortenstudien mit jahrzehntelanger Dauer nicht realisiert werden. Also werden die bekannten Risiken nach höheren Strahlenexpositionen auf den Bereich niedrigerer Strahlendosen mathematisch extrapoliert („linear no threshold model“).
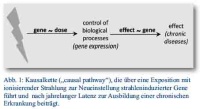
Gibt es andere Wege, die tatsächlichen gesundheitlichen Risiken abzuschätzen? Ionisierende Strahlung führt zu einer biologischen Antwort, die interindividuell unterschiedlich sein kann. Ein anderer Weg (Kombination molekularbiologischer und epidemiologischer Verfahren) müsste somit folgenden Ansprüchen genügen (Abb. 1):
- Die biologischen Änderungen sollten kausal und möglichst nur nach Strahlenexposition auftreten. Somit könnten die wenigen strahleninduzierten chronischen Erkrankungen von der Mehrzahl der spontan auftretenden chronischen Erkrankungen differenziert werden. Basierend auf Berechnungen sind ca. 97 % der auftretenden Tumore nicht auf die natürliche Strahlenexposition zurückzuführen, sondern haben andere Ursachen (z. B. 30 % Rauchen, 30 % Ernährung).
- Aufgrund der langen Latenz von der Exposition bis zum Auftreten chronischer Erkrankungen sind persistierende und nachweisbare biologische Änderungen vor Auftreten der Erkrankung erforderlich.
- Eine Gen-Dosisbeziehung, die als Hinweis auf strahleninduzierte biologische Veränderungen interpretiert wird, bedeutet nicht zwingend, dass auch eine Effekt-Gen-Beziehung besteht. Ist auch die Effekt-Gen-Beziehung gegeben, dann ist die Kausalbeziehung von der Exposition über ein strahleninduziertes Gen, das zu einer Erkrankung führt, wahrscheinlich.
Die Kombination molekularbiologischer und epidemiologischer Verfahren könnte wie folgt Anwendung finden: Für die unterschiedlichsten Umweltfaktoren (z. B. Temperatur in Pflanzen, [2]) wurde bereits eine Modifikation der Ablesung der Gene gezeigt. Tatsächlich können solche Modifikationen permanent in das Genom geschrieben werden (DNA-Methylierung) und von einer zur anderen Zellgeneration bzw. auch an die nächste Nachkommenschaft weitervererbt werden [2]. Dieser Prozess wird als epigenetische Modifikation bezeichnet, weil die genomische Sequenz nicht verändert wird, aber die Aktivierung/Regulation von Genen neu eingestellt wird. Es ist wie ein Schalter, der in eine neue Position gedreht und dort arretiert wird. In der Folge kommt es zu einer Anpassung des Organismus an geänderte Umweltbedingungen (z. B. der Pflanze bei veränderten Außentemperaturen). Strahlenexposition ist ein Umweltfaktor. Findet eine strahlenspezifische permanente Neueinstellung des Genoms an verschiedenen Genen statt, so dass sie Jahre nach Strahlenexposition nachweisbar wäre, dann könnte eine solche Gensignatur als Indikator für eine Strahlenexposition betrachtet werden. Zusätzliche Strahlenexpositionen, die z. B. im Rahmen von Auslandseinsätzen passierten, würden sichtbar werden. Die Frage nach einer Wehrdienstbeschädigung (WDB) könnte individuell und objektiv beurteilt werden.
Würde darüber hinaus ein Zusammenhang zwischen den strahleninduzierten Genen und dem Auftreten chronischer Erkrankungen (z. B. Tumore) gezeigt werden, dann könnte die Gensignatur auch zur Prädiktion eines gesundheitlichen Schadens Verwendung finden und als „gene target“ i. S. eines therapeutischen Ansatzes eingesetzt werden.
Das Ziel unserer Untersuchungen war erstens der Nachweis persistierender Änderungen der Genexpression bestimmter „gene targets“ nach Bestrahlung und zweitens die Untersuchung auf eine Assoziation dieser Gene mit chronischen Erkrankungen. Hierzu untersuchten wir zwei strahlenexponierte Kollektive, Chernobyl-Unfallopfer (Einzeldosis) und Majak-Arbeiter, die im Zuge der Entwicklung des russischen Atomprogramms über lange Zeiträume mit kleinen Strahlendosen extern exponiert wurden bzw. teilweise Radionuklide inkorporierten. In einem zwei-Phasen-Studiendesign wurden zunächst das gesamte mRNA Transkriptom und weite Teile des micro-RNA (miRNA) Transkriptoms (nur Majak-Projekt) an der einen Hälfte der Untersuchungsproben gescreent, Kandidatengene selektiert und diese Gene mit einem quantitativen Verfahren der Genexpressionsanalyse (qRT-PCR1) an den verbleibenden Proben validiert.
Material und Methoden
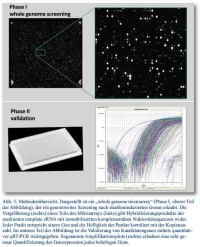
Von 63 Schilddrüsentumorträgern (Kinder und Jugendliche), die während des Chernobyl Kernkraftwerksunfalls mit J-131 kontaminiert wurden, erhielten wir über die „Chernobyl Tissue Bank“ RNA-Proben. Diese wurden aus kryokonservierten Biopsien isoliert. Wir erhielten sowohl 63 RNA-Proben aus der Schilddrüsentumorregion als auch 63 RNA-Proben aus korrespondierenden histologisch normalen Schilddrüsengeweben, die fern vom Tumor entnommen worden waren (Abb. 2). In der Phase I des 2-Phasen Studiendesigns wurde das gesamte mRNA Transkriptom mit Hilfe von „whole genome microarrays“ gescreent (Abb. 3). Die Proben wurden zu drei Gruppen ca. gleicher Probenanzahl und aufsteigender Strahlenexposition zusammengefasst (< 0,3 Gy; 0,3-1,0 Gy; > 1,0 Gy). Die niedrigste Dosisgruppe diente als Referenz (Kalibrator) für quintil-normalisierte log2-transformierte Genexpressionsdaten. Die bioinformatische Analyse erfolgte mit PANTHER oder DAVID Datenbanken für solche Gene, die bezüglich bestimmter biologischer Prozesse über- oder unterrepräsentiert erschienen. Signifikant und > 2-fach deregulierte Gene (hoch- oder runterreguliert) wurden selektiert und i. R. der Phase II an den verbleibenden Proben und mittels qRT-PCR validiert (Abb. 3). Eine methodische Validierung der Mikroarrays mit qRT-PCR wurde schließlich durch Mittelwertbildung für dasselbe Gen durchgeführt, das in den zwei Personengruppen gemessen wurde. Beide Verfahren zeigten eine Übereinstimmung im Bereich von 93 % (r2=0.86). Die qRT-PCR Daten wurden schließlich auf ihre Assoziation mit der Expositionshöhe statistisch untersucht (für Details siehe [3, 4]).
Von unserem russischen Kooperationspartner erhielten wir i. R. eines anderen Forschungsprojekts 100 Blutproben strahlenexponierter ehemaliger Majak-Arbeiter (aktuell in Ozyorsk lebend) und 50 Blutproben von Individuen mit ähnlichem sozialen Hintergrund, die jedoch nicht exponiert worden waren (für Details siehe [5] und Abb. 2). Diese dienten i. R. des Majak-Projekts als Referenz (Kalibrator). Bei der Exposition handelte es sich häufig um eine ca. 2 Jahrzehnte anhaltende externe Gammabestrahlung in Kombination mit einer internen Plutoniumkontamination. Für die Phasen I und II folgte das Studiendesign weitgehend dem geschilderten Chernobylprojekt. Allerdings wurden neben dem mRNA Transkriptom auch weite Teile (667 von ca. 1 200 miRNA) des miRNA Transkriptom (oder post-Transkriptom) mituntersucht. Nachdem für die Majak-Arbeiter strahleninduzierte Gene identifiziert worden waren, wurde zudem in einer III. Phase deren Assoziation mit chronischen Erkrankungen wie Schilddrüsenerkrankungen, chronischem Strahlensyndrom, Atherosklerose oder Diabetes untersucht. Diese Daten standen nur für die Majak-Arbeiter zur Verfügung. Tumorträger waren bei den Majak-Arbeitern ausgeschlossen worden.
Ergebnisse
Mit Hilfe der „whole genome microarrays“ wurden gleichzeitig 42 545 Transkripte und ca. 19 596 Gene auf eine Assoziation mit der Strahlenexposition als Screening für geeignete Kandidatengene untersucht. In beiden Kohorten waren ca. 800 - 1000 Gene dosisabhängig signifikant verändert. Nach bestimmten Kriterien wurden hieraus 95 Kandidatengene für die weitere Validierung mittels qRT-PCR selektiert.
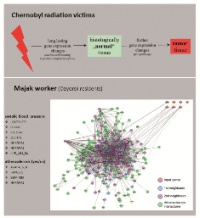
Von diesen 95 untersuchten Genen wurde im Zuge des Chernobyl-Projekts schließlich im Normalgewebe acht Gene und im Tumorgewebe sechs Gene identifiziert, die eine signifikante Änderung der Genexpression in Abhängigkeit von der Dosis aufwiesen (für Details siehe [3, 4]). Die bioinformatische Auswertung (Gesamtgenomanalyse) nach veränderten biologischen Prozessen ergab, dass bestimmte biologische Prozesse gleichermaßen im Normal- und Tumorgewebe neu eingestellt worden waren (z. B. RNA-Bindung und Nukleinsäure-Stoffwechsel), während im Tumorgewebe zusätzlich eher Proliferation (z. B. FGF-, EGF2-Signaltransduktionswege) und Reparatur (p53) kodierende Prozesse überrepräsentiert (die Anzahl der dafür kodierenden Gene war erhöht) erschienen (Abb. 4).
Im Rahmen des Majak-Projekts wurden schließlich mit dem selben Screeningverfahren 15 mRNA und aus 667 miRNAs 15 miRNA-Spezies identifiziert, die Jahrzehnte nach Bestrahlung eine signifikante Assoziation mit der Strahlenexposition aufwiesen. Diese Gene entsprachen in ca. 30 % den Genen, die in der Chernobylkohorte als strahleninduziert gefunden worden waren. Dabei dominierten in der Majak-Kohorte Änderungen der Genexpression nach Plutoniuminkorporation (α-Strahler) über solchen nach externer Gammastrahlenexposition (Details siehe [5] bzw. zur Veröffentlichung eingereichte Arbeiten). Verschiedene dieser strahleninduzierten Gene wiesen zudem eine signifikante Assoziation mit Schilddrüsenerkrankungen, dem chronischen Strahlensyndrom sowie erhöhtem Blutdruck und atherosklerotischen Prozessen auf (Abb. 4).
Diskussion
In vivo Genexpressionsuntersuchungen an zwei strahlenexponierten Kohorten führten zu folgenden Ergebnissen:
- Jahrzehnte nach externer Gammastrahlenexposition, nach ß-Strahlenexposition (Inkorporation von J-131) oder α-Strahlenexposition (Inkorporation von Plutonium) sind dosisabhängige Genexpressionsänderungen im Tumorgewebe (Schilddrüse) sowie im Blut strahlenexponierter Personen nachweisbar.
- Strahleninduzierte Genexpressionsänderungen sind auch schon in histologisch normalen Geweben nachweisbar.
- Ein Teil der strahleninduzierten Gene ist zudem signifikant z. B. mit atherosklerotischen Prozessen assoziiert.
Der Nachweis von Gen-Dosisbeziehungen über Jahrzehnte nach Bestrahlung kann als ein Indiz für eine kausale Beziehung gedeutet werden („Bradford Hill criteria for causation“) – ein Beweis ist er indes nicht. Interessanterweise fanden wir nach unterschiedlichen Expositionen zu ca. 30 % die gleichen Gene oder Gengruppen sowohl im Schilddrüsengewebe (Chernobyl-Projekt) als auch im Blut (Majak-Projekt) dosisabhängig dereguliert. Das periphere Blut könnte demnach als ein Kommunikations-Medium verstanden werden, das Änderungen biologischer Prozesse an verschiedenen Körperregionen reflektiert. Die Genexpressionsänderungen wurden bei jedem Exponierten zu anderen Zeiten nach Bestrahlung bestimmt und überspannen einen Zeitraum bis zu 3 Jahrzehnten nach Bestrahlung. Das wird von uns als Hinweis auf persistierende Änderungen der Genexpression interpretiert. Epigenetische Modifikationen, wie in der Einleitung beschrieben, könnten den zugrundeliegenden Mechanismus darstellen.
Wir konnten ferner i. R. des Chernobyl-Projekts eine dosisabhängige Genexpressionsänderung im histologisch normalen Gewebe nachweisen. Ob dies als diagnostisches Kriterium für später auftretende Tumore einsetzbar ist, müssen zukünftige Untersuchungen zeigen. Zumindest stehen unsere Beobachtungen im Einklang mit der Vorstellung eines Mehrstufenprozesses bis hin zur Ausbildung eines Tumors.
Neben chronischen Erkrankungen wie dem Auftreten von Tumoren war es möglich, i. R. des Majak-Projekts auch andere chronische Erkrankungen wie das Auftreten von Atherosklerose zu untersuchen. Aus epidemiologischen Studien an derselben Kohorte [6, 7], aber auch basierend auf klinisch-experimentellen Ergebnissen [8], wurde bereits ein strahleninduziert erhöhtes Atherosklerose-Risiko abgeleitet. Darüber hinaus geben unsere Studien jedoch einen Hinweis auf die zugrundeliegenden strahleninduzierten Gene und deren Beteiligung bei niedrigen, aber chronischen Strahlenexpositionen. Das kann die Basis für eine zukünftige „gene target“ Therapie, z. B. via small interface RNA (siRNA), darstellen. Zuvor müssen jedoch die gefundenen Assoziationen an größeren strahlenexponierten Kollektiven validiert werden – der nächste Schritt.
Unsere Untersuchungen sind in vielerlei Hinsicht limitiert (Fallzahl, Unsicherheiten in der Dosisabschätzung; für Details siehe [3, 4]). Basierend auf unseren Gesamt-Genom-Screeningverfahren sind nach Bestrahlung mehrere hundert Gene wie Schalter neu eingestellt und arretiert. Aus Kostengründen wurden jedoch nicht mehr als 95 Gene mittels qRT-PCR validiert. Um ein vollständiges Bild strahleninduzierter Änderungen und deren gesundheitlicher Auswirkungen zu erhalten, muss diese methodische Limitierung überwunden werden. Das ist mit gerade neu entwickelten „high-throughput“ qRT-PCR-Verfahren nunmehr kostengünstig möglich.
Schlussfolgerung
Unter Verwendung verschiedener Methoden, verschiedener Materialien und der Untersuchung verschiedener strahlenexponierter Kohorten konnten Gene identifiziert werden, die eine signifikante dosisabhängige Änderung ihrer Genexpression in Zellen aufwiesen, die keine zusätzliche akzidentelle Strahlenexposition erhalten haben. Wir interpretieren das als einen Hinweis auf eine Art „Erinnerung/Widerhall“ an eine z. T. Jahrzehnte zurückliegende Strahlenexposition, die von einer zur anderen Zellgeneration weitergegeben wird. Zum Teil sind diese Genexpressionsänderungen mit dem Auftreten chronischer Erkrankungen signifikant assoziiert, die bereits i. R. anderer Expositionsszenare beschrieben wurden. Erstmalig konnten indes persistierende strahleninduzierte Gene identifiziert werden, die vermutlich kausal als „intermediate“ zwischen der Exposition und dem Auftreten eines Effekts einzuordnen sind. Trifft dies zu, dann schaffen diese Untersuchungen die Basis für eine neuartige Diagnostik (WDB) und neue therapeutische („gene target“) Ansätze.
Kooperationspartner:
Die vorgestellten Projekte wurden in Zusammenarbeit mit folgenden Institutionen und Kooperationspartnern durchgeführt:
Chernobyl-Projekt: (1) Biostatistics Branch, Division of Cancer Epidemiology and Genetics, NCI, Bethesda, Maryland USA: RM. Pfeiffer; (2) Radiation Epidemiology Branch, Division of Cancer Epidemiology and Genetics, NCI, Bethesda, Maryland USA: AV. Brenner, M. Hatch, K. Mabuchi; (3) State Institution “V.P. Komissarenko Institute of Endocrinology and Metabolism of Academy of Medical Sciences of Ukraine”, Kiev, Ukraine: TI. Bogdanova, MD. Tronko; (4) Bundeswehr Institute of Radiobiology, Munich, Germany: C. Ruf, J. Hartmann.
Majak-Projekt: (1) Southern Urals Biophysics Institute (SUBI), Russian Federation: T. Azizova, G. Rusinova, I. Glazkova, N. Vyazovskaya (2) Research Unit of Radiation Cytogenetics, Integrative Biology Group, Helmholtz Center, Munich, Germany: D. Schmidl, K. Unger; (3) Bundeswehr Medical Office, Department F, CBRN Med Defence, Munich, Germany: H. Kreppel; (4) Bundeswehr Institute of Radiobiology affiliated to the University of Ulm, Munich, Germany: K. Müller, H. Dörr, S. Senf.
Literatur
- Samet JM: Epidemiologic studies of ionizing radiation and cancer: past successes and future challenges. Environ Health Perspect 1997; 105: 883-889.
- Craig JM, Wong NC: Epigenetics. A reference manual. Caister Academic Press, Norfolk, UK, 2011.
- Abend M, Pfeiffer RM, Ruf C, Hatch M, Bogdanova TI, Tronko MD et al.: Iodine-131 dose dependent gene expression in thyroid cancers and corresponding normal tissues following the chernobyl accident. PLoS One. 2012; 7(7): e39103.
- Abend M, Pfeiffer RM, Ruf C, Hatch M, Bogdanova TI, Tronko MD et al.: Iodine-131 dose dependent gene expression: alterations in both normal and tumor thyroid tissues of post- Chernobyl thyroid cancers. Br J Cancer 2013; 574:1-9.
- Abend M, Azizova T, Müller K, Dörr H, Senf S, Kreppel H et al. Gene expression analysis in Mayak workers with occupational prolonged radiation exposure. Health Physics, in press.
- Azizova TV, Muirhead CR, Moseeva MB, Grigoryeva ES, Vlasenko EV, Hunter N, et al.: Ischemic heart disease in nuclear workers first employed at the Mayak PA in 1948 - 1972. Health Phys 2012; 103(1): 3-14.
- Azizova TV, Muirhead CR, Druzhinina MB, Grigoryeva ES, Vlasenko EV, Sumina MV, et al.: Cerebrovascular diseases in the cohort of workers first employed at Mayak PA in 1948-1958. Radiat Res 2010; 174(6): 851-64.
- Li M, Jendrossek V, Belka C. The role of PDGF in radiation oncology. Rad Oncol 2007; 2: 1-9.
Datum: 17.07.2014
Quelle: Wehrmedizinische Monatsschrift 2014/5