Pterygium – ein zunehmendes Gesundheitsproblem für Soldaten?
Pterygium- a common opthalmic disease for soldiers?
Aus der Abteilung Augenheilkunde (Leitender Arzt: Flottenarzt Prof. Dr. med. H. Gümbel des Bundeswehrkrankenhauses Ulm (Chefarzt: Generalarzt Dr. med. A. Kalinowski)
Nicole Pettke
WMM, 59. Jahrgang (Ausgabe 4/2015; S. 129-131)
Zusammenfassung
Das Pterygium ist ein UV-Licht induziertes ophthalmologisches Erkrankungsbild, das auch in Deutschland zunehmend häufiger auftritt.
Wichtige Risikofaktoren sind, neben der chronischen Sonnenlichtexposition bzw. der zunehmenden Nähe des Wohnortes zum Äquator, Berufe mit einer langjährigen Tätigkeit im Freien, steigendes Lebensalter und männliches Geschlecht. Um ein Pterygium-Rezidiv zu verhindern, sind sowohl die optimale chirurgische Strategie (Exzision und Deckung mit freiem Bindehaut(-limbus)-transplantat), die konsequente Therapie mit Steroiden und konservierungsmittelfreien Tränenersatzmitteln als auch die langfristige UV-Protektion von großer Bedeutung.
Schlüsselwörter: Pterygium, chronische UV-Belastung, Rezidivrate, Pterygiumchirurgie, Mitomycin C, UV-Schutz
Summary
A pterygium is a common UV-induced opthalmic disease with an increasing prevalence in Germany. In addition to the latitude of residence, risk factors include years of working outdoors, increasing age an male gender.
To prevent the risk of recurrence it is very important to use the optimal surgical strategy (free conjunctivo (-limbal) autograft transplantation technique), postoperativ topical therapy with steroids, artificial tear substitutes without preservatives, and long-term UV-protection.
Keywords: pterygium, chronic UV exposure, recurrence rate, Mitomycin C, UV protection
Einführung
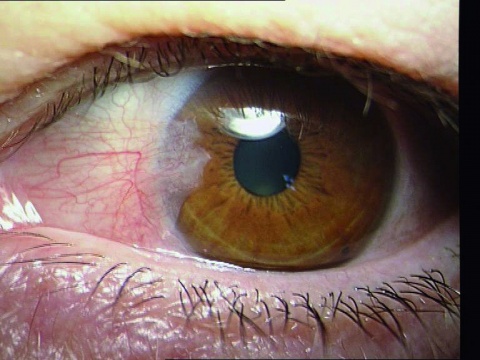
Ein Pterygium ist ein fokales Einwachsen der Bindehaut auf die Hornhaut. Seinen Namen erhielt es aufgrund seiner flügelartigen Form (Abbildung 1); das Wort “Pterygium“ kommt vom griechischen Wort “pterygos“, was übersetzt Flügel heißt. Im deutschen Sprachgebrauch wird das Pterygium deshalb auch Flügelfell genannt [14, 29].
Ein vermehrtes Auftreten wird in tropischen und subtropischen Ländern, 30° bis 40° nördlich und südlich des Äquators, im sogenannten Pterygiumgürtel, sowie in der Arktis beobachtet [3, 8, 11, 30]. Es wird von Prävalenzwerten von 0,7 % (in Nordeuropa) bis 33 % (Südchina) berichtet [24, 32]. Mit zunehmendem Abstand zum Äquator reduziert sich die Prävalenz der jeweiligen Population für diese Erkrankung [3, 17].
Die Ätiologie des Pterygiums ist noch nicht ausreichend geklärt. Als wesentlicher pathogenetischer Faktor wird die chronische Exposition gegenüber UV-Strahlung und intensivem sichtbaren Licht vermutet. Auch Umwelteinflüsse wie Staub, Wind und trockene Hitze sowie der Einfluss von Mikrotraumen werden diskutiert [2, 3, 5, 9, 12, 21, 29]. Weitere wichtige Risikofaktoren sind der Lebensstil, die Ausübung von Tätigkeiten im Freien, der Wohnort, der vom Patienten ausgeübte Beruf, das männliche Geschlecht und das steigende Lebensalter [2, 3, 21, 29]. Zu den typischen Berufsgruppen, die diesen erhöhten Gefahren ausgesetzt sind, gehören unter anderem Landwirte, Förster, Seeleute, Fischer und Maurer, da sie viel im Freien arbeiten und pathogenetisch relevanten Einflüssen ausgesetzt sind [20, 15, 22].
Demnach kann auch der Soldatenberuf zu diesen Risikogruppen gezählt werden, wobei ein besonderes Augenmerk darauf gelegt werden muss, dass in Zeiten zunehmender Auslandseinsätze in mediterranen, subtropischen und tropischen Breiten eine signifikant höhere UV-Strahlungsbelastung für die Soldatinnen/Soldaten besteht. Als Konsequenz daraus sollte eine ausführliche Aufklärung der Truppe über die Notwendigkeit des Schutzes vor starker UV-Strahlung mittels adäquater Sonnenbrillen mit Seitenschutz und das Tragen von Kopfbedeckungen erfolgen.
Historie
Die Geschichte des Pterygiums und dessen Behandlung umfasst einen Zeitraum von mehr als 3 000 Jahren. Berühmte Ärzte wie unter anderem Susruta (1000 v. Chr.), Hippocrates (469 v. Chr.), Celso (50 n. Chr.) und Galeno (131 n. Chr.) gaben bereits in ihrer Zeit eine präzise Beschreibung des Pterygiums und Empfehlungen zu dessen Behandlung an. Sie setzten für die heutige Zeit allerdings eher ungewöhnliche Behandlungsmethoden, wie das Einstreuen von Salz oder Augentropfen, die Eisen, Essig, Gallensäfte, Urin oder Muttermilch enthielten, ein.
Bereits in dieser Zeit wurde das Entfernen des Pterygiums durch Avulsion mit einem scharfen Hacken oder einer Zange beschrieben. Im 19ten Jahrhundert wurde die Bedeutung der weiteren chirurgischen Behandlung des Pterygiums erkannt. Arlt demonstrierte schließlich 1850 die Notwenigkeit einer Deckung des Bindehautdefektes im Sklerabereich nach der chirurgischen Entfernung des Pterygiums. Auch wurde die Häufigkeit der Rezidive durch die damaligen Ärzte berücksichtigt. Damit konnte der Grundstein für die Pterygiumbehandlung gelegt werden [10, 18, 25].
Klinik
Symptome
Die Ausprägung der Symptome ist direkt proportional zum klinischen Bild. Es wird von Irritationen, Rötungen, Lichtscheue (Photophobie), Brennen, Fremdkörpergefühl und kosmetischen Beeinträchtigungen berichtet. Die Invasion des Pterygiumgewebes auf die Hornhaut kann durch Zugkräfte, die dabei auf die Hornhaut einwirken, einen messbaren Astigmatismus (Stabsichtigkeit) verursachen. Dieser kann sich verschlimmern und unter Umständen auch durch eine Brille nicht vollständig korrigiert werden. Folglich kommt es zu Sehverminderung und Verzerrtsehen [17].
Diagnostik
Die Diagnose eines Pterygiums wird bei einer ophthalmologischen Untersuchung an der Spaltlampe gestellt. Bei dieser wird besonders das Ausmaß der Bindehautwucherung berücksichtigt. Die Ausdehnung des Pterygiums kann an der Spaltlampe sowohl horizontal als auch vertikal ausgemessen werden. Anhand des Grades der Gefäßdilatation im Gewebe, bezogen auf den Kopf und die Basis des Pterygiums, kann die Aktivität bestimmt werden. Eine Keratometrie, eine Visusbestimmung und eine Fotodokumentation sollten zudem erfolgen, um eine mögliche Progredienz dokumentieren zu können [16].
Um eine genaue Diagnose stellen zu können, ist die Differenzierung zu anderen ähnlichen Erkrankungen wichtig. Zu den wichtigsten Differentialdiagosen zählen das Pinguecula (Vorwachsen der Bindehaut bis an die Hornhaut) und maligne limbale Tumore. Die klinische Unterscheidung kann oft schwierig sein, weshalb die histologische Diagnosesicherung nach Pterygiumentfernung indiziert ist [28].
Therapie
Die chirurgische Entfernung ist die primäre und effizienteste Behandlung des Pterygiums. Die Indikation zur Operation ist sowohl von klinischem Bild und subjektiven Beschwerden als auch von den vorhandenen Risikofaktoren abhängig [3, 18, 21, 26]. Als eine absolute Indikation zur Operation gilt eine Visusminderung bzw. die Zunahme eines Astigmatismus [16, 18, 27].
Gegenwärtig gibt es immer noch Unstimmigkeiten und Diskussionen hinsichtlich einer eindeutigen und ausschließlichen Empfehlung zur optimalen Behandlung von Pterygien [3, 7, 26]. Ein operatives Vorgehen der Wahl, einen sogenannten Goldstandard, gibt es bei der Behandlung von primären oder rezidivierenden Pterygien bislang nicht [3, 7, 18, 26]. Bei der einfachen chirurgischen Entfernung, bei der das Pterygium mit der anschließenden Bindehaut bis auf die Sklera abgetragen wird (Bare-Sklera-Technik), ist das Rezidiv die Hauptkomplikation [2, 18]. In der Literatur sind für diese Technik Rezidivraten von 14 bis 89 % beschrieben [1, 3, 18, 21]. Aus diesem Grunde gilt heute die alleinige Anwendung der Bare-Sklera-Technik als obsolet [3, 31].
Um die sehr hohe postoperative Rezidivrate zu reduzieren, wurden in den letzten Jahren viele Operationstechniken und postoperative Behandlungsformen entwickelt. Zu diesen unterschiedlichen Methoden zählen die Defektdeckung mittels freiem Bindehauttransplantat, freiem Bindehaut-Limbus-Transplant, einem Bindehautschwenklappen oder einer Amnionmembran und/oder die intraoperative Behandlung mit Chemotherapeutika wie Mitomycin C [3, 18, 23, 31].
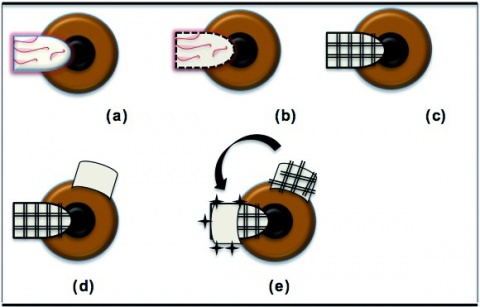
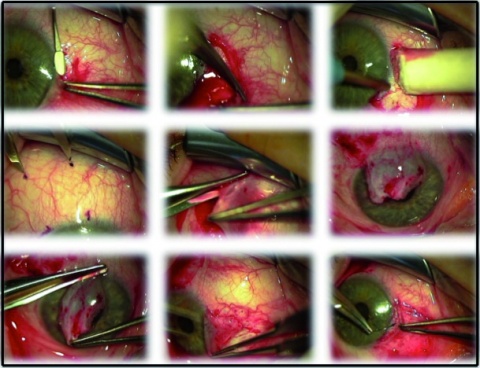
Im klinischen Alltag werden heute zur chirurgischen Behandlung des Pterygiums vorrangig die Bare-Sklera-Technik in Kombination mit einer Defektdeckung mittels freiem Bindehaut- bzw. freiem Bindehaut-Limbus-Transplantat (Abb. 2 und Abb. 3) angewandt. Gegebenenfalls kann zusätzliche eine intraoperative Applikation von Mitomycin C 0,02 % erfolgen. Zudem wird die Adaption des Transplantates mit Fibrinkleber statt mit Nähten diskutiert [34, 13, 26, 31].
Einen neuen Therapieansatz in der Rezidivprophylaxe des Pterygiums stellt die antiangiogene Therapie durch subkonjunktivale Applikation von Bevazicumab (Avastin®) dar. In einer in diesem Jahr erschienen Meta-Analyse zur Therapie mit Bevacizumab (VEGF –“vascular endothelial growth factor“-Antikörper) zeigte sich noch kein statistisch signifikanter Effekt bezüglich der Prävention von Pterygiumrezidiven. Allerdings ist die Wirksamkeit dieses Therapieansatzes noch in prospektiven, randomisierten Studien mit einer größeren Fallzahl zu untersuchen [19]. Anzumerken ist auch der Off-Label-Charakter dieser Therapiemethode, worüber die Patienten in jedem Fall aufzuklären sind [16].
Postoperativ ist eine konsequente antientzündliche Therapie mit Steroiden kombiniert mit einem Antibiotikum bis zum Epithelschluss (z. B. Dexamytrex® AS 3-5x täglich) empfohlen. Anschließend sollte mit konservierungsmittelfreien Steroiden (z. B. Dexa EDO® AT 5x täglich) sowie Tränenersatzmittel 5x täglich weiterbehandelt werden. Während der topischen Steroidgabe sind Augendruckkontrollen beim Augenarzt wichtig.
Ein weiterer wichtiger Punkt, um ein Pterygium bzw. ein Rezidiv zu vermeiden, ist der konsequente Schutz vor UV-Strahlung durch Sonnenbrillen und Sonnenhüte [16].
Fazit/Folgerung
Das Pterygium stellt in Deutschland ein zunehmend wichtiges Erkrankungsbild innerhalb der Augenheilkunde dar. Zwar ist die Exposition gegenüber UV-Strahlung in Zentraleuropa, bedingt durch einen schrägen Einfallswinkel der Sonnenstrahlen, verhältnismäßig gering, dennoch sind ungefähr 1,6 Millionen Menschen in Deutschland von Pterygien betroffen [3, 26].
Das regelmäßige Tragen von adäquatem Sonnenschutz, in Form von Sonnenbrille und Kopfbedeckung, besitzt eine nachgewiesene protektive Wirkung und wird als günstige und unkomplizierte Prophylaxe empfohlen. Die Soldatinnen/Soldaten sind hierüber aufzuklären.
Literatur
- Akinci A., Zilelioglu O. 2007. Comparison of limbal-conjunctival autograft and intraoperative 0.02% mitomycin-C for treatment of primary pterygium. Int. Ophthalmol., 27(5): 281-285.
- Altiparmak U.E., Katircio(lu Y.A., Ya(ci R., Yalniz Z., Duman S. 2007. Mitomycin C and conjunctival autograft for recurrent pterygium. Int. Ophthalmol., 27(6): 339-343.
- Ang L.P., Chua J.L., Tan D.T. 2007. Current concepts and techniques in pterygium treatment. Curr. Opin. Ophthalmol., 18(4): 308-313.
- Biswas M.C., Shaw C., Mandal R., Islam M.N., Chakroborty M. 2007. Treatment of pterygium with conjunctival limbal autograft and mitomycin C – A comparative study. Indian Med. Assoc., 105(4): 200, 202, 204.
- Bradley J.C, Yang W., Bradley R.H., Reid T.W., Schwab I.R. 2010. The science of pterygium. Br. J. Ophthalmol., 94(7): 815-820.
- Buratto L., Phillips R., Carito G. Hrsg. 2000a. Clinical picture and classifica- tion. In: Bond J.H., Pterygium Surgery, Teil A. Thorofare, New Jersey: SLACK Incorporated, 21-25.
- Buratto L., Phillips R., Carito G. Hrsg. 2000g. Treatment of pterygium. In: Bond J.H., Pterygium Surgery, Teil A. Thorofare, New Jersey: SLACK Incorporated, 37-42.
- Cameron M.E. 1983. Histology of pterygium: an electron microscopic study. Br. J. Ophthalmol., 67(9): 604-608.
- Chui J., Di Girolamo N., Wakefield D., Coroneo M.T. 2008. The pathogenesis of pterygium: current concepts and their therapeutic implications. Ocul. Surf., 6(1): 24-43.
- Cionni R.J., Watanabe T.M. Hrsg. 2000. Historical background. In: John H. Bond, Pterygium Surgery, Teil A. Thorofare, New Jersey: SLACK Incor- porated, 5-6.
- Coroneo M.T. 1993. Pterygium as an early indicator of ultraviolet insolation: a hypothesis. Br. J. Ophthalmol., 77(11): 734-739.
- Di Girolamo N., Chui J., Coroneo M.T., Wakefield D. 2004. Pathogenesis of pterygia: role of cytokines, growth factors and matrix metalloproteinases. Prog. Retin. Eye Res., 23(2): 195-228.
- Donaldson K.E., Alfonso E.C. 2003. Recent advances in pterygium excision, Contemporary Ophthalmology, 2( 25): 1-8.
- Droutsas K., Sekundo W. 2010. Epidemiologie des Pterygiums – Eine Übersicht. Ophthalmologe, 107(6): 511-512,514-516.
- Gazzard G., Saw S.M.; Farook M., Koh D., Widjaja D., Chia S.E., Hong C.Y., Tan D.T. 2002. Pterygium in Indonesia: prevalence severity and risk factors. Br. J. Opthalmol., 86(12): 1341-1346.
- Heindl L.M., Cursiefen C. 2010. Pterygium – Ätiologie, Klinik und neue adju- vante Therapien. Ophthalmologe, 107(6):517-20, 522-524.
- Hirst L.W. Hrsg. 2000. Distribution, risk factors and epidemiology of pterygi- um. In: Taylor H.R., Pterygium, Kapitel 2. Hague, Niederlande: Kugler Publications,15-27.
- Hirst L.W. 2003. The treatment of pterygium. Surv. Ophthalmol., 48(2): 145-180.
- Hu Q., Qiao Y., Nie X., Cheng X., Ma Y. 2014. Bevacizumab in the treatment of pterygium: a meta-analysis, Cornea, 33(2):154-60.
- Khoo J., Saw S.M., Banerjee K., Chia S.E., Tan D. 1998. Outdoor work and the risk of pterygia: a case-control study. Int. Ophthalmol., 22(5):293-8.
- Küçükerdönmez C., Akova Y.A., Altinörs D.D. 2007. Comparison of conjunc- tival autograft with amniotic membrane transplantation for pterygium surgery: surgical and cosmetic outcome. Cornea, 26(4):407-13.
- Mackenzie F.D., Hirst L.W., Battistutta D., Green A. 1992. Risk analysis in the development of pterygia. Ophthalmology, 99(7):1056-61.
- Müller S., Stahn J., Schmitz K., Behrens-Baumann W. 2007. Rezidivraten nach Pterygiumoperation mit Bindehautschwenklappen vs. Freies autologes Transplantat. Ophthalmologe,104(6): 480-3.
- Norn M.S. 1979. Prevalence of pinguecula in Greenland and in Copenhagen, and its relation to pterygium and spheroid degeneration. Acta Ophthalmol., 57(1):96-105.
- Rosenthal J.W. 1953. Chronology of pterygium therapy. Am. J. Ophthalmol., 36(11):1601-16.
- Sekundo W. 2010. Pterygium. Ophthalmologe, 107(6):509.
- Soriano J.M., Janknecht P., Witschel H. 1993. Effect of pterygium operation on preoperative astigmatism. Prospective study. Ophthalmologe, 90(6):688-90.
- Sridhar M.S., Rao G.N. Hrsg. 2000. Different diagnosis and indications for treatment. In: Taylor H.R., Pterygium, Kapitel 6. Hague, Niederlande: Kugler Publications, 71-82.
- Taylor H.R. 2000. A historical perspective of pterygium. In: Taylor H.R., Pterygium, Kapitel 1. Hague, Niederlande: Kugler Publications, 3-13.
- Taylor H.R., West S., Muñoz B., Rosenthal F.S., Bressler S.B., Bressler N.M. 1992.The long-term effects of visible light on the eye. Arch. Ophthalmol., 110(1):99-104.
- Walkow T., Daniel J., Meyer C.H., Rodrigues E.B., Mennel S. 2005. Long- Term results after Bare Sclera Pterygium resection with excimer smoothing and local application of Mitomycin C. Cornea, 24(4):378-81.
- Wu K., He M., Xu J., Li S. 2002. Pterygium in aged population in Doumen County, China. Yan Ke Xue Bao, 18(3):181-4.
Bildquellen:
Abb. 1 und 3: Universitätsaugenklinik der Paracelsus Medizinischen Privatuniversität Salzburg - Archiv Augenheilkunde, eigene Patienten
Abb. 2: N. Pettke (erstellt mit Microsoft Word XP®)
Datum: 28.04.2015
Quelle: Wehrmedizinische Monatsschrift 2015/4