LIPIDRESCUE™ - ERFOLGREICHER EINSATZ NACH ROPIVACAIN-BEDINGTER LOKALANÄSTHTETIKA-INTOXIKATION BEI AXILLIÄREN PLEXUSANÄSTHESIE
LipidRescue™ - successful use after ropivacaine-related local anaesthetic toxicity in axillary plexus blockade
Aus der Abteilung Anästhesie (Ärztlicher Direktor: Oberstarzt Dr. H. Lischke) des Bundeswehrzentralkrankenhauses Koblenz (Chefarzt: Generalarzt Dr. M. Zallet)
Herbert Plümer, Sebastian Fischer und Michael Braun
WMM, 58. Jahrgang (Ausgabe 6/2014, S. 192-197)
Zusammenfassung
Bei lebensbedrohlichen Anzeichen einer Lokalanästhetika-Intoxikation wie plötzlichem Bewusstseinsverlust mit oder ohne generalisierten Krampfanfall muss umgehend gehandelt werden. Die Lokalanästhetika-Injektion soll sofort gestoppt werden, gefolgt von einer umgehenden Sicherung der Atemwege mit adäquater Sauerstoffversorgung.
Die Gabe von Antikonvulsiva wird empfohlen. Nach kardiovaskulären Symptomen muss gefahndet werden. Im Falle eines Herzkreislaufstillstandes hat die sofortige leitliniengerechte Reanimation zu erfolgen. Die Reanimationsbemühungen müssen stets über einen längeren Zeitraum fortgesetzt werden. Die Anwendung einer Lipidemulsion sowie der Einsatz der Herz-Lungenmaschine müssen in Betracht gezogen werden. Wenn Lipidemulsionen verfügbar sind, sollte die rasche Applikation eines Lipid-Bolus (1,5 ml/kgKG Lipidlösung 20 %) durchgeführt werden, gefolgt von einer definierten kontinuierlichen Infusion. Eine eindeutige Handlungsempfehlung sollte vorhanden und zugänglich sein.
Schlüsselwörter: Intoxikation, Lokalanästhetika, Krampfanfall, Reanimation, SOP
Summary
Life-threatening signs of local anaesthetic toxicity, such as sudden loss of consciousness, with or without tonic-clonic convulsions need to be treated immediately by stopping the injection, securing and maintaining the airway and providing adequate oxygenation. Anticonvulsants are recommended. The cardiovascular status must be assessed. In the event of a cardiac arrest, cardiopulmonary resuscitation in accordance with standard protocols must be initiated without delay. It is important to remember that prolonged resuscitation may be necessary. The use of lipid emulsion and a cardiopulmonary bypass may be considered. If lipid is administered, a bolus dose of 1.5 ml/kg (lipid emulsion 20 %) followed by a defined continuous infusion may be appropriate. A precise standing operating procedure should be established and available.
Keywords: Intoxication, Local Anaesthetics, Seizure, Resuscitation, SOP
Einleitung
Die Intoxikation mit Lokalanästhetika (LA) ist trotz des weitverbreiteten Einsatzes der Substanzen eine sehr seltene Komplikation [1, 2]. Die Inzidenz beträgt bei peripheren Nervenblockaden 0,075 bis 0,20 % [3]. Allerdings sind die Folgen im Einzelfall gravierend und mit enormen potentiellen Schädigungen bis zum Tod des Patienten verbunden [4]. Bei den Blockadetechniken an der oberen Extremität stellt die axilläre Plexusanästhesie das sicherste Regionalverfahren dar [5].
Als Ursache für die systemische Intoxikation wird einerseits die akzidentelle intravasale Injektion mit rasch einsetzender Symptomatik und andererseits ein resorptionsbedingter Anstieg des Plasmaspiegels bei größeren Gewebedosen mit verzögerter Symptomatik nach 20-30 Minuten unterschieden [3].
Dank verbesserten Erkenntnissen zur Pathophysiologie von LA und erfolgversprechenden tierexperimentellen Untersuchungen mehren sich in den letzten Jahren klinische Fallberichte über den erfolgreichen Einsatz von Lipidlösungen als zusätzliche Therapieoption bei der LA-Intoxikation. Die anästhesiologischen Fachgesellschaften in den USA, Großbritannien und Deutschland haben diesen Sachverhalt in ihre jüngsten Empfehlungen aufgenommen und publiziert [6-8].
Nachfolgend beschreiben wir den Fall einer Patientin, die während der Anlage einer axillären Plexusblockade eine schwerwiegende systemische LA-Intoxikation erlitt. Ziel dieser Abhandlung ist es, anhand des nachfolgenden Fallberichtes über die Notwendigkeit eines definierten Sicherheitsstandards bei der Durchführung von Regionalanästhesien zu sensibilisieren, Symptome der LA-Intoxikation zu erkennen sowie therapeutische Konzepte sicher und ohne Zeitverzögerung anzuwenden. Mögliche Fallstricke bei ungewohnter Medikamentenapplikation werden angesprochen und können durch eine klare, eindeutige Handlungsempfehlung (SOP) vermieden werden.
Fallbericht - „Ich glaub, ich tret´ jetzt ab … “
Eine 47 jährige, 90 kg schwere Patientin stellte sich zur ambulanten Wundrevision des DIII der linken Hand in Plexusanästhesie vor. Die Patientin wurde aufgrund eines anamnestischen Carotistraumas mit passagerer neurologischer Symptomatik in 2001 und des bestehenden Übergewichtes nach der American Society of Anesthesia (ASA) als Risikoklasse II eingestuft. Mehrere Voroperationen in axillärer Plexusanästhesie verliefen unauffällig.
Primär wurden im Aufwachraum das Herzkreislauf-Monitoring und der venöse Zugang gemäß Klinikstandard angelegt. Die initial erhobenen Vitalparameter zeigten einen Sinusrhythmus von 62/min bei einem Blutdruck von 130/75 mmHg und 100 % Sauerstoffsättigung. Die Punktion des axillären Plexus erfolgte in Analgosedierung mit Remifentanil. Es wurde die Neurostimulationstechnik mit einer Pajunk Stimuplex Nadel 22G (50 mm) unter ständiger Aspiration angewendet. Die zu applizierende LA-Menge war mit 20 ml Ropivacain 0,75 % und 40 ml Prilocain 1 % geplant.
Aufgrund einer einmaligen Gefäßpunktion wurde die Nadel entfernt, die Punktionsstelle komprimiert und ein Oberarzt hinzugerufen. Nach anschließender Nadelkorrektur unter stetig negativem Aspirationstest konnte eine Reizantwort in den Fingerbeugern bis 0,2 mA bei 2 Hz und 0,1 ms ausgelöst werden. Es erfolgte die langsame Injektion des Ropivacains in 5 ml Schritten bei intermittierender Aspiration. Nach der Applikation von 18 ml Ropivacain 0,75 % klagte die Patientin plötzlich über Unwohlsein. Den Worten: „Ich glaub´, ich tret´ jetzt ab…“ folgte eine nur flüchtige Exzitationsphase bis zur Manifestation eines generalisierten tonisch-klonischen Krampfanfalls. Parallel wurde im Monitor-EKG das Auftreten einer monomorphen ventrikulären Tachykardie mit einer Frequenz von 165/min beobachtet. Weitere Vitalparameter konnten aufgrund des Krampfanfalls nicht abgeleitet werden. Die Injektion wurde sofort abgebrochen und das anschließende Notfallmanagement konsequent nach den Empfehlungen der deutschen Gesellschaft für Anästhesie und Intensivmedizin (DGAI) ausgerichtet. Neben der unverzüglichen Sauerstoffapplikation über Maske wurden 15 mg Midazolam fraktioniert appliziert sowie Defibrillator und Amiodaron bereitgestellt. Bedingt durch die Persistenz des generalisierten Krampfanfalls waren sowohl die manuelle als auch die automatische Pulskontrolle so stark durch Artefakte überlagert, dass ein möglicher Herzkreislaufstillstand weder bestätigt noch ausgeschlossen werden konnte. Folglich konnte eine leitliniengerechte Therapie der VT zu diesem Zeitpunkt nicht gestartet werden. Angesichts der progredienten Hypoxiezeichen entschlossen wir uns nach 90 Sekunden, die Lipidtherapie vor der antiarrhythmischen Therapie durchzuführen. 30 Sekunden nach Bolusgabe von 135 ml SMOFlipid 20 % sistierte der Krampfanfall. Die monomorphe VT konvertierte in eine Sinustachykardie mit 115/min bei nun messbarem Puls mit Blutdruckwerten von 110/60 mmHg. Die deutliche Hypoxie mit 54 % Sauerstoffsättigung war unter jetzt möglicher Maskenbeatmung rasch regredient. Nach Intubation und Starten der kontinuierlichen Lipidinfusion mit 100 ml/h via Perfusor konnten wir eine rasche Konsolidierung der kardiopulmonalen Symptomatik erreichen. Mit einem Sinusrhythmus von 90/min, Blutdruck 140/90 mmHg und 100 % Sauerstoffsättigung wurde die Patientin ohne zusätzliche antiarrhythmische Therapie und katecholaminfrei auf die Intensivstation verlegt. Im Verlauf waren keine weiteren Herzrhythmusstörungen oder neurologische Auffälligkeiten nachweisbar. Die Patientin konnte bereits 45 Minuten nach dem Ereignis extubiert und am nächsten Tag in Allgemeinanästhesie erfolgreich operiert werden.
Systemische Toxizität von LA und klinische Symptome
LA unterscheiden sich hinsichtlich ihrer Toxizität. Aufgrund ihrer Wirkkinetik sind die mittellang wirkenden Substanzen wie Mepivacain, Prilocain und Lidocain unproblematischer als die lang wirkenden lipophilen Substanzen Ropivacain, Levobupivacain und Bupivacain [9]. Die systemische Toxizität von Levobupivacain liegt experimentell zwischen der von Bupivacain und Ropivacain [10].
Mit steigenden Plasmaspiegeln der Substanzen kann es zu Störungen vor allem des zentralen Nervensystems (ZNS) und des Herz-Kreislauf-Systems kommen [11]. Zudem scheinen lipophile LA, insbesondere Bupivacain, über eine direkte Beeinflussung der oxidativen Phosphorylierung die intrazelluläre Energiegewinnung im Herzmuskel zu beeinflussen. Durch Hemmung der Karnitin-Acylkarnitin-Translokase wird der Transport von Fettsäuren in die Mitochondrien beeinträchtigt und die Atmungskette mit der lebenswichtigen Produktion von Adenosintriphosphat (ATP) entkoppelt [12].
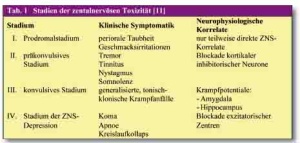
Die systemische Toxizität von LA betrifft zunächst das ZNS. Symptome wie Übelkeit, Müdigkeit, periorale Taubheit, Unruhe, Doppelbildersehen und Schwindel sind oft Prodromi von kardiovaskulären Ereignissen [13]. Die Abfolge der ZNS-Symptome kann in Stadien eingeteilt werden, die jedoch nicht zwangsläufig durchlaufen werden müssen (Tab. 1). Eine LA-Intoxikation kann sich durchaus zu Beginn als generalisierter Krampfanfall manifestieren [14 - 16].
Aufgrund der potenziellen Gefahrenlage bei LA-Blockaden durch Applikation relevanter LA-Mengen müssen grundsätzlich die in Tab. 2 genannten Vorsichtsmaßnahmen eingehalten werden [9].
Diskussion
Obwohl der Einsatz von 20 %igen Lipidemulsionen zur Therapie von LA-Intoxikationen in der Literatur inzwischen als LipidRescue™ bezeichnet wird [17], ist ihr genauer Wirkungsmechanismus bis heute nicht bekannt [18]. Derzeit werden mehrere Theorien auf der Grundlage von Weinbergs tierexperimentellen Ergebnissen diskutiert [19-21]. Am bekanntesten ist die „Lipid sink“-Theorie, in der die Extraktion lipophiler LA aus Plasma und Gewebe beschrieben wird. In der „Fat rush“-Theorie wird zudem eine Reaktivierung der durch LA inhibierten Fettsäureoxydation an Herzmuskelzellen vermutet [18].
Erste Fallberichte über den erfolgreichen klinischen Einsatz von Lipidemulsionen erschienen bereits 2006 [15, 22]. Abgesehen von einer Ausnahme finden sich im Melderegister der American Society of Regional Anesthesia (ASRA) mehr als 20 Fallberichte über den erfolgreichen Einsatz der LipidRescue™ bei LA-Intoxikationen. Darüber hinaus werden 15 Fallberichte über den Einsatz bei Intoxikationen mit verschiedenen lipophilen Psychopharmaka, Antiarrhythmika und durch Cocainmissbrauch aufgeführt [23]. Folglich wird die Therapie mit einer 20 %igen Lipidemulsion in den amerikanischen Guidelines aktuell evidenzbasiert mit Grad IIa, Klasse B empfohlen. Hingegen sollte Propofol als Lipidersatz aufgrund des zu niedrigen Fettanteils und zu hoher kardiodepressiver Effekte vermieden werden (III; C) [6].
2009 publizierte der wissenschaftliche Arbeitskreis Regionalanästhesie der DGAI seine Empfehlungen zur Lipidbehandlung (Tab. 3): Bei in aller Regel zunächst erkennbaren zentralnervösen Symptomen wie Desorientiertheit, Tremor, Verlust der Ansprechbarkeit bis hin zu tonisch klonischen Krämpfen soll die Lokalanästhetikazufuhr sofort gestoppt werden und eine umgehende Sicherstellung der Oxygenierung und der Atemwege erfolgen, um eine Hypoxie und Azidose zu vermeiden. Antikonvulsiva sollen gegeben werden. Nach kardiotoxischen Symptomen muss gefahndet werden. Im Falle eines Kreislaufstillstandes muss sofort die leitliniengerechte Reanimation erfolgen. Für die weitere möglicherweise spezifische Behandlung kann eine Lipidgabe erwogen werden. Empfehlenswert erscheint die rasche Applikation eines Bolus (1,5 ml/kgKG Lipidlösung 20 %) und eine anschließende kontinuierlichen Gabe mit 0,1-0,5 ml/kgKG/min über 30-10 Minuten (Tab. 3). Als Ultima Ratio bleibt - falls verfügbar - der Anschluss an die extrakorporale Zirkulation unter laufender Reanimation. Bedacht werden muss jedoch stets, dass die Reanimationsbemühungen über längere Zeit fortzusetzen sind [8].
Biscoping unterstreicht in diesem Zusammenhang, dass es sich bei der Lipidtherapie um eine zwar oft erfolgreiche, aber nur adjuvante Maßnahme bei lebensbedrohlichen LA-Intoxikationen handelt und selbstverständlich zuvor die Empfehlungen zur kardiopulmonalen Reanimation bei Herz-Kreislauf-Stillstand beachtet und befolgt werden müssen [24].
Trotz der Empfehlungen der Fachgesellschaften, experimenteller Daten und zahlreichen Fallberichten bestehen aber auch Zweifel über die Wirksamkeit der Lipidtherapie. So konnten die positiven Effekte aus verschiedenen experimentellen Untersuchungen nicht im Schweinemodell bestätigt werden [25, 26]. Aufgrund eines möglichen „Publikationsbias“ wird des Weiteren vermutet, dass erfolglose Behandlungsfälle nicht publiziert wurden, und dadurch eine falsch positive Datenlage suggeriert wird. Verschiedene Autoren bemängeln zudem eine vergleichsweise unzureichende Datenlage bei geringer klinischer Erfahrung [17, 27]. Daher empfiehlt der Arbeitskreis Regionalanästhesie, alle Fälle anonym dem bundesweiten Ereignis-Meldesystem unter www.Pasos-ains.de mitzuteilen. Abschließend wird auf mögliche Nachteile und Nebenwirkungen einer Lipidbehandlung hingewiesen. Die zur Behandlung einer LA-Intoxikation verabreichte Lipidmenge überschreitet die maximale empfohlene Dosis der Hersteller um das 120fache [8]. Es handelt sich bei dieser Therapieform also um einen „Off-Label-Use“, außerhalb der zugelassenen Herstellerindikationen. Eine Höchstdosis bei LipidRescue™ wurde im Gegensatz zu den Guidelines anderer Fachgesellschaften (10 - 12 ml/kgKG über 30 - 60 min) durch die DGAI nicht formuliert [6, 7].
In unserer Kasuistik müssen wir aufgrund der perakut einsetzenden Symptomatik von einer intravasalen Injektion des LA ausgehen. Der Injektion war bei der Blockadeanlage eine einmalige Gefäßpunktion vorausgegangen. Trotz Nadelkorrektur und nachfolgenden negativen Aspirationstesten ist ein druckbedingter Übertritt des Ropivacains durch die Gefäßleckage als wahrscheinliche Ursache anzunehmen.
Bei der weiteren Nachbetrachtung unseres Notfallmanagements wurden wir auf ein scheinbar diskrepantes Vorgehen zu den Empfehlungen der Fachgesellschaften und auf einige Fallstricke mit nicht unerheblichem Gefahrenpotential aufmerksam:
Wegen der Persistenz des Krampfanfalls konnte eine leitliniengerechte Therapie der VT nicht gestartet werden. Andererseits stand die zentralnervöse Symptomatik mit progredienter Hypoxie im Vordergrund. In diesem Konfliktfeld entschlossen wir uns für die vorzeitige Lipid-Bolus-Gabe. Durch das nachfolgend rasche Sistieren der zentralnervösen und kardialen Symptome konnte von der erwogenen antiarrhythmischen Behandlung abgesehen werden. Retrospektiv müssen wir von einer monomorphen VT ohne Kreislaufstillstand ausgehen, die jedoch nach den ERC-Reanimationsleitlinien primär mit Amiodaron zu behandeln gewesen wäre [28]. Aufgrund der hohen Lipophilie von Amiodaron [29] hätte in unserem Fall ein Versagen der vorgezogenen Lipidtherapie deletäre Folgen haben können. Wegen der bereits diskutierten „Lipid sink“-Theorie wäre eine Amiodaronapplikation nach Lipidgabe über einen unbestimmten Zeitraum vermutlich wirkungslos geblieben.
Darüber hinaus mussten wir konstatieren, dass die von uns berechnete kontinuierlich zu applizierende Lipidmenge fehlerhaft war. Es wurde nur ein Fünftel der empfohlenen Menge über 30 Minuten infundiert, respektive 0,02 ml/kgKG/min. Auch die von uns gewählte Applikationsform über eine Spritzenpume (Perfusor) erwies sich als ungeeignet. Die maximale Leistungsfähigkeit der in unserer Klinik eingesetzten Perfusoren beträgt 200 ml/h. Theoretisch hätte sie für das empfohlenen Zeitintervall über 30 Minuten 540 ml/h betragen müssen (Soll-Menge: 0,1 x 90 kgKG x 30 min = 270 ml in 30 Minuten). Die abteilungsinterne SOP zur LA-Intoxikation war zwar bekannt, jedoch nur über das hauseigene Computernetzwerk verfügbar. Dadurch wurde eine Kontrollberechnung der zu applizierenden Lipidmenge erschwert und nicht zeitgerecht vorgenommen.
Die Sinnhaftigkeit einer definierten, kontinuierlichen Lipidgabe über 30 Minuten belegt Marwicks Fallbericht von 2009. Er beschreibt die Wiederkehr kardiotoxischer Symptome 40 Minuten nach der initial erfolgreichen Behandlung mit 150 ml einer 20 %igen Lipidlösung [30].
Die DGAI publizierte in ihren Empfehlungen zur Lipidbehandlung insgesamt 17 tabellarische Fallberichte. In allen Fällen wurde der empfohlene Lipidbolus von 1,5 ml/kgKG appliziert. Die anschließende kontinuierliche Lipidtherapie wurde in nur 8 Fällen und in äußerst heterogener Dosierung durchgeführt [8]. Die Ursache dafür sehen wir in den unterschiedlichen Dosierempfehlungen der Fachgesellschaften, einschließlich der Empfehlung von alternativen Dosierintervallen und Mengen. Eine einheitliche Empfehlung der Fachgesellschaften wäre hier zweifelsfrei von Vorteil. Erst kürzlich wurde durch eine Marburger Arbeitsgruppe auf die Notwendigkeit einer schriftlichen SOP bei LA-Intoxikationen hingewiesen. Im Gegensatz zur Empfehlung von Dosierintervallen und Mengen, entschied sich die Arbeitsgruppe für eine eindeutige Dosierungsempfehlung, um im Notfall keine zusätzlichen Irritationen zu verursachen [31]. Auch Neal und Mitarbeiter fordern klare, eindeutige Handlungsempfehlungen, um im Notfall keine unnötigen Zeitverluste zu provozieren. Die Umsetzung der Therapieempfehlungen ist zudem deutlich verbessert, wenn solche Handlungsempfehlungen im Notfall verfügbar sind [32].
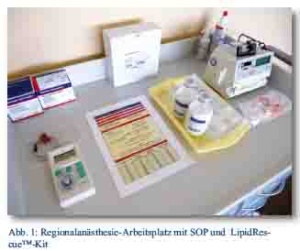
Wir können uns den Empfehlungen und der Kritik dieser Arbeitgruppen uneingeschränkt anschließen. Als Konsequenz des Ereignisses haben wir unsere SOP überarbeitet, eindeutige Dosierungen in einer gewichtsadaptierten Tabelle festgelegt und am Regionalanaesthesie-Arbeitsplatz hinterlegt (Tab. 4). Strategien zur Vermeidung möglicher Fallstricke wurden eingearbeitet und in Tab. 5 gesondert aufgeführt. Verschiedene Arbeitsgruppen empfehlen darüber hinaus die Vorhaltung eines LipidRescue™-Kits am Regionalanästhesie-Arbeitsplatz (Abb. 1).
Fazit für die Praxis
Grundsätzlich sind bei der Durchführung von Regionalanästhesien ausreichende Sicherheitsvorkehrungen zu treffen. Ein klares Behandlungsregime (SOP) sollte nach den Empfehlungen der Fachgesellschaften definiert, etabliert und am Arbeitsplatz verfügbar sein.
Für die Durchführung einer Lipidbehandlung sollten einfache, praktikable Applikationsformen und Dosierungen festgelegt sowie mögliche Fallstricke bedacht werden. Da noch vergleichsweise wenige klinische Erfahrungen zur Lipidbehandlung vorliegen, sollten alle Fälle anonym der DGAI über das Ereignis-Meldesystem unter www.Pasos-ains.de mitgeteilt werden. Picard u. Meek formulierten in diesem Zusammenhang [18]: „Fat may be bad for you, but it may just once be very good for your patient – and whether it is or not, tell us all!“
Literatur
- Corcoran W, Butterworth J, Weller RS et al. Local anesthetic-induced cardiac toxicity: a survey of contemporary practise strategies among academic anaesthesiology departments. Anesth Analg 2006; 103:1322-1326.
- Sites BD, Taenzer AH, Herrik MD et al. Incidence of Local Anesthetic Systemic Toxicity and Postoperative Neurologic Symptoms Associated With 12.668 Ultrasound-Guided Nerve Blocks: An Analysis From a Prospective Clinical Registry. Reg Anesth Pain Med 2012; 37: 478-482.
- Mulroy MF. Systemic toxicity and cardiotoxicity from local anesthetics: incidence and preventive measures. Reg Anesth Pain Med 2002; 27: 556-561.
- Di Gregorio G, Neal JM, Rosenquist RW, Weinberg GL. Clinical presentation of local anesthetic systemic toxicity: a rewiew of published cases, 1979 to 2009. Reg Anesth Pain Med 2010; 35: 181-187.
- Brown DL, Ransom DM, Hall JA et al. Regional anesthesia and local anesthetic-induced systemic toxicity: seizure frequency and accompanying cardiovascular changes. Anesth Analg 1995; 81:321-328.
- Neal JM, Bernards CM, Butterworth JF et al. ASRA Practice Advisory on Local Anesthetic Systemic Toxicity. Reg Anesth Pain Med 2010; 35: 152-161.
- The Association of Anaesthetists of Great Britain & Ireland. AAGBI Safety Guideline – Management of Severe Local Anaesthetic Toxicity. 2010. http://www.aagbi.org/publications/publications-guidelines
- Volk T, Graf BM, Gogarten W et al. Empfehlungen zur Lipidbehandlung bei der Intoxikation mit Lokalanästhetika. Anästh Intensivmed 2009; 50:698-702.
- Neuburger M, Büttner J. Komplikationen bei peripherer Regionalanästhesie. Anaesthesist 2011; 60: 1014-1026.
- Ohmura S, Kawada M, Ohta T, Yamamoto K & Kobayashi T. Systemic toxicity and resuscitation in bupivacaine-, levobupivacaine-, or ropivacaine-infused rats. Anesth Analg 2001; 93(3): 743-748.
- Zink W, Graf BM. Toxikologie der Lokalanästhetika. Pathomechanismen – Klinik – Therapie. Anaesthesist 2003; 52:1102-1123.
- Weinberg GL, Palmer JW, VadeBoncouer TR et al. Bupivacaine inhibits acylcarnitine exchange in cardiac mitochondria. Anesthesiology 2000; 92:523-528.
- Leone S, Di Cianni S, Casati A, Fanelli G. Pharmacology, toxicology, and clinical use of new long acting local anesthetics, ropivacaine and levobupivacaine. Acta Biomed 2008; 79: 92-105.
- Foxall GR, McCahon JL, Hardman JG, Bedforth NM. Levobupivacaine-induced seizers and cardiovascular collapse treated with intralipid. Anaesthesia 2007; 62: 516-518.
- Rosenblatt MA, Abel M, Fischer GW et al. Successful use of 20 % lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology 2006; 105: 217-218.
- Smith HM, Jacob AK, Segura LG et al. Simulation education in anesthesia training: a case report of bupivacaine-induced cardiac arrest linked to recent simulation training. Anesth Analg 2008; 106: 1581-1584.
- Ott K, Rossaint R, Weigand M et al. Lipidlösungen zur Therapie der Lokalanästhetikaintoxikation. Anaesthesist 2010; 59: 575-586.
- Picard J, Meek T. Lipid emulsion to treat overdose of local anaesthetic: the gift of the glob. Anaesthesia2006; 61:107-109.
- Weinberg GL, VadeBoncouer T, Ramaraju GA et al. Pretreatment or resuscitation with a lipid infusion shifts the dose–response to bupivacaine-induced asystole in rats. Anesthesiology 1998; 88: 1071-1075.
- Weinberg G, Ripper R, Feinstein DL, Hoffman W. Lipid emulsion infusion rescues dogs from bupivacaine-induced cardiac toxicity. Regional Anesthesia and Pain Medicine 2003; 28: 198-202.
- Weinberg GL, Ripper R, Murphy P et al. Lipid infusion accelerates removal of bupivacaine and recovery from bupivacaine toxicity in the isolated rat heart. Reg Anesth Pain Med 2006; 31: 296-303.
- Litz RJ, Popp M, Stehr SN, Koch T. Successful resuscitation of a patient with ropivacaine-induced asystole after axillary plexus block using lipid infusion. Anaesthesia 2006; 61: 800-1.
- Weinberg G. Resuscitation in the Peer-Reviewed Medical Literature (Cases, Commentary, Research, Reviews) http://www.lipidrescue.org (Okt. 2013)
- Mayr VD, Mitterschiffthaler L, Neurauter A et al. A comparison of the combination of epinephrine and vasopressin with lipid emulsion in a porcine model of asphyxial cardiac arrest after intravenous injection of bupivacaine. Anesth Analg. 2008; 106: 1566-1571.
- Biscoping J. Der Lokalanaesthesie-Zwischenfall. In: Refresher Course (Hrsg. DAAF) 2010; 36: 1-9.
- Hicks SD, Salcido DD, Logue ES et al. Lipid Emulsion Combined with Epinephrine and Vasopressin Does Not Improve Survival in a Swine Model of Bupivacaine-induced Cardiac Arrest. Anesthesiology 2009; 111: 138-146.
- Dagtekin O. CPR mit "lipid resuscitation" bei Lokalanästhetikaintoxikation. Anästh Intensivmed 2010; 51: 464.
- Deakin CD, Nolan JP, Soar J et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation 2010; 81: 1305-52.
- Gassanov N, Dietlein M, Caglayan E et al. Amiodaron-induzierte Schilddrüsenfunktionsstörungen. Dtsch Med Wochenschr. 2010; 135: 807-11.
- Marwick PC, Levin AI, Coetzee AR: Recurrence of cardiotoxicity after lipid rescue from bupivacaine-induced cardiac arrest. Anesth Analg 2009; 108:1344-1346.
- Wiesmann T, Bornträger A, Steinfeldt T, Wulf H. Deklaration von Helsinki zur Patientensicherheit in der Anästhesiologie – SOP zur Lokalanästhetika-Intoxikation. Anästhesiol Intensivmed Notfallmed Schmerzther 2013; 48: 32-35.
- Neal JM, Hsiung RL, Mulroy MF et al. ASRA checklist improves trainee performance during a simulated episode of local anesthetic systemic toxicity. Reg Anesth Pain Med 2011; 37: 8-15.
Bildquelle: Abb. 1: Bundeswehrzentralkrankenhaus Koblenz – Abt. X
Datum: 18.07.2014
Quelle: Wehrmedizinische Monatsschrift 2014/6