Das kutane Mikrobiom: Ausblick für neue Therapieansätze beim atopischen Ekzem
Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum Würzburg
ZUSAMMENFASSUNG
Die Sichtweise auf die Pathogenese und Therapie des atopischen Ekzems hat sich durch fortlaufend neue Erkenntnisse über das kutane Mikrobiom geändert. Untersuchungen zum Mikrobiom erkrankter Patienten bestätigten einen Anstieg von Staphylococcus aureus sowie parallel dazu die Abnahme insbesondere der gram-negativen bakteriellen Vielfalt in den betroffenen Regionen. Die Interaktion der Haut mit dem Mikrobiom hat Konsequenzen für Immunität und Toleranz des Wirts. Veränderungen der mikrobiellen Zusammensetzung können somit die Entwicklung und den Verlauf des atopischen Ekzems beeinflussen. Aus diesen aktuellen Erkenntnissen der Relevanz des Hautmikrobioms ist neben der gestörten Hautbarriere und den Entzündungsreaktionen auch das Hautmikrobiom mit in die Therapie des atopischen Ekzems einzubeziehen. Neben der anti-inflammatorischen Behandlung sollte die Therapie auch auf einen positiven Einfluss auf das Mikrobiom abzielen. Lokale oder systemische antibiotische und antiseptische Behandlungen können zwar die Kolonisationsdichte von S. aureus vermindern, verbessern jedoch nicht zwangsläufig das Mikrobiom. Interessanterweise besitzt Miconazol neben seiner antimykotischen Wirkung zusätzlich antibakterielle Eigenschaften insbesondere gegenüber S. aureus und Corynebakterien. Gram-negative Bakterien werden jedoch durch das Antimykotikum kaum beeinflusst. Eine Lokaltherapie mit Miconazol, gegebenenfalls in Kombination mit einem antientzündlichen Wirkstoff, stellt so eine interessante Alternative zur Behandlung des atopischen Ekzems dar und erweitert das Therapiespektrum anderer bakterieller Hauterkrankungen wie des Erythrasmas und unterschiedlicher Ekzemerkrankungen, die häufig mit Pilzen und Bakterien besiedelt oder infiziert sind.
Atopisches Ekzem
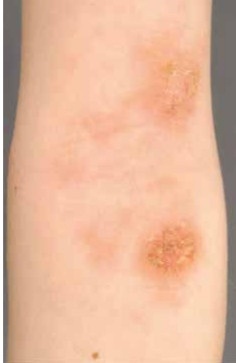
Das atopische Ekzem ist eine der häufigstenchronischrezidivierenden Erkrankungen des Kindes-und Jugendalters. In Deutschland leiden etwa 13 % der Kinder (entspricht der Lebenszeitprävalenz bis zum Alter von 17 Jahren) zumindest zeitweise unter dieser Hauterkrankung [1]. Beim atopischen Ekzem handelt es sich um eine entzündliche, nicht-kontagiöse, multifaktorielle, oft mit starkem Juckreiz einhergehende Hauterkrankung von großer medizinischer und ökonomischer Bedeutung (Abb. 1). Die genetische Prädisposition zusammen mit zahlreichen Auslösefaktoren spielt für die Manifestation der Hauterkrankung eine wichtige Rolle. Die Haut des Neurodermitis-Patienten weist ein Defizit an Ceramiden auf. Zusätzlich liegt bei 20 bis 40 % der Patienten eine Mutation im Filaggrin-Gen vor. Das Protein Filaggrin ist an der Bildung der Keratinschicht und somit der Barriere und Hydratation der Haut beteiligt. Der Verlauf des atopischen Ekzems wird durch eine Reihe von Auslösefaktoren wie Infektionen, Kontakt mit Allergenen und Irritanzien, Klima und psychische Faktoren beeinflusst. Pathophysiologisch stellt die gestörte Hautbarriere, die mit einer erhöhten Penetration von Allergenen und einem gesteigerten transepidermalen Wasserverlust einhergeht, die Grundlage für die Irritabilität und die Entzündungsneigung der Haut dar. Neben der eingeschränkten Barrierefunktion spielen die veränderte Aktivierung des angeborenen Immunsystems und die erhöhte Suszeptibilität gegenüber Staphylococcus aureus (S. aureus) eine entscheidende pathogenetische Rolle [2].Bei der Therapie der atopischen Dermatitis sind die zahlreichen Auslösefaktoren zu berücksichtigen und in einen individuellen Behandlungsplan einzupassen. Die Behandlung des atopischen Ekzems erfolgt stadienadaptiert. Die Grundlage besteht in einer regelmäßigen Basispflege, die in Abhängigkeit der Ausprägung der Entzündungsschübe durch antiinflammatorische Wirkstoffe ergänzt wird. Es kommen sowohl topische Steroide und Immunmodulatoren als auch antiseptische Wirkstoffe zum Einsatz. Die antimikrobielle Therapie besteht aus einer topischen Applikation von Antiseptika (z. B. mit Triclosan, Chlorhexidin oder Octenidin). Topische Antibiotika sollten jedoch aufgrund der befürchteten Gefahr einer Resistenzbildung und auch wegen einer Sensibilisierungsgefahr zurückhaltend eingesetzt werden. Eine Therapie mit systemischen Antibiotika wird bei Ekzemen mit ausgeprägten klinischen Zeichen einer bakteriellen Infektion empfohlen. Dabei sollten gegen S. aureus gerichtete selektive antibakterielle Schmalspektrumantibiotika wie Cephalexin oder andere Cephalosporine der ersten Generation zum Einsatz kommen [3].
Mikrobiom – Mensch: Einfluss der Interaktion auf das Immunsystem
Das humane Mikrobiom, auch Mikroflora genannt, ist die Summe aller den Körper besiedelnden Mikroorganismen im Darm, auf der Haut und anderen Lokalisationen wie dem Urogenitaltrakt. Die Diversität des Mikrobioms mit dem Vorhandensein großer Mengen verschiedener Kommensalen umfasst unterschiedliche Bakterien-, Viren-und Pilzarten. Die komplexe Gemeinschaft der Mikroorganismen beeinflusst die Physiologie und die Immunität der unterschiedlich besiedelten Organe. Interaktionen zwischen den verschiedenen Mikroorganismen untereinander und den humanen Zellen sind zum Erhalt einer Homöostase von großer Bedeutung. Bereits in der frühen Kindheit prägt die Wechselwirkung des Immunsystems mit dem Mikrobiom den späteren Verlauf von Immunreaktionen und beeinflusst die Neigung zu Allergie und Autoimmunerkrankungen. Ein funktionierendes Mikrobiom, das sich in einem Gleichgewicht befindet, ist die Voraussetzung für eine normale Entwicklung und die Erhaltung der Gesundheit. Ein Ungleichgewicht der mikrobiellen Flora zu Gunsten von Pathogenen kann Erkrankungen auslösen oder verstärken [4].
Die Haut ist das größte Organ an der Grenze zwischen Wirt und Umwelt und schützt als erste physische Barriere gegen eindringende Pathogene. Die kutane bakterielle Besiedelung beträgt bis zu 1 Milliarde Bakterien pro Quadratzentimeter und übertrifft damit bei weitem die Anzahl unserer eigenen Hautzellen. Neben einer reichlichen Anzahl an Bakterien ist der Hefepilz Malassezia spp. als führender Pilz Bestandteil der physiologischen humanen Hautflora. Eine quantitative kulturunabhängige Bestimmung bakterieller Keimbesiedlung unterschiedlicher Lokalisationen wird durch die Gensequenzierung der 16s-Untereinheit des bakteriellen Ribosoms ermöglicht.
Einerseits greifen Wirtsfaktoren wie Geschlecht, Alter, Umweltfaktoren, Hygiene und die Anwendung von verschiedenen Hautpflegeprodukten auf das Mikrobiom ein, andererseits beeinflusst das Mikrobiom die Wirtsimmunität und die Kolonisation mit pathogenen Mikroorganismen [4]. Hautbesiedelnde bakterielle Kommensalen wie Staphylococcus epidermidis sind in der Lage, sowohl ortständige dendritische Zellen und T-Lymphozyten zu aktivieren [5], um eindringende Bakterien zu bekämpfen, als auch Immuntoleranz zu induzieren [6]. Das Erkennen hoch konservierter molekularer Muster (pathogen-associated molecular patterns, PAMP) auf der zellulären Oberfläche der Mikroorganismen erfolgt durch Mustererkennungsrezeptoren (pattern-recognition receptors, PRR) des angeborenen Immunsystems. Toll-ähnliche Rezeptoren (TLR) sind eine gut charakterisierte Klasse unter den PRR. TLR-2 spielt eine besondere Rolle in der Interaktion mit gram-positiven Bakterien wie S. au-reus. Die Bindung des PAMP an den Rezeptor versursacht unter anderem in Abhängigkeit verschiedener Ko-Rezeptoren unterschiedliche Immunreaktionen. Die Rezeptorbindung kann sowohl eine Verstärkung der Entzündungsreaktion als auch eine Immunsuppression induzieren. Lipoproteine von S. aureus verursachen beispielsweise über die Freisetzung von Interleukin-6 eine Immunsuppression. Diese wiederum kann im Fall der Kolonisierung atopischer Haut zur Ausbreitung von Hautinfektionen führen und letztendlich zur Verstärkung der Entzündung. Die Interaktion von ortständigen Zellen der Haut mit dem Mikrobiom hat somit weitreichende Konsequenzen für Immunität und Toleranz. Ferner beeinflussen sich die Zusammensetzung des kutanen Mikrobioms und die Funktion der epidermalen Barriere gegenseitig. Veränderungen der mikrobiellen Zusammensetzung werden mit der Entstehung unterschiedlicher Krankheiten in Zusammenhang gebracht. Dominiert ein Bakterium oder Pilz, so kann dies auf einen pathologischen Zustand hindeuten [6].
Die Relevanz der S. aureus-Kolonisierung für die Pathogenese des atopischen Ekzems
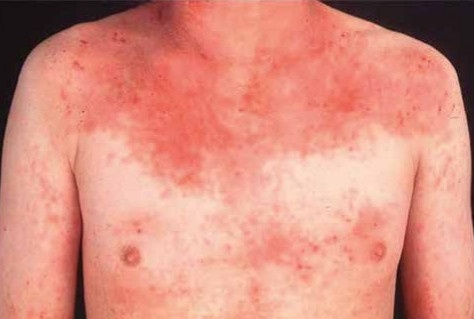
Unterschiedliche Untersuchungen und deren Ergebnisse deuten auf eine mikrobielle Beteiligung an der Pathogenese des atopischen Ekzems hin. In betroffener Haut der Patienten liegt ein verändertes Mikrobiom mit Besiedlung durch S. aureus vor [7]. Die Prävalenz der Hautbesiedelung mit S. aureus beim Vorliegen eines atopischen Ekzems zeigt im Vergleich zur gesunden Kontrollgruppe den größten Unterschied im Bereich läsionaler Haut. Entzündete Haut des atopischen Ekzems ist zu 70 % mit S. aureus kolonisiert, gefolgt von der Nasenschleimhaut (62 % Kolonisierung mit S. aureus) und nicht-läsionaler Haut (39 % Kolonisierung mit S. aureus) [8]. Aufgrund des Kratzens kann es zum Eindringen der Bakterien in tiefere Hautschichten kommen, was häufig zu nässenden, S. aureus-infizierten Ekzemen mit akuter Verschlechterung des Krankheitsbildes führt. Eine Komplikation der bakteriellen Kolonisierung durch S. aureus stellt die disseminierte Impetiginisation dar (Abb. 2).Das Vorliegen eines atopischen Ekzems wurde auch als Risikofaktor für eine Besiedlung mit Methicillin-resistenten S. aureus (MRSA) identifiziert [9]. Darum sollte das atopische Ekzem bei MRSA-Screeningprogrammen berücksichtigt werden. In Anbetracht der hohen Kolonisationsraten mit S. aureus ist das Risiko einer MRSA-Besiedelung erhöht. Atopische Haut zeigt eine andere mikrobielle Besiedlung als gesunde Haut. Insbesondere während eines Ekzemschubs verliert sich die Diversität des Mikrobioms zu Gunsten einer Dominanz von S. aureus und S. epidermidis. Diese wiederum kann zum Übergang einer bakteriellen Besiedlung zur Infektion führen und letztendlich zur Verstärkung der Entzündung. Nach erfolgreicher Therapie reduziert sich der Anteil an S. aureus und die bakterielle Diversität als Zeichen einer gesunden Haut normalisiert sich [10]. Das Ausmaß der S. aureus-Kolonisierung korreliert mit dem Schweregrad des atopischen Ekzems. Da bekannt ist, dass die Reduktion der Besiedlung mit S. aureus an den betroffenen Hautstellen eine Linderung der Entzündung bewirkt, sollte eine Therapie auf die Reduktion von S. aureus abzielen. Interessanterweise dominiert bei der atopischen Dermatitis ein S. aureus-Stamm mit einem single nucleotide-Polymorphismus im Lipase-Gen [11]. Ein spezifisches Targeting gegen S. aureus-Stämme könnten den Erfolg einer antibakteriellen Behandlung möglicherweise verbessern. Weitere Untersuchungen zum Hautmikrobiom zeigten eine geringere Besiedelung der atopischen Haut mit gram-negativen Bakterien wie Acinetobacter sowie den gram-positiven Corynebakterien spp. und Propionibacterium acnes. Insbesondere während eines Ekzemschubs verringert sich die Besiedelung mit Corynebakterien [10]. Nach einem Schub steigt die Zahl erneut an. Die Dysbiose des atopischen Ekzems beruht somit nicht nur auf der erhöhten S. aureus-Anzahl. Eine Beeinflussung des Mikrobioms als Therapieziel des atopischen Ekzems sollte somit nicht nur die Verringerung der Kolonisierung mit S. aureus, sondern auch eine Zunahme gram-negativer Bakterien berücksichtigen. Hierin liegt auch der Vorteil einer selektiven antibakteriellen Therapie mit dem Fokus auf S. aureus. In einer irischen longitudinalen Geburtenkohorte mit insgesamt 50 Kindern wurde das Mikrobiom im Bereich vier unterschiedlicher Hautareale (Ellenbeugen, Kniekehle, Nasenspitze, Wangen) zu drei verschiedenen Zeitpunkten während der ersten sechs Lebensmonate bestimmt. Im Verlauf entwickelten zehn der Kinder ein atopisches Ekzem. Im Vergleich zu den hautgesunden Kindern zeigte sich bei den Atopikern bereits im zweiten Lebensmonat eine signifikant unterschiedliche Hautbesiedlung in den Beugen. In diesem Bereich waren weniger kommensale Staphylokokken nachweisbar [12]. Möglicherweise beeinflusst ein mutiertes Filaggrin-Protein bereits in der Neugeborenenperiode das kutane Mikrobiom. Diese Daten lassen vermuten, dass eine kutane Dysbiose eine Rolle in der Initiierung eines atopischen Ekzems spielen könnte. Eventuell schützen kommensale Staphylokokken in der Neugeborenenperiode vor der Entwicklung eines atopischen Ekzems. Im Mausmodell konnte kürzlich gezeigt werden, dass eine Exposition der Haut mit kommensalen Bakterien im frühen Leben Toleranz gegenüber diesen Bakterien induziert [13]. Ob das veränderte Hautmikrobiom einen primären oder sekundären Pathogenitätsfaktor des atopischen Ekzems darstellt, ist bis zum jetzigen Zeitpunkt weiterhin unklar. Dass eine mikrobielle Dysbiose Schübe und die Ausprägung der atopischen Dermatitis beeinflusst, ist jedoch aus den aktuellen Daten zu erwarten.
Über das Potenzial eines therapeutischen Benefits durch Modulation des Mikrobioms ist bisher noch wenig bekannt. Die Idee eines kritischen Fensters im frühen Leben, in dem die Hautexposition gegenüber definierten Mikroben für die Entwicklung des Immunsystems und allergischer Erkrankungen entscheidend ist, wird durch Studien unterstützt, die eine reduzierte mikrobielle Diversität im Darm vor der Entstehung eines Asthma bronchiale zeigen [14]. Daten über den Einfluss des kutanen Mikrobioms auf die Initiierung eines atopischen Ekzems sind aktuell noch limitiert.
Eine prospektive, randomisierte, placebo-kontrollierte Studie konnte zeigen, dass eine kutane Exposition entzündeter Haut atopischer Patienten mit einem Lysat des gram-negativen, nichtpathogenen Bakteriums Vitreoscilla filiformis zur Abnahme des Juckreizes und des Krankheitsscores führte [15]. In einer aktuellen Studie wurde der Einfluss von kultivierbaren hautbesiedelnden gram-negativen Bakterien von Hautgesunden und Patienten mit atopischem Ekzem untersucht. In unterschiedlichen zellulären Modellen zeigten sich positive Effekte gram-negativer Bakterien von Hautgesunden auf die Hautbarriere, auf Mechanismen des angeborenen Immunsystems sowie auf die Kolonisierungsdichte von S. aureus. Zusätzlich konnte in einem Mausmodell der atopischen Dermatitis eine lokale Anwendung gram-negativer Bakterien von Gesunden auf der entzündlichen Haut zur Besserung der Symptome führen [16]. Interaktionen dieser therapeutisch eingesetzten Bakterien mit den Zellen der Haut, aber auch mit anderen Bakterien wie S. aureus, eröffnen ein großes Forschungsfeld mit therapeutischen Perspektiven.
Antimykotika: Eine therapeutische Alternative zu Antibiotika und Antiseptika
Aus diesen aktuellen Erkenntnissen zum Hautmikrobiom bei atopischem Ekzem ist neben der gestörten Hautbarriere und den Entzündungsreaktionen auch das Hautmikrobiom in die Therapie des atopischen Ekzems mit einzubeziehen. Lokale oder systemische, antibiotische und antiseptische Behandlungen können zwar die Kolonisationsdichte von S. aureus vermindern, verbessern jedoch nicht zwangsläufig das Mikrobiom. Somit stellt die positive Beeinflussung des kutanen Mikrobioms eine neue therapeutische Strategie dar. Da bekannt ist, dass die Reduktion der Besiedlung mit S. aureus und der Anstieg gram-negativer Bakterien an den betroffenen Hautstellen eine Linderung der Symptome bewirkt [10], werden alternative Strategien gesucht, um die „gesunde“ Diversität der entsprechenden Mikroflora wiederherzustellen.Topische antimikrobielle Behandlungen stellen eine wichtige alternative Therapieoption zur systemischen antibakteriellen Therapie, nicht nur beim infizierten atopischen Ekzem, sondern auch bei anderen impetiginisierten Ekzemen und oberflächlichen bakteriellen Infektionen dar. Im Unterschied zur systemischen Therapie liegen die Vorteile einer antimikrobiellen Lokaltherapie in einem raschen Wirkungseintritt, hohen Wirkstoffkonzentrationen und einem niedrigeren Risiko für das Auftreten systemischer Nebenwirkungen. Lokale Antibiotika sind jedoch aufgrund der Gefahr der Kontaktsensibilisierung, der verzögerten Wundheilung und Resistenzbildung kritisch zu beurteilen. Antiseptika entfalten ihre Wirkung über physikalische und chemische Destruktion der Zellwände oder Denaturierung von Proteinen. Neben ihrer schmalen therapeutischen Breite mit toxischen Effekten und Wundheilungsstörungen bei hohen Konzentrationen ist die antibakterielle Wirkung kaum selektiv und kann das kutane Mikrobiom in seiner Gesamtheit negativ beeinflussen [17]. Umso interessanter sind die In-vitro-und In-vivo-Beobachtungen antibakterieller Wirkungen gegen gram-positive Bakterien von Azol-Antimykotika wie z. B. Miconazol, ein lokal anzuwendendes Breitspektrum-Antimykotikum [18]. In einer aktuellen Untersuchung von Nenoff et al. wurde die minimale Hemmkonzentration von Miconazol auf gram-positive und gram-negative Bakterien untersucht [19]. Dabei wurde ein antibakterieller Effekt gegen gram-positive aerobe Bakterien wie S. aureus, Streptococcus spp. und Enterococcus spp. bei Konzentrationen des Azols zwischen 0,78 und 6,25 mg/ml nachgewiesen, während sich keinerlei Hemmung auf das Wachstum von gram-negativen Bakterien innerhalb einer getesteten Konzentration über 200.g/ml zeigte. Interessanterweise ergab sich kein Unterschied in der Suszeptibilität gegenüber Miconazol zwischen Methicillin-sensiblen (MSSA), Methicillin-resistenten (MRSA) und Fusidinsäure-resistenten S. aureus-Isolaten. Da das Vorliegen eines atopischen Ekzems als Risikofaktor für eine Methicillin-resistente S. aureus (MRSA)-Besiedelung identifiziert wurde [9], eröffnet die Lokaltherapie mit Miconazol eine sehr interessante Behandlungsmöglichkeit. Aber auch Corynebacterien spp., die als bakterielle Ursache des Erythrasmas angesehen werden, zeigten ein exzellentes Ansprechen auf Miconazol. Die Behandlung des Erythrasmas erfolgt schon sehr lange empirisch mit topischen Antimykotika aus der Gruppe der Imidazole. Die aktuellen In-vitro-Daten stützen die Effektivität einer Miconazol-Behandlung bei Hauterkrankungen durch Corynebakterien wie Erythrasma, bakterielle Intertrigo und Keratoma sulcatum.
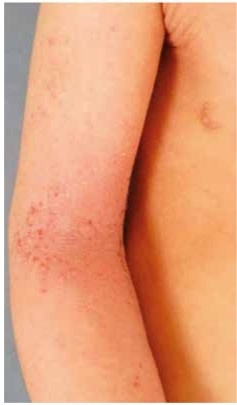
Die antimykotische Wirkung entfaltet Miconazol über die Hemmung der Lanosterol-14-Demethylase, ein essentielles Enzym zur Ergosterolsynthese. Der antibakterielle Effekt gegenüber Staphylokokken gelingt möglicherweise über ein homologes bakterielles Enzym, die 14-alpha-Sterol-Demethylase. Zusätzlich korreliert die antibakterielle Aktivität mit der Hemmung eines bakteriellen Flavohämoglobins, eines NO-entgiftenden bakteriellen Enzyms [20]. Die lokale Anwendung der Azolemit ihren kombiniertenantimikrobiellen Effekten u. a. gegen Staphylokokken, Streptokokken, Dermatophyten und Hefepilze erweitert die Therapiestrategien bei den nicht selten vorkommenden bakteriellen und mykotischen Mischinfektionen der Haut. Entscheidende Vorteile im Vergleich zu den antibakteriellen Substanzen lägen auch in der geringen Gefahr einer Resistenzentwicklung und Auslösung einer Kontaktallergie. Kombiniert mit topischen Kortikosteroiden stellt Miconazol insbesondere bei infizierten Ekzemen wie der atopischen Dermatitis eine interessante Therapieoption dar [21]. Eine Sonderform des atopischen Ekzems mit ausgeprägter Entzündungsreaktion im Bereich des Gesichts und Nackens wird als „Head-Neck-Form“ des atopischen Ekzems bezeichnet (Abb. 3). Diese schwere, oftmals therapierefraktäre Variante wird häufig durch eine IgE-Sensibilisierung gegenüber dem fakultativ pathogenen Mikroorganismus Malassezia spec. hervorgerufen. Eine Sensibilisierung gegen mikrobielle Antigene soll dafür verantwortlich sein. Bei dieser Variante des atopischen Ekzems stellt die kombinierte antimykotische und antiinflammatorische Lokaltherapie ebenfalls eine effektive Behandlungsoption dar [22].
Weitere Ekzeme wie das nummuläre Ekzem, die mit Pilzen und Bakterien besiedelt sein können, stellen in der Praxis ein häufiges therapeutisches Problem dar. Die Superinfektion kann den Verlauf der Ekzeme komplizieren. Die topische Kombinationstherapie aus Antimykotikum und Kortikosteroid kann jedoch zur raschen Wiederherstellung der defekten Hautbarriere und der Normalisierung des Hautmikrobioms führen. z
Interessenkonflikt
Die Autorin erhält ein Honorar zur Erstellung des Manuskripts von der Firma Almirall Hermal.
Literatur beim Verfasser
Bildrechte beim Verfasser
Korrespondenzadresse
Prof. Dr. Dr. Annette Kolb-Mäurer
Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie,
Universitätsklinikum Würzburg,
Josef-Schneider-Straße 2,
97080 Würzburg
[email protected]
Datum: 03.09.2018
Quelle: Wehrmedizin und Wehrpharmazie 2/2018