Gibt es einen Schwefel-Lost-Chemosensor?
Institut für Pharmakologie und Toxikologie der Bundeswehr, München
Einleitung
Im Jahre 1822 synthetisierte César-Mansuète Despretz erstmalig Schwefel-Lost (S-Lost). Fast 100 Jahre später erfolgte 1917 der erste Einsatz als chemischer Kampfstoff im Ersten Weltkrieg. Trotz allgemeiner Ächtung chemischer Kampfstoffe im Rahmen der Genfer Konventionen bleibt auch weitere 100 Jahre später die Gefahr akut, da terroristische Vereinigungen Zugriff auf den Kampfstoff besitzen und ihn bereits eingesetzt haben. Im Rahmen des laufenden Krieges in Syrien konnte die Organisation für das Verbot chemischer Waffen (OPCW) einen Einsatz von S-Lost nachweisen. So wurde der Kampfstoff zum Beispiel in Aleppo und Cobane verwendet [1].

Betrachtet man den klinischen Goldstandard der S-Lost-Therapie, so gab es innerhalb des letzten Jahrhunderts nur marginale Fortschritte. Es werden die Symptome behandelt, nicht aber die Ursachen. Nach wie vor besteht in diesem Bereich eine wehrmedizinische Fähigkeitslücke auf der Suche nach einem direkten Antidot.
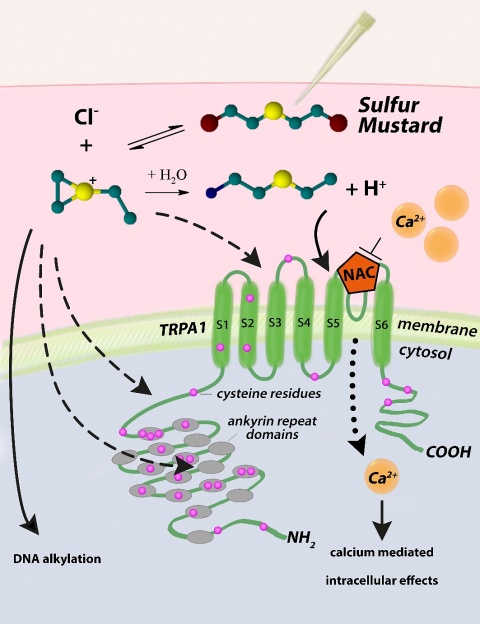
Bemerkenswerterweise besitzen chemische Kampfstoffe charakteristische Gerüche. Im Falle von S-Lost wird der Geruch als senf- oder knoblauchartig beschrieben. Die olfaktorische Wahrnehmung von Gerüchen wird durch spezielle Chemosensoren vermittelt. Eine Gruppe solcher Chemosensoren stellt die Familie der „transient receptor potential“-Ionenkanäle dar. Insbesondere der „transient receptor potential ion channel A1“ (TRPA1) konnte als entscheidend bei der Detektion von hochreaktiven
und giftigen Substanzen, einschließlich Reizstoffen, wie z. B. -Allylisothiozyanat (AITC) oder Senföl, ausgemacht werden [3].
Dies führte uns letztlich zur Hypothese, dass es einen Chemosensor für S-Lost gibt, und ferner, dass alkylierende Verbindungen, wie zum Beispiel S-Lost, in der Lage sind, TRPA1 zu aktivieren. Im Einklang zu dieser These wird TRPA1 bereits eine wichtige Rolle bei der Schmerzempfindung sowie Histamin unabhängigem Juckreiz zugesprochen – beides Symptome, welche auch nach einer S-Lost-Exposition beobachtet werden können. Eine Entschlüsselung des Pathomechanismus von S-Lost sollte eine zielgerichtete Therapie ermöglichen, weshalb im Rahmen dieser Forschungsarbeit auch entsprechende TRPA1---Antagonisten auf ihre protektive Kapazität nach S-Lost---Exposition untersucht wurden.
Methoden
Nach der Etablierung eines in vitro-HEK293-Zellkulturmodells, welches TRPA1 überexprimiert, konnte gezielt der Einfluss von S-Lost oder dessen Analogon CEES (2-chlorethyl sulfid) auf den Ionenkanal analysiert werden. Folgende Endpunkte wurden untersucht:
- Die direkte Aktivierung von TRPA1 wurde an Hand der Änderung des intrazellulären Calciums mittels Aequorinassay in Echtzeit gemessen. Als Stimuli dienten der spezifische TRPA1-Aktivator AITC (Allylisothiocanat) sowie S-Lost oder auch CEES.
- Anschließend wurde die Zytotoxizität mittels Cell Prolifera-tion Assay (XTT) nach S-Lost-Exposition untersucht. Die Inkubationsdauer wurde auf Grund der bekannten Latenzzeit von S-Lost auf mindestens 24 Stunden festgelegt.
- Der Effekt von Kanalantagonisten, wie z. B. AP18 sowie den ROS-Scavengern Natrium-Acetylcystein (NAC) und Gluthation (GSH), wurde anschließend in den oben genannten Assays überprüft.
- Abschließend wurden biologische Effekte, wie z. B. die Aktivierung von Signalkaskaden nach S-Lost-Exposition untersucht. Hierfür fanden SDS-PAGE, als auch Western Blots, Reporter Asssays, ELISAs sowie Proteinarrays und die Bioplexmethode Anwendung.
Ergebnisse
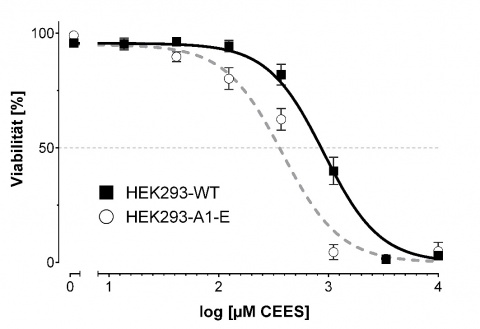
Im Falle des Antagonisten AP18 wurde ebenfalls eine dosisabhängige Inhibition beobachtet. Hierbei beträgt die IC50 von AP18 1,22 µM im Falle einer S-Lost-Exposition, und 0,62 µM AP18 bei nachfolgender CEES-Exposition. Ferner wurde für die Inhibition von TRPA1 mittels AP18 ein protektiver Effekt und eine erhöhte Zellviabilität im Vergleich zur Kontrolle nach CEES-Exposition beobachtet. Hierbei konnte die Resistenz der Zellen gegenüber CEES um bis zu 70 % gesteigert werden [4].
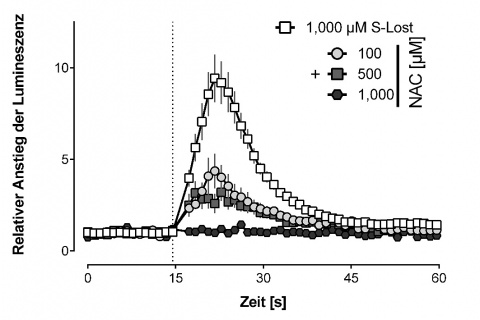
Für NAC konnte ein antagonistisches Potenzial für den TRPA1-Ionenkanal beschrieben werden. Diese inhibitorische Wirkung ist bereits bei 100 µM NAC zu beobachten und erreicht ihr Maximum bei 1 mM NAC [5]. GSH hingegen zeigt kein antagonistisches Potenzial am TRPA1-Ionen-kanal [5].
Auf Proteinebene konnte der Einfluss von S-Lost auf diverse Mitglieder des proliferativen Signalweges der MAPK (mitogen-activated protein kinase) gezeigt werden. Bereits 5 Minuten nach einer S-Lost-Exposition von HEK293-A1-Zellen konnte eine ERK1/2 (extracellular signal-related kinase 1/2)--Phosphorylierung beobachtet werden, welche wiederum durch Inhibition des TRPA1-Kanals verhindert werden konnte. In Korrelation hierzu wurde auch für das Serum-Response-Element, welches in der gleichen Signalkaskade wie ERK1/2 zu finden ist, eine erhöhte Kerntranslokation gemessen.
Diskussion
Ausblick
In zukünftigen Versuchen sollen weitere Kanalinhibitoren auf ihr protektives Potential nach einer S-Lost-Exposition untersucht werden. Bereits geplante Forschungsvorhaben sind dahin gerichtet, sowohl ex vivo als auch in vivo zu überprüfen, ob die in der Zellkultur erzielten Ergebnisse auch auf den lebenden Organismus übertragen werden können. Ziel unserer S-Lost--Forschung ist eine auf die Ursachen gerichtete Therapie, welche wiederum nur dann stattfinden kann, wenn der zugrundeliegende Pathomechanismus komplett entschlüsselt wird.
Literatur
- Deutsch A: Exclusive: Samples confirm Islamic State used mustard gas in Iraq – diplomat. Reuters. 2016; http://www.reuters.com/article/us-mideast-crisis-iraq-chemicalweapons-idUSKCN0VO1IC
- Steinritz D, Striepling E, Rudolf KD et al.: Medical documentation, bioanalytical evidence of an accidental human exposure to sulfur mustard and general therapy recommendations. Toxicology Letters 2016; 244: 112 - 120.
- Macpherson LJ, Dubin AE, Evans MJ, Marr F, Schultz PG, Cravatt BF, Patapoutian A: Noxious compounds activate TRPA1 ion channels through covalent modification of cysteines. Nature 2007; 445 (7127): 541 - 545.
- Stenger B, Zehfuss F, Mückter H et al.: Activation of the chemosensing transient receptor potential channel A1 (TRPA1) by alkylating agents. Archives of Toxicology 2015; 89(9): 1631 - 1643.
- Stenger B, Popp T, John H et al.: N-Acetyl-L-cysteine inhibits sulfur mustard-induced and TRPA1-dependent calcium influx. Archives of Toxicology 2017; 91(5): 2179 - 2189.
Hauptmann Bernhard Stenger
E-Mail: [email protected]
Der Vortrag wurde mit dem 2. Preis ausgezeichnet.
Datum: 29.12.2017
Quelle: Bernhard Stenger, Tanja Popp, Annette Schmidt, Thomas -Gudermann, Horst Thiermann, Dirk Steinritz










