ZOSTEX®
Die Virustatika sind in ihrer Wirksamkeit auf kutane Zosterläsionen nahezu gleichwertig.1 Die Dauer des zosterassoziierten Schmerzes ist bei Brivudin, Famciclovir und Valaciclovir verglichen mit Aciclovir signifikant vermindert.1
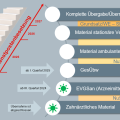
Einen großen Vorteil weist Brivudin durch die Einmaldosierung pro Tag über sieben Tage gegenüber Aciclovir, Famciclovir oder Valaciclovir auf.3
Brivudin darf nicht zur Behandlung von Patienten eingesetzt werden, wenn die Immunabwehr stark eingeschränkt ist, z. B. durch eine Krebs-Chemotherapie, durch eine immunsuppressive Therapie oder durch die Behandlung einer schweren generalisierten Pilzerkrankung mit dem Wirkstoff Flucytosin. Brivudin und 5-Fluorouracil, einschließlich topisch anzuwendender 5-FU-Zubereitungen, oder 5-FU-Prodrugs (z. B. Capecitabin, Floxuridin, Tegafur) oder Kombinationsarzneimittel mit diesen Wirkstoffen oder andere 5-Fluoropyrimidine (z. B. Flucytosin) dürfen nicht zusammen verabreicht werden. Weiterhin muss zwischen einer Behandlung mit Brivudin und dem Beginn einer Therapie mit 5-Fluoropyrimidin- haltigen Arzneimitteln ein zeitlicher Abstand von mindestens 4 Wochen eingehalten werden.2
- Wutzler P, Gross G, Doerr HW. Dtsch Arztebl. 2003;100(13):A858-A861
- Fachinformation Zostex®, Stand Oktober 2010
- ross G, Schöfer H, Wassilew S et al. J Clin Virol. 2003;26:277-289
Weitere Informationen: BERLIN-CHEMIE AG
Frau Patrizia Profeta
Produktmanager Glienicker Weg 125
12489 Berlin
Tel: 030 / 6707-3238
Fax: 030 / 6707-2440
E-Mail: [email protected]
www.berlin-chemie.de
Zostex®. Wirkstoff: Brivudin. Zusammensetzung: 1 Tablette enthält: Brivudin 125 mg; sonstige Bestandteile: Mikrokristalline Cellulose, Lactose- Monohydrat, Povidon K 24-27, Magnesiumstearat (Ph. Eur.) [pflanzlich]. Anwendungsgebiete: Frühzeitige Behandlung des akuten Herpes zoster bei immunkompetenten Erwachsenen. Gegenanzeigen: Überempfindlichkeit gegen Brivudin oder einen der sonstigen Bestandteile. Patienten rouracil (5-FU), einschl. topisch anzuwendender 5-FU-Zubereitungen, 5-FU-Prodrugs (z. B. Capecitabin, Floxuridin, Tegafur), Kombinationsarzneimitteln mit diesen Wirkstoffen oder anderen 5-Fluoropyrimidinen. Immunsupprimierte Patienten (z. B. Krebspatienten unter Chemotherapie, Patienten unter immunsuppressiver Therapie, Patienten mit schwerer systemischer Mykose unter Flucytosin-Therapie). Patienten unter 18 Jahren (nicht ausreichende Erfahrungen), Schwangere und Stillende. Nebenwirkungen: Häufig Übelkeit. Gelegentlich Granulozytopenie, Eosinophilie, Anämie, Lymphozytose, Monozytose, allergische Reaktionen (periphere Ödeme u. Ödeme der Zunge, Lippen, Augenlider, des Kehlkopfes und Gesichts, Pruritus, Hautausschlag, verstärktes Schwitzen, Husten, Dyspnoe, Bronchokonstriktion), Appetitlosigkeit, Insomnie, Angststörung, Kopfschmerzen, Schwindel, Drehschwindel, Somnolenz, Parästhesie, Hypertonie, Erbrechen, Diarrhö, Dyspepsie, Bauchschmerzen, Flatulenz, Verstopfung, Fettleber, Erhöhung der Leberenzyme, Asthenie, Müdigkeit, grippeähnliche Erkrankung (Unwohlsein, Fieber, Schmerz, Schüttelfrost). Selten Thrombozytopenie, Halluzinationen, Verwirrtheitszustand, Geschmacksstörung, Tremor, Ohrschmerzen, Hypotonie, Hepatitis, Bilirubin im Blut erhöht, Knochenschmerzen. Häufigkeit nicht bekannt Gleichgewichtsstörung, Vaskulitis, akutes Leberversagen, fixes Exanthem, exfoliative Dermatitis, Erythema multiforme, Stevens-Johnson-Syndrom. Warnhinweis: Zostex® und 5-Fluorouracil (5-FU), einschließlich topisch anzuwendender 5-FU-Zubereitungen, oder 5-FU-Prodrugs (z. B. Capecitabin, Floxuridin, Tegafur) oder Kombinationsarzneimittel mit diesen Wirkstoffen oder andere 5-Fluoropyrimidine (z. B. Flucytosin) dürfen nicht zusammen verabreicht werden, da eine Akkumulation und erhöhte Toxizität von 5-FU oder anderen 5-Fluoropyrimidinen, inkl. tödlicher Fälle nach Markteinführung berichtet wurden. Weiterhin muss zwischen einer Behandlung mit Zostex® und dem Beginn einer Therapie mit 5-Fluoropyrimidin-haltigen Arzneimitteln ein zeitlicher Abstand von mindestens 4 Wochen eingehalten werden. Als eine zusätzliche Vorsichtsmaßnahme sollte bei Patienten, die vor Kurzem Zostex® erhalten haben, die DPD-Enzymaktivität ermittelt werden, bevor die Behandlung mit einem 5-Fluoropyrimidin-haltigen Arzneimittel begonnen wird. Enthält Lactose. Verschreibungspflichtig. Weitere Einzelheiten enthalten die Fach- und Gebrauchsinformation, deren aufmerksame Durchsicht empfohlen wird. BERLIN-CHEMIE AG, 12489 Berlin (Stand: 09.10)
Datum: 30.09.2014
Quelle: Wehrmedizin und Wehrpharmazie 2014/3