EINFLUSS VON DYNAMISCHEM WIDERSTANDSTRAINING AUF DIE ZEREBRALE AUTOREGULATION
Influence of dynamic Resistance Training on the cerebral Autoregulation
Aus der Sektion Maritime Medizin am Institut für Experimentelle Medizin des UKSH (Leiter: Flottenarzt Priv.-Doz. Dr. A. Koch) der Christian-Albrechts-Universität zu Kiel c/o Schifffahrtmedizinisches Institut der Marine Kronshagen (Leiter: Flottenarzt Dr. S. Neidhardt)
Andreas Koch, Thomas Wunderlich, Julia Witte, Inga Koch und Wataru Kähler
WMM, 57. Jahrgang (Ausgabe 1/2013: S. 2-7)
Zusammenfassung
Hintergrund: Eine Hyperoxie-induzierte Abnahme der zerebralen Blutflussgeschwindigkeit (CBFV) kann ein Schutzeffekt gegen die akute Neurotoxizität beim Tauchen mit geschlossenen Kreislauftauchgeräten sein. Der Einfluss zusätzlicher schwerer körperlicher Belastung auf diese Regulation ist unklar. Daher galt es, Parameter der dynamischen zerebralen Autoregulation während und nach erschöpfender körperlicher Belastung zu bestimmen.
Methoden: Kraftausdauer- und Maximalkraft-Training (23 vs. 8 Wiederholungen) bei 16 weiblichen und 16 männlichen Athleten auf einem Leg-Curler (M. quadriceps, 2 s-Kontraktion) in sitzender Position. Registrierung von EKG, kontinuierlichem Blutdruck (BP), CBFV durch transkranielle Dopplersonographie (TCD) und Atmung. Bei einer Subgruppe (n = 7) Ergospirometrie (O2-Aufnahme, CO2-Elimination, Ventilation) und Blutgasanalysen vor und nach Belastung. Errechnung des zerebrovaskulären Gefäßwiderstandes (CVR) und Pulsatilitätsindex (PI).
Ergebnisse: Unter Belastung betrug der Anstieg der CBFV (p < 0,01) 15 – 30 % in beiden Trainingsets ohne Anhalt für Störungen durch Pressatmung. In der frühen Erholung während schnell sinkenden Blutdruckes erfolgte ein signifikanter Anstieg der CBFV-Amplitude (p < 0,01) für 60 – 80 s. Der mittlere Fluss (Vm) stabilisierte sich auf Belastungsniveau. Die CVR und PI verhielten sich dabei widersprüchlich ähnlich einer präsynkopalen Reaktion. Die Ergospirometrie und Blutgasanalysen ergaben keinen Hinweis auf relevante CO2-Änderungen.
Schlussfolgerungen: Körperliche Belastung führte zu einem signifikanten Anstieg der CBFV. Nach plötzlichem Belastungsende verblieb der Vm zunächst auf dem Belastungsniveau. Die Hyperoxie-induzierte und möglicherweise schützende CBFV-Reduktion kann somit durch schwere Belastung aufgehoben werden.
Schlagworte: Widerstandstraining, zerebrale Blutflussgeschwindigkeit CBFV, Blutdruck, zerebro-vaskulärer Gefäßwiderstand, Pulsatilitätsindex.
Summary
Background: A hyperoxia-induced reduction in cerebral blood-flow velocity (CBFV) might be protective against acute neurotoxicity in closed-circuit diving. The effect of additional heavy exercise on this regulation is unknown. Therefore, we determined parameters of dynamic cerebral autoregulation (CA) during and after exhausting resistance exercise.
Methods: Strength endurance- (23 repetitions) and maximal strength-training (8 repetitions) in 16 female and 16 male athletes on a leg curler (M. quadriceps training; approx. 2 s contraction) in upright position were performed. ECG, blood pressure (BP), CBFV by Transcranial Doppler-Ultrasound (TCD), and breathing have been registrated. Additional repetitive ergospirometry (O2-uptake, CO2-elimination, ventilation) and blood-gas analyses were performed in a subgroup of seven athletes. From BP and CBFV cerebro-vascular resistance (CVR), and Pulsatility Index (PI) were derived.
Results: All athletes showed significant (p < 0.01) 15 – 30 % increases in CBFV during both training sets without signs of flow depression due to Valsalva maneuvers. In the early recovery, when blood pressure rapidly decreased, CBFV-amplitude significantly (p < 0.01) increased for 60 – 80 seconds with mean flow (Vm) on exercise level, while CVR and PI showed conflicting results, similar to a presyncopal reaction. Ergospirometry and blood-gas analyses revealed no evidence of major changes in pCO2.
Conclusions: Physical strain increases CBFV significantly, and keeps Vm on exercise level even during early recovery. A protective hyperoxia-induced reduction in CBFV might thus become overruled by heavy exercise.
Keywords: Training, cerebral blood flow velocity CBFV, blood pressure, cerebro-vascular resistance, pulsatility index.
Einleitung
Das Tauchen mit Tauchgerät erfreut sich als Breitensportart steigender Beliebtheit [1] und stellt darüber hinaus jedoch ebenso eine herausfordernde berufliche Tätigkeit dar, sei es im gewerblichen oder auch militärischen Umfeld.
Beim Tauchen in größeren Tiefen und besonders bei Verwendung von Atemgasgemischen mit einem erhöhten Sauerstoffanteil ist der Taucher einer teilweise erheblichen Hyperoxie ausgesetzt. Der hohe Sauerstoffpartialdruck führt regelmäßig zu einer Abnahme der zerebralen Blutflussgeschwindigkeit (CBFV). Diese Reaktion auf die teilweise extreme Hyperoxie, wie sie zum Beispiel beim Tauchen mit Sauerstoffkreislaufgeräten auftritt, scheint nach derzeitigem Wissensstand einen zumindest zeitweiligen Schutz vor dem Auftreten der akuten Sauerstoff-induzierten ZNS-Toxizität darzustellen. Allerdings wurde im Vorfeld des Auftretens generalisierter zerebraler Krampfanfälle unter Hyperoxie auch beim Menschen ein plötzlicher Anstieg der CBFV beobachtet [2], der mit der Entwicklung der akuten Symptomatik in engem Zusammenhang zu stehen scheint.
Mit Blick auf die der akuten Sauerstoff-induzierten ZNS-Toxizität zu Grunde liegenden Pathophysiologie legen Untersuchungen am Tiermodell [3 – 5] erhebliche Einflüsse der extremen Hyperoxie auf die lokale NO-Verfügbarkeit im Gefäßbett nahe. Eine durch Wechselwirkung des Sauerstoffradikals O2 mit dem NO ausgelöste initiale zerebrale Vasokonstriktion kann dabei sekundär bei akuter ZNS-Toxizität in eine plötzliche Vasodilatation umschlagen und von einem zerebralen Krampfanfall gefolgt werden. Die Hypothese der Wechselwirkung von NO mit Sauerstoffradikalen wird durch eine aktuelle Publikation von Obad [6] zur verminderten „Flow-mediated“ Dilatation der Unterarmarterien nach Sporttauchgängen gestützt.
Die verfügbaren Daten zu einer möglicherweise initial schützenden Wirkung der Vasokonstriktion unter Hyperoxie [2 – 5, 7] wurden bislang üblicherweise unter körperlichen Ruhebedingungen erhoben. Es gibt allerdings deutliche Hinweise, dass körperliche Belastung auch beim Menschen die ZNS-Toxizität des Sauerstoffs erhöhen kann [8].
Es galt folglich zu untersuchen, welchen Einfluss körperliche Belastung auf die CBFV und die dynamische zerebrale Autoregulation hat und wie sich insbesondere plötzliche Laständerungen auf die CBFV auswirken. Gerade im gewerblichen und militärischen Tauchen sind stark wechselnde Belastungsanforderungen unter Wasser üblich. Speziell war die Frage zu beantworten, in welchem Maße körperliche Belastung und plötzliche Laständerungen schon unter normobaren Bedingungen die CBFV und die Parameter der dynamischen zerebralen Autoregulation beeinflussen. Aus der Literatur gibt es Hinweise, dass physische Belastung zu einer moderaten Erhöhung der mittleren zerebralen Blutflussgeschwindigkeit (Vm) [9 – 16] führt. Auch nach einem plötzlichen Lastabbruch wird die erhöhte Vm zunächst aktiv aufrecht erhalten [17], wobei die CBFV-Amplitude deutlich erhöht ist.
In diesem Versuchsansatz wurde gezielt untersucht, ob sich Anhaltspunkte dafür ergeben, dass die belastungsabhängigen Änderungen der CBFV eine Größenordnung erreichen, die die Schutzfunktion der Vasokonstriktion unter Hyperoxie beeinträchtigen kann.
Darüber hinaus war ein weiteres Ziel dieser zweiten Untersuchung, ein auch für den Einsatz unter hyperbaren Bedingungen geeignetes Belastungsmodell zu evaluieren. Dieses könnte in zukünftigen Studien unter Überdruckbedingungen eingesetzt werden, um die der Realität beim Tauchen mit Kreislauftauchgeräten entsprechende Kombination von hyperbarer Oxygenation und physischer Belastung in geeigneter Weise untersuchen zu können [18].
Die Digitalisierung der CBFV-Messung in Kombination mit der kontinuierlichen Blutdruckregistrierung und dem EKG ermöglichte die Kalkulation mehrerer abgeleiteter Parameter der dynamischen zerebralen Autoregulation. Ein Schwerpunkt lag hier auf dem zerebrovaskulären Gefäßwiderstand (CVR), dem Pulsatilitätsindex (PI) und dem kritischen zerebralen Verschlussdruck (CCP). Die Digitalisierung der CBFV-Messung in Kombination mit der kontinuierlichen Blutdruckregistrierung und dem EKG ermöglichte die Kalkulation mehrerer abgeleiteter Parameter der dynamischen zerebralen Autoregulation. Ein Schwerpunkt lag hier auf dem zerebrovaskulären Gefäßwiderstand (CVR), dem Pulsatilitätsindex (PI) und dem kritischen zerebralen Verschlussdruck (CCP).
Methoden
Die Untersuchung wurde am Schifffahrtmedizinischen Institut der Marine mit Genehmigungen der Ethikkommission der Christian-Albrechts-Universität zu Kiel durchgeführt.
An dieser Studie nahmen 17 gesunde weibliche (24,2 ± 2,5 Jahre) und 22 männliche (24,9 ± 2,2 Jahre) Studenten mit einem Minimum von sechs Monaten Erfahrung im Krafttraining teil.
Die männlichen wie auch die weiblichen Probanden führten nach Anlage und Fixierung der Messsysteme jeweils zwei Trainingssets in sitzender Position an einem Beincurler durch. Eines der beiden Trainingssets war für Kraftausdauertraining optimiert, das andere für Maximalkrafttraining.
In der Untergruppe der sieben Probanden mit zusätzlicher Spirometriemessung (Oxycon Beta®, Viasys, Germany) wurden ausschließlich Kraftausdauermessungen durchgeführt, da eine Versuchsdauer von über 60 s notwendig war, um Daten der spirometrischen Gasanalyse zu erhalten.
Änderungen der zerebralen Blutflussgeschwindigkeit (CBFV) wurden mittels transkranieller Dopplersonographie (MultiDop X4®, DWL, Singen, Deutschland) gemessen. Die kontinuierliche nichtinvasive Blutdruckregistrierung erfolgte verschlussplethysmographisch (FinaPres®, Amsterdam, Niederlande). Eine genaue Beschreibung der verwendeten Geräte, der Geräteparameter und der eingesetzten Methoden zur Auswertung der gewonnenen Daten wurde von Koch et al., 2005 [18], Brys et al., 2003 [19] und Dawson et al., 1999 [20] dokumentiert.
Datenerfassung
EKG (Siemens Mingograph 7, Germany), Atmung (Zak® 100 breathing-belt, Simbach/Inn, Germany), und Blutdruck (Finapres® device, Model 2300, Ohmeda, Germany, Finger-Cuff am linken Mittelfinger) wurden während der Versuche kontinuierlich registriert.
Die Registrierung der CBFV erfolgte zeitgleich in beiden A. arteriae cerebri mediae (MCA) (TCD; 2 MHz; Messtiefe des Sampling volumes: 49 – 54 mm; Multi-Dop X4 mit Kopfhalterung, Version: TCD-801b, DWL Elektronische Systeme, Germany). Alle registrierten Daten wurden digital auf einem PC aufgezeichnet und in einem Tabellenkalkulationsprogramm gespeichert (A/D converter card dt2814, Data Translation, Germany, 256 Hz Samplingfrequenz).
Die Ergospirometrie erfolgte mit dicht sitzender Gesichtsmaske (Daten-update alle 30 s; Oxycon Beta®, Viasys, Germany).
Die Blutproben für die kapillären Blutgasanalysen (50 µl für pO2, pCO2 und pH) wurden aus dem hyperämisierten Ohrläppchen vor und innerhalb von 30 s nach Belastung entnommen sowie nach 5 min Erholung (ABL500®, Radiometer, Kopenhagen).
Belastungstests
Jeder Athlet führte zwei Sätze M. quadriceps-Training auf einem handelsüblichen „LegCurler“ (TechnoGym®, Germany) in sitzender Position mit einer Taktvorgabe durch Metronom mit 48 bpm, entsprechend circa 2 s Kontraktionszeit. Der erste Satz entsprach einem Maximalkrafttraining mit maximal 8 Wiederholungen bei 80 – 90 % der individuellen Maximalkraft. Der zweite Satz nach Erholung entsprach einem Kraftausdauertraining mit maximal 23 Wiederholungen bei 50 – 60 % Maximalkraft. Die Sportler waren angewiesen, bei beiden Sätze keine Pressatmungsmanöver durchzuführen. Die linke Hand mit dem Finger-cuff zur Blutdruckregistrierung war während der Versuche auf einem Kissen gelagert.
Die sieben Athleten der Subgruppe, bei der zusätzlich eine Ergospirometrie und eine Blutgasanalyse durchgeführt wurden, führten nur das Kraftausdauertraining durch, da für die Spirometrie eine Messdauer von über einer Minute benötigt wurde.
Datenauswertung
Jede Belastungsphase wurde in sechs Teilabschnitte unterteilt. In jedem Abschnitt wurden Messdaten aus drei konsekutiven Herzaktionen ausgelesen und ein Mittelwert für den jeweiligen Parameter gebildet. Während der frühen Erholungsphase (25 s) wurden alle fünf Sekunden Messdaten ausgelesen, während der verlängerten Erholungsphase alle 10 Sekunden.
Aus den digitalisierten Daten der kontinuierlichen Blutdruckregistrierung wurden der systolische (BPs) und diastolische Blutdruck (BPd) sowie der mittlere Blutdruck (MAP = Integral der Druckwerte eines kompletten Herzzyklus/Anzahl der Datenpunkte) bestimmt.
Aus den Messdaten des TCD wurden die systolische (Vs), die diastolische (Vd) und die mittlere Blutflussgeschwindigkeit bestimmt (Vm = Integral der Flusswerte eines kompletten Herzzyklus/Anzahl der Datenpunkte).
Die Atemkurven aller Belastungsphasen wurden sorgfältig auf Unterbrechungen überprüft, die verdächtig für ein nicht erwünschtes Pressatmungsmanöver hätten sein können.
Berechnung abgeleiteter Parameter
Der cerebro-vaskuläre Widerstand (CVR), der Goslings Pulsatilitätsindex (PI) und der kritische Verschlussdruck (critical closing pressure - CCP) wurden aus den digitalisierten Blutdruck- und TCD-Daten wie folgt errechnet:
- CVR = (MAP (Höhendifferenz/1,36))/Vm [mmHg cm-1 s-1].
- PI der CBFV: PICBFV = (Vs – Vd)/Vm; PI des BP: PIBP = (BPs-BPd)/MAP.
- Für die Berechnung des CCP wurde CBFV als Funktion von BP aufgetragen. CCP wurde definiert als Schnittpunkt der Regressionsgerade mit der BP-Achse (Methode nach Dawson) [20].
Statistik
Für unabhängige Stichproben wurde der Mann-Whitney-U-Test durchgeführt, für abhängige Messungen der Wilcoxon Test. Die Messwerte wurden als Mittelwert ± Standardfehler aufgetragen, Signifikanzlevels *: p < 0.05;**: p < 0.01;***: p < 0.001.
Ergebnisse
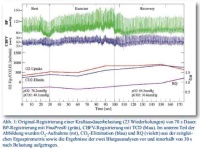
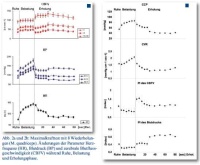
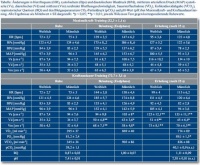
Ausgehend von Normalwerten für Blutdruck und Herzfrequenz stiegen die gemessenen Parameter während der Belastung erwartungsgemäß an. Nach Belastungsende normalisierten sich die Blutdruck (BP)-Parameter innerhalb von 5 – 10 s, der Rückgang der Herzfrequenz dauerte länger. Während beider Belastungsphasen zeigten ebenfalls alle erfassten Parameter der CBFV einen initialen signifikanten Anstieg um 15 – 30 % (p < 0,01), der im weiteren Verlauf der Belastung konstant blieb. In der frühen Erholungsphase konnte dann für die CBFV-Amplitude im Gegensatz zur schnellen Normalisierung des Blutdruckes nach initialen kurzem Abfall von systolischer (Vs) und diastolischer Flussgeschwindigkeit (Vd) („Dipping“) ein deutlicher Anstieg registriert werden mit Vs bis über 127 cm s-1 und Stabilisierung von Vd nach einem initialen kurzen Abfall bei 45 cm s-1. Die mittlere Blutflussgeschwindigkeit (Vm) erreichte nach 25 s Werte oberhalb des Belastungslevels und signifikant über Ruheniveau (p < 0.01). das Wiedererreichen des Normalbereiches dauerte bis zu 80 Sekunden (Abb. 1 und 2, Tabelle).
Ergospirometrie, Blutgasanalysen und abgeleitete Parameter
Die Ergebnisse der Ergospirometrie ergaben die zu erwartenden Anstiege bei Belastung für Ventilation, O2-Aufnahme und CO2-Abgabe, jedoch fanden sich in den Blutgasanalysen insbesondere für pCO2 keine signifikanten Veränderungen während oder nach Belastung.
Der errechnete zerebrovaskuläre Gefäßwiderstand (CVR) stieg während der Belastung parallel zum Blutdruck (BP) an und fiel nach Belastungsende rapide auf Werte unter Ruheniveau ab (< 1,2 mmHg cm-1 s-1). Der Pulsatilitätsindex der CBFV (PICBFV) stieg im Gegensatz hierzu nach Belastung innerhalb weniger Sekunden steil auf etwa 100 % oberhalb des Wertes während des Krafttrainings an. Beide Parameter normalisierten sich langsam in der späten Erholungsphase.
Der CCP erhöhte sich parallel zum BP und CVR während Belastung auf Werte zwischen 80 – 95 mmHg und kehrte zu Ruhewerten in der Erholungsphase zurück.
Diskussion
Die hier erhobenen Daten zu Änderungen der CBFV bei dynamischem Widerstandstraining demonstrieren einen erheblichen Einfluss gerade stark wechselnder körperlicher Aktivität auf die CBFV. Dieser hier zunächst unter normoxischen Bedingungen untersuchte Aspekt kann für zukünftige Untersuchungen im Bereich der Sauerstofftoxizität erhebliche Bedeutung erlangen.
Die Auswertung sowohl der Maximalkraft- als auch der Kraftausdauertests bestätigte einen signifikanten Anstieg sowohl der systolischen und diastolischen als auch der mittleren CBFV um 15 – 30 % zu Beginn der Belastung, was als Ausdruck der gesteigerten metabolischen Hirnaktivität betrachtet wird [12, 21]. Die zerebrale Autoregulation verhinderte allerdings wirksam einen unkontrollierten weiteren CBFV-Anstieg im Verlauf der Belastung und sorgte für eine Stabilisierung der Parameter vornehmlich über einen Anstieg des CVR. Diese Daten decken sich mit Modellberechnungen von Diehl und Berlit [22] und mit früheren Publikationen zur dynamischen zerebralen Autoregulation bei physischer Belastung [13, 19, 23].
Von besonderer Relevanz war jedoch die bei plötzlichem Lastabbruch regelmäßig zu beobachtende deutliche und bis zu 80 Sekunden anhaltende Zunahme der CBFV-Amplitude. Es muss davon ausgegangen werden, dass diese Zunahme der CBFV-Amplitude bei Lastabbruch mit dem unvermittelt eintretenden Rückgang des peripheren Blutdruckes von Belastungswerten auf Ruhewerte in engem Zusammenhang steht, also eine Reaktion auf einen plötzlichen Abfall des peripheren Blutdruckes darstellt. Edwards [24] beschrieb den auch in seinen Untersuchungen nach einem initialen „Dipping“ zu beobachtenden CBFV-Anstieg mit Beginn des Blutdruckabfalls als zerebrale Gegenregulation auf die akute Blutdruckänderung. Die Ergebnisse der eigenen Untersuchungen bestätigen dies, da auch die eigenen Daten das initiale „Dipping“ innerhalb der ersten Sekunden nach Belastung dokumentierten, das dann von einem Anstieg der CBFV abgelöst wurde. Eine ganz ähnliche Reaktion der dynamischen zerebralen Autoregulation wies auch Schondorf [25, 26] bei Patienten mit autonomen Regulationsstörungen im Vorfeld drohender Synkopen nach, bei denen der periphere Blutdruck tatsächlich auf kritisch niedrige Werte abfiel. Es ist somit zu diskutieren, dass die bei einem plötzlichen Blutdruckabfall regelmäßig nach einem initialen „Dipping“ zu beobachtende deutliche Zunahme der CBFV-Amplitude eine regelhafte Gegenmaßnahme der dynamischen Autoregulation auf ein plötzliches Delta in der Blutdruckregulation darstellt. Hierbei spielt es offensichtlich keine wesentliche Rolle, ob lediglich ein schneller Rückgang eines erhöhten peripheren Blutdruckes auf Normalwerte nach Belastungsende oder ein pathologischer Abfall des Blutdruckes im Vorfeld einer neurogenen Synkope vorliegt. In beiden Fällen wird eine ähnliche und schnelle Reaktion der dynamischen zerebralen Autoregulation ausgelöst.
Der rasch eintretende Anstieg der CBFV mit Stabilisierung des Vm (mittlere Flussgeschwindigkeit) auf Vorniveau wurde in den eigenen Versuchen durch einen schnellen Abfall des CVR parallel zum peripheren Blutdruck bei gleichzeitigem starkem Anstieg des PICBFV bewirkt. Letzteres deutet auf eine erhöhte Pulsatilität des CBFV in dieser Phase hin. Diese widersprüchlich erscheinende vaskuläre Reaktion ist mehrfach in präsynkopalen und synkopalen Situationen dokumentiert worden [9, 16, 25, 27]. Als Erklärungsansatz hierfür bietet sich eine starke Abnahme des CVR vornehmlich in den zuführenden proximalen Gefäßregionen zum Ausgleich des plötzlichen Blutdruckabfalles durch eine schnelle Freisetzung vasoaktiver Substanzen wie Adenosin oder NO an. Während dieser kompensatorischen Reaktion proximal herrscht jedoch in den peripheren Gefäßprovinzen noch ein hoher Gefäßwiderstand vor, was sich durch den hohen PICBFV ausdrückt [28, 29].
Die in der vorgestellten Versuchsreihe regelhaft auslösbare deutliche Reaktion der CBFV auf eine körperliche Belastung und insbesondere die akute Gegenregulation der CBFV in der frühen Erholungsphase nach Lastabbruch machen deutlich, dass unter den Bedingungen der Hyperoxie der Aspekt der körperlichen Belastung hohe Relevanz für die akute O2-induzierte ZNS-Toxizität gewinnen könnte. Das beobachtete Ausmaß der Änderungen der CBFV war tatsächlich groß genug, um die aus den Sauerstofftoleranztests bekannte und möglicherweise schützende Vasokonstriktion unter Hyperoxie gegebenenfalls nahezu vollständig aufheben zu können [2, 30].
Eine solche mögliche gegenseitige Beeinflussung wird noch unterstrichen durch Hinweise aus der Literatur, die besagen, dass einerseits an den zuvor beschriebenen Wirkmechanismen unter Belastung und Lastabbruch die lokale NO-Homöostase beteiligt ist [28], andererseits gerade Änderungen des NO-Gleichgewichtes für wesentliche Aspekte der akuten O2-bedingten ZNS-Toxizität verantwortlich gemacht werden [5, 7, 31-33].
Schlussfolgerungen
Das in der vorgelegten Studie erfolgreich normobar getestete physiologische Belastungsmodell erscheint demnach geeignet, vor dem Hintergrund der dargestellten Änderungen im NO-Gleichgewicht bei akuter O2-bedingter Neurotoxizität den Einfluss körperlicher Belastung bei Hyperoxie in Bezug auf Änderungen der zerebralen Vasomotorik genauer untersuchen zu können. Die Ergebnisse könnten wesentlich dazu beitragen, den Einfluss körperlicher Belastung auf die akute ZNS-Toxizität des Sauerstoffs besser verstehen zu lernen und das Tauchen mit sauerstoffangereicherten Gasgemischen oder mit reinem Sauerstoff zukünftig sicherer zu machen.
Literatur
- Benton PJ, Glover MA. Diving medicine. Travel Med Infect Dis. 2006 4: 238-254.
- Visser GH, Van Hulst RA, Wieneke GH, Van Huffelen AC. Transcranial Doppler sonographic measurements of middle cerebral artery flow velocity during hyperbaric oxygen exposures. Undersea Hyperb Med. 1996 23: 157-165.
- Atochin DN, Demchenko IT, Astern J, Boso AE, Piantadosi CA, Huang PL. Contributions of endothelial and neuronal nitric oxide synthases to cerebrovascular responses to hyperoxia. J Cereb Blood Flow Metab. 2003 23: 1219-1226.
- Demchenko IT, Atochin DN, Boso AE, Astern J, Huang PL, Piantadosi CA. Oxygen seizure latency and peroxynitrite formation in mice lacking neuronal or endothelial nitric oxide synthases. Neurosci Lett. 2003 344: 53-56.
- Demchenko IT, Bosso AE, Zhiliaev S, et al. [Involvement of nitrogen oxide in the cerebral vasoconstriction during respiration with high pressure oxygen]. Ross Fiziol Zh Im I M Sechenova. 2000 86: 1594-1603.
- Obad A, Palada I, Valic Z, et al. The effects of acute oral antioxidants on diving-induced alterations in human cardiovascular function. J Physiol. 2007 578: 859-870.
- Demchenko IT, Boso AE, Bennett PB, Whorton AR, Piantadosi CA. Hyperbaric oxygen reduces cerebral blood flow by inactivating nitric oxide. Nitric Oxide. 2000 4: 597-608.
- Arieli R, Shochat T, Adir Y. CNS toxicity in closed-circuit oxygen diving: symptoms reported from 2527 dives. Aviat Space Environ Med. 2006 77: 526-532.
- Jorgensen LG, Perko M, Perko G, Secher NH. Middle cerebral artery velocity during head-up tilt induced hypovolaemic shock in humans. Clin Physiol. 1993 13: 323-336.
- Herholz K, Buskies W, Rist M, Pawlik G, Hollmann W, Heiss WD. Regional cerebral blood flow in man at rest and during exercise. J Neurol. 1987 234: 9-13.
- Jorgensen LG, Perko G, Secher NH. Regional cerebral artery mean flow velocity and blood flow during dynamic exercise in humans. J Appl Physiol. 1992 73: 1825-1830.
- Moraine JJ, Lamotte M, Berre J, Niset G, Leduc A, Naeije R. Relationship of middle cerebral artery blood flow velocity to intensity during dynamic exercise in normal subjects. Eur J Appl Physiol Occup Physiol. 1993 67: 35-38.
- Hellstrom G, Wahlgren NG. Physical exercise increases middle cerebral artery blood flow velocity. Neurosurg Rev. 1993 16: 151-156.
- Pott F, Knudsen L, Nowak M, Nielsen HB, Hanel B, Secher NH. Middle cerebral artery blood velocity during rowing. Acta Physiol Scand. 1997 160: 251-255.
- Ide K, Pott F, Van Lieshout JJ, Secher NH. Middle cerebral artery blood velocity depends on cardiac output during exercise with a large muscle mass. Acta Physiol Scand. 1998 162: 13-20.
- Carey BJ, Eames PJ, Panerai RB, Potter JF. Carbon dioxide, critical closing pressure and cerebral haemodynamics prior to vasovagal syncope in humans. Clin Sci (Lond). 2001 101: 351-358.
- Edwards MR, Schondorf R. Is cerebrovascular autoregulation impaired during neurally-mediated syncope? Clin Auton Res. 2003 13: 306-309.
- Koch A, Ivers M, Gehrt A, Schnoor P, Rump A, Rieckert H. Cerebral autoregulation is temporarily disturbed in the early recovery phase after dynamic resistance exercise. Clin Auton Res. 2005 15: 83-91.
- Brys M, Brown CM, Marthol H, Franta R, Hilz MJ. Dynamic cerebral autoregulation remains stable during physical challenge in healthy persons. Am J Physiol Heart Circ Physiol. 2003 285: H1048-1054.
- Dawson SL, Panerai RB, Potter JF. Critical closing pressure explains cerebral hemodynamics during the Valsalva maneuver. J Appl Physiol. 1999 86: 675-680.
- Hollmann W, Struder HK. [Brain, psyche and physical activity]. Orthopade. 2000 29: 948-956.
- Diehl RR, Linden D, Lucke D, Berlit P. Phase relationship between cerebral blood flow velocity and blood pressure. A clinical test of autoregulation. Stroke; a journal of cerebral circulation. 1995 26: 1801-1804.
- Persson PB. Spectrum analysis of cardiovascular time series. Am J Physiol. 1997 273: R1201-1210.
- Edwards MR, Martin DH, Hughson RL. Cerebral hemodynamics and resistance exercise. Med Sci Sports Exerc. 2002 34: 1207-1211.
- Schondorf R, Benoit J, Wein T. Cerebrovascular and cardiovascular measurements during neurally mediated syncope induced by head-up tilt. Stroke; a journal of cerebral circulation. 1997 28: 1564-1568.
- Schondorf R, Stein R, Roberts R, Benoit J, Cupples W. Dynamic cerebral autoregulation is preserved in neurally mediated syncope. J Appl Physiol. 2001 91: 2493-2502.
- Van Lieshout JJ, Wieling W, Karemaker JM, Secher NH. Syncope, cerebral perfusion, and oxygenation. J Appl Physiol. 2003 94: 833-848.
- Chen Y, McCarron RM, Golech S, et al. ET-1- and NO-mediated signal transduction pathway in human brain capillary endothelial cells. Am J Physiol Cell Physiol. 2003 284: C243-249.
- Phillis JW, Lungu CL, Barbu DE, O’Regan MH. Adenosine’s role in hypercapnia-evoked cerebral vasodilation in the rat. Neurosci Lett. 2004 365: 6-9
- Koch AE, Kahler W, Wegner-Brose H, et al. Monitoring of CBFV and time characteristics of oxygen-induced acute CNS toxicity in humans. European journal of neurology : the official journal of the European Federation of Neurological Societies. 2008 15: 746-748.
- Demchenko IT, Boso AE, O’Neill TJ, Bennett PB, Piantadosi CA. Nitric oxide and cerebral blood flow responses to hyperbaric oxygen. J Appl Physiol. 2000 88: 1381-1389.
- Demchenko IT, Oury TD, Crapo JD, Piantadosi CA. Regulation of the brain’s vascular responses to oxygen. Circ Res. 2002 91: 1031-1037.
- Demchenko IT, Piantadosi CA. Nitric oxide amplifies the excitatory to inhibitory neurotransmitter imbalance accelerating oxygen seizures. Undersea Hyperb Med. 2006 33: 169-174.
Es besteht kein Interessenkonflikt.
Datum: 23.01.2013
Quelle: Wehrmedizinische Monatsschrift 2013/1