KRIM-KONGO HÄMORRHAGISCHES FIEBER – EIN RELEVANTES RISIKO IM EINSATZ?
Krim-Kongo hämorrhagisches Fieber (CCHF) ist eine der klassischen und nach dem Denguefieber die am weitesten verbreitete „tick-born“ Arbovirose ( ARBO = arthropod born, also von Moskitos oder Zecken übertragen) der Welt. Das Krim Kongo Virus (CCV) ist auch eines der am frühesten beschriebenen und am weitesten verbreiteten hämorrhagischen Fieberviren (HFV).
Gerade in den letzten Monaten hat es eine Häufung von Meldungen gegeben aus der Region Bangladesh /Pakistan und aus dem afghanisch-indischen Grenzgebiet. Für die ISAF-Einsätze muss der Tod eines US-amerikanischen Kameraden im Jahr 2009 eine erhebliche Warnung sein, das Vorkommen der Erkrankung im Gebiet der KFOR-Einsätze ist lange bekannt. Ein besonderes Charakteristikum dieser an sich zoonotischen Erkrankung ist ihr Übertragungsmodus: einerseits kann das Virus von Mensch zu Mensch übertragen werden - insbesondere bei Blutkontakten und bei Sekret-Kontaminationen -, aber auch durch Zeckenstiche wird die Erkrankung auf den Menschen übertragen. Das natürliche Reservoir des Krim-Kongo Virus sind Paarhufer, Nagetiere, Hasenartige und Vögel.
Historie
Es ist durchaus möglich, dass eine der frühesten Beschreibung einer Krim-Kongo Infektion von dem nahöstlichen Arzt Abu Bakr al-Raza genannt Rhazes (854-932) stammt, der in seinem „Kitab al-Hawi“ (einem Lehrbuch der Medizin) drei Fälle beschreibt, die eine erstaunliche Ähnlichkeit mit dem von Krim- Kongovirus hervorgerufenen Krankheitsbild haben. Später war es dann im 12. Jahrhundert ein Nachfolger von Avicenna, der Perser al Husayn al-Jorjani, der einen Fall aus der Region von Tadschikistan beschrieb, bei dem die Leitsymptome blutiger Urin, Erbrechen und blutiges Sputum waren. Er vermutete schon Arthropoden als eine Ursache für die Erkrankung und „Parasiten in schwarzen Vögeln“ als ihren Herd. In der Volkskultur der Usbeken sind über Jahrhunderte ähnliche Krankheitsbilder immer wieder beschrieben worden.
Das erste Erscheinen des Krim Kongo-Virus in der modernen Zeit fand 1956 in Belgisch-Kongo statt. Am 6. März 1956 sah einer der in Stanleyville tätigen belgischen Kolonialärzte einen dreizehnjährigen Jungen mit Fieber, Kopfschmerzen, Erbrechen, generalisierten Gelenkschmerzen und Lichtscheu. Der Labormediziner entnahm dem Jungen Blut und inokulierte es in eine Maus und zwar sowohl intrazerebral als auch intraperitoneal. Diese und auch alle im Folgenden inokulierten Mäuse erkrankten oder starben und auch der Arzt selbst litt anschließend unter einem Krankheitsbild mit Fieber, Übelkeit und Erbrechen, und auch sein Blut wurde Mäusen inokuliert. In Ermangelung eines Gefrierschranks wurde das Isolat nach Passage durch einen bakteriendichten Filter weiter in Mäusen gehalten und schließlich in das Nationale Virologische Institut in Entebbe, Uganda verbracht - dort erkrankten dann im weiteren Verlauf noch zwei Labormitarbeiter an einem solchen Krankheitsbild. Erst 1967 erschien dann die erste Veröffentlichung unter dem Titel Kongo- Virus, ein bisher unbekanntes Virus aus Afrika ; gleichzeitig arbeitete der russische Virologe Chumakow mit einem auf der Krim isolierten Virus, das er in psychiatrische Patienten zur therapeutischen Fieberindukion einbrachte, durch Freiwillige passagierte und schließlich auch in Mäuse inokulierte. Die Zahl der Opfer dieser Experimente ist unbekannt. Auf der Krim waren1944 etwa 200 russische Soldaten an einer fieberhaften, hämorrhagischen Symptomatik erkrankt, als sie versuchten, den unter den Kriegsfolgen leidenden Bauern zu helfen. Chumakow wies auch bereits in Hyalommazecken das entsprechende Virus nach und die Russen erreichten schließlich, dass dieses nicht Kongo-Krim Virus genannt wurde, sondern Krim-Kongo Virus. Die Abkürzung CCHF kann aber in beiden Versionen als gültig angesehen werden. Es ist eine Pointe der Geschichte, dass die Politik des kalten Krieges die Benennung eines Virus beeinflusst hat.
Virologie
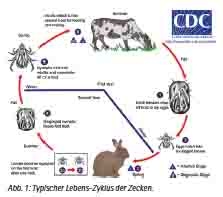
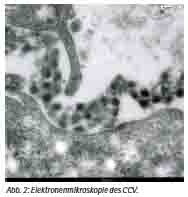
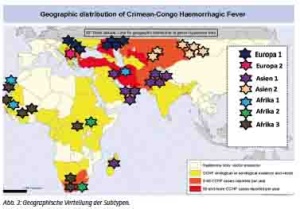
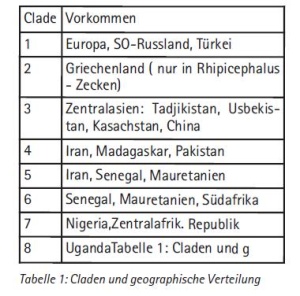
Krim- Kongo Virus ist ein Mitglied der Familie der Bunyaviridae. Zu diesen gehören die Genera Hantavirus, Phlebovirus und Nairovirus. CCHF ist ein Nairovirus, diese werden alle von Zecken übertragen. In den Zecken kann es zu einer transovariellen und transstadiellen Transmission kommen. Der Lebenszyklus (Abb. 1) zwischen Zecke und Wirbeltier kann Wildtiere, aber auch Haustiere betreffen, auch domestizierte Vögel wie zum Beispiel Strauße oder Huftiere wie Kamele. Drei RNA-Segmente bilden das umhüllte Virion, das aus drei Untereinheiten (Small, Medium, Large) besteht und 90-100 Nanometer groß ist (Abb. 2). Elektronenmikroskopisch ist es gut von anderen Nairoviren zu unterscheiden. Möglichkeiten der molekulargenetischen Sequenzierung im S-Segment haben zur Bestimmung unterschiedlicher Genotypen geführt, die auch in geographisch unterschiedlichen Regionen der Welt vorkommen: So kennt man heute Asien-Subtyp 1, 2, Europa 1, 2, Afrika 1, 2, 3 bzw. acht Clade mit ca. 70 genetisch unterscheidbaren Genotypen und acht Claden, die auch eine unterschiedliche Virulenz und Ökologie zu haben scheinen (Tabelle 1). Sowohl Re-Assortment als auch Rekombination sind für diese Vielfalt verantwortlich.
Übertragung, Ökologie und Vorkommen
Die Verteilung der Subtypen in der Welt und den Einsatzgebieten der Bundeswehr zeigt grob Abbildung 3.
31 Zeckenspezies der Familie Ixodidae sind als Vektoren nachgewiesen, Hyalomma Zecken (Abb. 4) sind das bevorzugte Genus, aber auch Rhipicephalus, Boophilus, Dermacentor und Ixodes. Während die Zeckennymphen eher kleine Tiere wie Kaninchen, Hasen und Igel befallen, sorgen die adulten Zecken für die Infektion auch größerer (Haus-) Tiere. Die befallenen Tiere sind nicht krank. Die Erkrankung wird auch durch Zerquetschen des Vektors auf der Haut, zum Beispiel im Rahmen der Schafschur, übertragen. Vor allem aber Schlachtung oder Verkauf von Fleisch sind häufige Modi der Infektion. Nosokomiale und intrafamiliäre Übertragung insbesondere bei blutenden Patienten ist häufig und spielt auch für das medizinische Personal eine schwerwiegende Rolle. Eine aerogene Übertragung wird diskutiert, ist aber nicht gesichert. Von der türkischen Arbeitsgruppe um O. Ergonul, einem der erfahrensten Forscher in Südeuropa, wurde auch über diaplazentare Übertragungen berichtet.
Seit der Erstbeschreibung 1967 sind etwa 140 Ausbrüche mit mehr als 5 000 betroffenen Patienten in 52 Ländern beschrieben worden. Dabei sind die Ausbrüche im NATO-Partnerland Türkei und die starke saisonale Zunahme der Fälle zwischen April und Juli besonders im Kosovo 2008/09/10 bemerkenswert. Nosokomiale Übertragung auf Ärzte und Pflegepersonal hat in den letzten Jahren besonders bei Ausbrüchen in Mauretanien, der Türkei und Bulgarien, Indien und Pakistan stattgefunden, teils auch mit Todesfolge. Eine Durchsicht der ProMed Mails aus den letzten Jahren zeigt eine starke Zunahme der Erkrankungsmeldungen aus der Region Pakistan / Afghanistan / Indien, aber auch einen ersten Nachweis von CCV in Hyalommazecken in Spanien im Jahr 2010. Im Südsudan wurde 2010 nach vielen Verdachtsfällen zum ersten Mal der Nachweis einer nosokomialen Übertragung nach Erkrankung eines Schlachters molekulargenetisch gesichert. Nach Zeckenstich im Rahmen eines Einsatzes im Süden Afghanistans verstarb 2009 ein amerikanischer Kamerad nach Medevac in das Krankenhaus Landstuhl, eine Umgebungsuntersuchung bei seinen Kameraden blieb offensichtlich ohne weitere Befunde.
Klinik
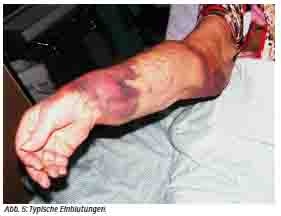
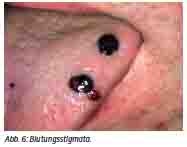
Das klinische Bild ähnelt dem anderer hämorrhagischer Fiebervirusinfektionen wie Ebola, Marburg oder Lassa. Seine Ausprägung hängt von der Infektionsdosis (minimal 1 - 10 Viren) und dem Infektionsweg ab, ganz sicher auch vom Virustyp. Nach einer Inkubationszeit von etwa 3 - 7 Tagen, maximal dokumentiert sind 13, kommt es in der prähämorrhagischen Phase zu Kopfschmerz, Fieber ohne Rhythmik, Myalgie und Schwindel. Diarrhoe, Übelkeit und Erbrechen können hinzukommen, eine Hyperämie der Haut, Exantheme und Konjunktivitis sind beschrieben. Nach etwa drei Tagen läuft die Erkrankung dann entweder unspektakulär aus oder geht in die hämorrhagische Phase über, die abrupt beginnt und mit Blutungen in allen Organen einhergeht; teils sind auch innere Blutungen ohne äußere Stigmata beschrieben. Zwei typische Befunde solcher Patienten zeigen die Abbildungen 5 und 6. Wird diese Phase überlebt, so kommt es etwa 10 - 20 Tage nach Erkrankungsbeginn zur Rekonvaleszenzphase, die mit Allgemeinsymptomen einhergeht. Von Fällen aus dem Kosovo aus dem Ausbruch 2009/08 wurde im Nachhinein von einer erheblich prolongierten Virämie bis zum Tag 36 nach Erkrankungsbeginn berichtet. In dieser Hinsicht ähnelt damit CCV anderen HFV wie Lassa oder Marburg. Die türkischen Kollegen um Ergonul haben versucht, eine Einschätzung der Prognose anhand einiger einfacher Laborparameter zu ermöglichen:
- Thrombozyten unter 20 000/mm
- ALT > 900 U/ml oder AST > 700 U/l
- aPTT > 60 sec. oder Fibrinogen < 110 mg/dL
gelten als ungünstige Prognoseparameter. Von einigen Autoren wurden noch GI-Blutung, Somnolenz und Splenomegalie hinzugefügt und Patienten, die an CCHF starben, hatten signifikant höhere IL-6 und TNF-α Spiegel als Überlebende. Die Letalität ist regional unterschiedlich und wird meist mit 20 – 50 % angegeben (WHO: 30 %). Der Tod tritt in der Regel in der 1. - 2. Woche ein.
Pathogenese
Die Pathogenese des CCHF wird oft mit der von Ebola verglichen, und so wird auch CCHF als das Ebola Asiens bezeichnet. Wie alle hämorrhagischen Fieberviren wirkt auch CCV auf zwei Ebenen: Direkte Zellschädigung in den Organen durch virusbedingte zytopathische Effekte mit Endothelschädigung geht einher mit einer Aktivierung des Immunsystems mit Freisetzung von Zytokinen, Chemokinen, NO und anderen Mediatoren und resultiert in einem programmierten Zelltod, einer Aktivierung der Gerinnungskaskade mit Entwicklung einer DIC und Multiorganversagen. Für Details muss hier auf die Literatur verwiesen werden.
Diagnose und Differenzialdiagnosen
Die Anamnese des Patienten, der ja unter Umständen im weiteren Verlauf schnell nicht mehr auskunftsfähig sein wird, muss „ziseliert und mit Liebe“ unter Erfassung von Expositionsrisiken erfolgen. Neben Zeckenkontakten muss nach Kontakt zu Erkrankten, Tieren und nach out-door-Aktivitäten gefragt werden, im soldatischen Bereich sind Biwak (Abb. 7), Patrouillen und Kontakt zu Einheimischen und Tieren wichtig. Selbst in wüstenhaften Regionen sind Ziegen- oder Schafhaltung und Zeckenvorkommen möglich (Abb. 8), womit eine Exposition gegeben ist. Labordiagnostik muss unter Beachtung der entsprechenden BioSafety-Regelungen erfolgen. Ein Nachweis von IG M- und IG G- Antikörpern mittels ELISA ist routinemäßig etabliert und wird am 6. - 7. Tag positiv. Die IG M-Antikörper persistieren über vier Monate, IG G ist bis zu fünf Jahren nach Infektion noch nachweisbar, während schnell verstorbene Patienten keine messbare Immunantwort zeigten. Um eine nosokomiale Ausbreitung zu verhüten, ist möglichst schnelle Diagnosestellung essentiell und sie erfolgt heute in allen Zentren mittels reverse Transkriptase-PCR innerhalb von acht Stunden - die Grundlage für diese Technik wurde von Mitarbeitern des Bernhard-Nocht-Institutes, unserem Kooperationspartner, erbracht. Virusisolation und Anzucht sind möglich, müssen aber unter BSL-4-Bedingungen erfolgen und dauern 2 - 5 Tage.
Wichtige Differenzialdiagnosen sind alle anderen viralen hämorrhagischen Fieber, soweit sie in der entsprechenden Region vorkommen; wichtige bakterielle Erreger sind vor allem Rickettsien (muriner Typhus und Fleckfieber sowie Infektionen durch Orientia tsutsugamushi in Asien), Leptospiren, Borrelia recurrentis, Meningokokken und Blutparasitosen wie Malaria und akute Trypanosomiasis.
Behandlung
Bei der zivilen und militärischen sanitätsdienstlichen Versorgung dieser Patienten müssen auch unter den erschwerten Bedingungen eines Einsatzes soweit wie möglich die Grundlagen des Barrier Nursing zur Anwendung kommen – Eigenschutz hat Vorrang. Neben einer aggressiven supportiven Behandlung von Blutungen und Multiorganversagen kommt heute in erster Linie Ribavirin, ein 1972 synthetisiertes Purin-Nukleosid-Analogon zur Anwendung. Als Polymerasehemmer verhindert es die Vermehrung von RNA- und DNA-Viren in vitro, seine Effizienz in vivo ist aber bis heute umstritten und mag auch vom möglichst frühen Zeitpunkt der Anwendung abhängen. Ein international akzeptiertes Dosierungsschema ist sowohl für die orale als auch teure intravenöse Anwendung seitens der WHO empfohlen. Ribavirin ist in den Feldlazaretten der betroffenen Einsatzgebiete verfügbar. Weitere angewandte Therapieoptionen wie die Gabe von Immunsera oder subunit-spezifischen monoklonalen Antikörpern sind genauso wenig durch kontrollierte Studien belegt bzw. belegbar, da ethische Grundsätze einer plazebokontrollierten Studie auf Dauer entgegenstehen. Angesichts der möglichen Differenzialdiagnosen muss bei Einleitung einer Therapie vor Diagnosesicherung eine zusätzliche antibiotische oder gegen Plasmodium falciparum gerichtete Behandlung erfolgen; als Antibiotikum bietet sich dabei vor allem Doxyzyklin, auch in Kombination, an.
Prävention
In unserem militärischen, sanitätsdienstlichen Kontext sind die mechanische und chemische Vektorprophylaxe in Verbindung mit einer kontinuierlichen Erziehung der eingesetzten Soldaten fest etabliert. Das Wissen um andere Infektionswege ist aber beim Sanitätspersonal und der Truppe noch nicht weit genug verbreitet und die nosokomiale Ausbreitung der Infektion ist unter Einsatzbedingungen eine reale Gefahr. Sie muss durch weitere Aufklärung über das Krankheitsbild und durch kontinuierliche Fortbildung besonders der jungen Sanitätsoffiziere vor dem Einsatz minimiert werden; der im Fachbereich Tropenmedizin stattfindende Einsatzvorbereitungskurs mit infektiologisch-tropenmedizinischen Inhalten dient hierzu in besonderer Weise. Die hohe Zahl von mehr als 200 Fällen in den Jahren 2009/2010 auf dem Balkan, die Ausbreitung des Virus in den NATO-Nachbarstaaten Türkei und Bulgarien, der Nachweis in Spanien und der Tod des amerikanischen Kameraden muss eine ständige Mahnung und Motivation zur Vorbereitung sein. Die vom zuständigen Kommandohygieniker Oberstarzt Dr. Lüke im Jahre 2010 mit dem 25. DEU Einsatzkontingent KFOR und unserem Fachbereich durchgeführte Übung Schneller Schutz hat in vorbildlicher und sehr plastischer Weise gezeigt, wie komplex die Anforderungen im Falle der Realversorgung eines solchen Patienten oder auch nur eines Verdachtsfalles sind (Abb. 9). Sie hat aber auch zur Implementierung eines möglichen Konzeptes für diese Situation beigetragen und sollte Modell sein für ähnlich strukturierte Übungen auch in Afghanistan/ISAF. Ein Schritt in diese Richtung wird die Durchführung des Barrier Nursing Kurses des Fachbereiches Tropenmedizin erstmals im Übungslazarett in Feldkirchen für Fortgeschrittene im Herbst dieses Jahres sein.
Fazit
Die geografische Epidemiologie des sich ausbreitenden Krim-Kongo hämorrhagischen Fiebers deckt sich mit mehreren Einsatzgebieten der Bundeswehr. Diese ARBO-Virusinfektion stellt somit eine zwar seltene, aber ernst zu nehmende Gefahr für den Soldaten besonders in ISAF und KFR dar. Präventivmaßnahmen und vorausschauende Planung zur Versorgung infizierter Soldaten oder von Verdachtsfällen auch in der Zivilbevölkerung ist erforderlich; dafür bereits ausgearbeitete Konzepte bedürfen weiterer intensiver Erprobung und Verbesserung. Der Fachbereich Tropenmedizin des Bundeswehrkrankenhauses Hamburg ist als Kompetenzzentrum sowohl in der theoretischen Einsatzvorbereitung der Sanitätsoffiziere als auch als schnell zu mobilisierende Task Force ein aktives Element der speziellen präventiven Medizin innerhalb des Sanitätsdienstes der Bundeswehr.
Datum: 20.03.2012
Quelle: Wehrmedizin und Wehrpharmazie 2012/4