MEDIZINISCHER ABC-SCHUTZ
Einsatz des Hautkampfstoffs Schwefellost im Nahen Osten: Neue Methoden zum Beweis der Vergiftung
Harald John*, Marianne Koller*, Franz Worek*, Horst Thiermann*, Markus Siegert*
Zusammenfassung
In einem Krisengebiet im Nahen Osten ereignete sich während kriegerischer Auseinandersetzungen 2015 ein Mörserangriff, bei dem die Freisetzung des Hautkampfstoffes Schwefellost (HD) vermutet wurde. In der Nähe des Aufschlagortes der Granate befanden sich 7 Personen, von denen einige unmittelbar mit Übelkeit und Erbrechen, Durchfall, Irritationen an Haut und Augen sowie Schmerzen im oberen Respirationstrakt reagierten. Vier der Personen entwickelten verzögert Haut-rötungen, Blasen und schlecht heilende Hautwunden. Im Rahmen einer ärztlichen Untersuchung wurde 15 Tage nach vermuteter Exposition den betroffenen Personen Blut abgenommen, um mittels langlebiger Protein-Addukt Biomarker den Verdacht auf Vergiftung zu klären. Solche Addukte entstehen im Körper durch chemische Reaktion von HD beispielsweise mit dem humanen Serumalbumin.
Zu diesem Zweck gelangte ein neues, eigens am Institut für Pharmakologie und Toxikologie (InstPharmToxBw) der Bundeswehr entwickeltes Methodenspektrum zum Einsatz. Durch separate Proteolyse der Patientenplasmen mit drei verschiedenen Enzymen (Pronase, Pro-teinase K, Pepsin) wurden 4 Peptid-Addukte produziert, die sich selektiv und sensitiv mittels einer Kopplung von Flüssigchromatografie zur Trennung und hochauflösender Tandem-Massenspektrometrie zur Detektion (µLC-MS/HRMS) nachweisen ließen. Die verschiedenen Methoden lieferten zur klinischen Symptomatik kongruente Resultate und belegten, dass 4 der 7 Perso-nen durch HD vergiftet worden waren.
Dies ist das erste Mal, dass reale HD-Vergiftungen in diesem Umfang durch Protein-Addukte bewiesen wurden.
Schlüsselwörter: Biomarker, Hydroxyethylthioethyl--Gruppe, LC-ESI MS/HR MS, Protein-Addukte, Hautkampfstoff
Keywords: biomarker, hydroxyethylthioethyl-moiety, LC-ESI MS/HRMS, protein-adducts, vesicant
Einleitung

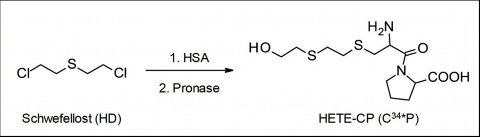
Eine wichtige Klasse der Biomarker sind Reaktionsprodukte von Kampfstoffen mit körpereigenen Proteinen (Protein-Addukte). Diese zeichnen sich durch recht lange Halbwertzeiten im lebenden Organismus aus und ermög-lichen somit auch noch Wochen bis Monate nach Vergiftung eine positive Postexpositionsanalytik [2]. Im Falle von Schwefellost (HD) werden Proteine typischerweise durch Anbindung mindestens einer Hydroxyethylthioethyl (HETE) Einheit chemisch modifiziert (Abbildung 1).
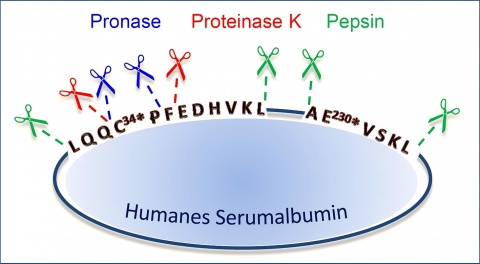
Wird diesem HSA-Addukt nun im Zuge der Probenaufarbeitung im Labor das Enzymgemisch Pronase zugesetzt, resultiert das Zerschneiden des alkylierten Proteins in kleine Spaltprodukte (Peptide). Dadurch wird das alkylierte Dipeptid, welches aus den Aminosäuren Cystein--Prolin besteht (Cys34*Pro, C34*P), gebildet (Abbildung 1, 2). Es trägt weiterhin den HETE-Rest und fungiert demnach als eindeutiger Biomarker einer HD-Inkorporation [1, 4, 6, 13].
Wird das HSA-Addukt statt mit Pronase mit Proteinase K enzymatisch gespalten, entsteht das Tripeptid Cys34*ProPhe (C34*PF), welches ebenfalls ein bereits international akzeptierter Biomarker der HD-Vergiftung ist (Abbildung 2) [3-7].
Für einen validen Expositionsnachweis nach den Regeln der OVCW sind jedoch immer mindestens zwei verschiedene analytische Methoden für ein und denselben Biomarker oder aber mindestens zwei verschiedene Biomarker mit wenigstens einer Methode nachzuweisen. Daher besteht ein Forschungsinteresse in der Erweiterung des bioanalytischen Methodenspektrums.
Wir stellen hiermit zwei zusätzliche mittels Pepsin neu generierte Expositionsmarker vor (AE230*VSKL und LQQC34*PFEDHVKL), die erfolgreich in Plasmaproben von Vergifteten aus einer Krisenregion im Nahen Osten erstmalig nachgewiesen werden konnten [3].
Material und Methoden
Chemikalien
Humanes EDTA-Plasma (Blank Plasma) wurde von Dunn Labortechnik (Asbach, D) bezogen. Pronase (von Streptomyces griseus) und Pepsin (aus Magenschleimhaut des Schweins) stammte von Roche (Mannheim, D) und Proteinase K von Merck (Darmstadt, D). Deuteriertes -Atropin (d3-Atr) wurde von CDN Isotopes (Pointe-Claire, Quebec, Canada) beschafft. Schwefellost (HD) wurde durch das Bundesministerium der Verteidigung bereitgestellt. Weitere Chemikalien wurden von gängigen Anbietern bezogen.
Herstellung von Protein-Addukt-Referenzen
Blank Plasma wurde mit 10 µM HD für 2 h bei 37°C und anschließend über Nacht im Kühlschrank inkubiert. Die Proteolyse zur Generierung der verschiedenen Peptid--Biomarker erfolgte wie untenstehend beschrieben.
HD ist ein giftiger Hautkampfstoff, der geschütztes Arbeiten unter dem Abzug erfordert. Laborverbrauchsmaterial muss vor der Entsorgung in basischer NaOCl-Lösung dekontaminiert werden.
Plasmaprobenvorbereitung zur Produktion von C34*P und C34*PF
In einem Gefäß zur Ultrafiltration (UF, 0,5 mL Amicon -Ultrafiltration Unit, molecular weight cut-off 10 kDa, Merck-Millipore, Darmstadt, D) wurden 100 µL Blank Plasma, Referenz oder Probe mit 300 µL 50 mM NH4HCO3 (pH 8.0) und entweder 100 µL Pronase-Lösung (60 mg/mL in 50 mM NH4HCO3) oder 100 µL Proteinase K-Lösung (20 mg/mL in 50 mM NH4HCO3) zur Proteolyse (2 h, 37°C) gemischt. Anschließend erfolgte UF (10 min bei 10.270 x g, 15°C) und die Filtrate wurden 1:3 mit d3-Atr-Lösung (3 ng/mL in 0,5 vol% Ameisensäure) verdünnt, um sie mittels micro Flüssigchromatografie-Elektrospray Ionisation hoch-auflösender Tandem-Massenspektrometrie (µLC-ESI MS/HR MS) zu analysieren.
Plasmaprobenvorbereitung zur Produktion von AE230*VSKL und LQQC34*PFEDHVKL
In einem UF-Gefäß (siehe oben) wurden 100 µL Blank Plasma, Referenz oder Probe mit 50 µL 10 vol% Ameisensäure und 100 µL Pepsin-Lösung (2 mg/mL in 10 vol% Ameisensäure) zur Proteolyse (1 h, 37°C) gemischt. Nach UF (10 min bei 10.270 x g, 15°C) wurden die Retentate zwei Mal mit 100 µL 5 vol% Ameisensäure gewaschen. Die vereinigten Filtrate wurden 1:3 mit d3--Atr-Lösung (3 ng/mL in 0.5 vol% Ameisensäure) verdünnt und über µLC-ESI MS/HR MS analysiert.
Plasmaprobenvorbereitung zur Produktion von derivatisierten Thiodiglykol
Plasma (1 mL) wurde mit 75 μl 1 M Perchlorsäure zur Proteinfällung und dann mit 15 μl 1 M Kaliumacetat-Lösung vermischt und zentrifugiert (10 min, 25.000 x g). Das Proteinpellet wurde getrocknet, mit 1 mL 1 M NaOH (2 h bei 75°C) zur Ablösung des Thiodiglykols (TDG) versetzt und anschließend mit 75 μL HCl (37 % w/v) vermischt. Thiodipropanol (TDP) wurde als interner Standard (10 μL, 1 µg/mL in Acetonitril zugegeben. Nach Festphasen-Extraktion (EASY Chromabond cartridge, 1 mL, 30 mg, -Macherey & Nagel, Düren, D) wurden dem Eluat (500 µL Acetonitril) 50 μL Heptafluorbuttersäureanhydrid (HFBA) zugegeben, um bei 50°C für 30 min reagieren zu lassen. Danach erfolgte der Zusatz von 1,4 mL phosphat-gepufferter Kochsalzlösung (0,025 M Na3PO4, 0,125 M NaCl, pH 7.4). Zur flüssig-flüssig Extraktion des derivatisierten TDG und TDP wurden 3 mL Chloroform hinzugegeben. Die organische Phase wurde auf 500 µL konzentriert und mittels Gaschromatografie-Massenspektrometrie (GC-MS) analysiert.
µLC-ESI MS/HR MS Analysen
Zum Peptid-Addukt Nachweis wurde ein µLC System (microLC 200, Eksigent Technologies, Dublin, CA, USA) mit einem hoch-auflösenden Massenspektrometer (TT5600+, ABSciex, Darmstadt, D) eingesetzt. Die Trennung der Proteolysegemische wurde über eine Atlantis T3 C18 Säule (50 x 1 mm I.D., 3 µm, 100 A, Waters, Eschborn, D) bei 60°C mit einem Fluss von 30 µL/min und Acetonitrilgradienten vorgenommen.
Die Detektion erfolgte unter optimierten Bedingungen im Tandem-MS Modus, um charakteristische Produktionen der vier Peptid-Addukte C34*P, C34*PF, AE230*VSKL und LQQC34*PFEDHVKL aufzuzeichnen. Nähere technische Details sind der Arbeit von JOHN et al. zu entnehmen [3].
GC-EI MS Analysen
Das durch HFBA derivatisierte TDG und TDP wurde mit einen Gaschromatographen (HP 7890, Agilent Technologies, Waldbronn, D) über eine Optima 5-MS Accent -Säule (30 m x 0,25 mm I.D., 0,5 µm Filmdicke, Macherey & -Nagel) mit Helium als Trägergas und anschließender Elektronenionisation (70 eV) und Massenspektrometrie (HP 5975 MSD, Agilent Technologies) selektiv detektiert [3].
Plasmaproben von potenziellen HD-Vergiftungopfern
Nach einem Mörserangriff im Sommer 2015 in einem Krisengebiet des Nahen Osten wurde die Freisetzung von HD vermutet. Sieben Personen, die sich nahe der Einschlagstelle aufhielten, waren potenziell exponiert. Unmittelbar nach dem Einschlag klagten einige Personen über Übelkeit und Erbrechen, Irritationen an Haut und Augen, bekamen Durchfall und spürten Schmerzen im oberen Respirationstrakt. Später entwickelten sich Hautrötungen und Blasen auf der Haut. Nach 15 Tagen wurden im Zuge der ärztlichen Behandlung Blutproben genommen. Zu diesem Zeitpunkt litten noch immer vier Personen unter Hautläsionen, Pigmentierungsveränderungen, schmerzenden Wunden, Atemproblemen und Tränenfluss. Die drei anderen Personen zeigten weder unmittelbar nach dem Angriff noch zu späterer Zeit -irgend-welche Vergiftungssymptome. Die Blutproben und Fotos wurden mit Zustimmung der Personen zur weiteren Analyse genommen und ins InstPharmToxBw gebracht.
Ergebnisse und Diskussion
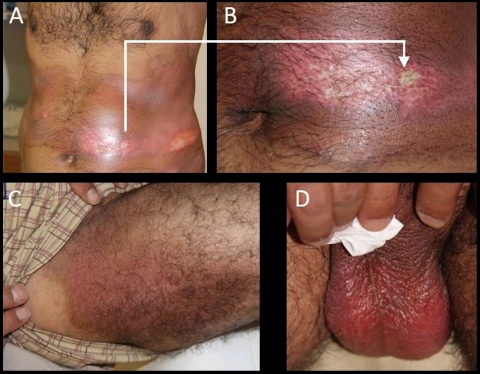
Auch 15 Tage nach Exposition zeigten 4 der 7 Personen starke Hautläsionen. Exemplarisch sind diese in Abbildung 3 gezeigt. Auffällig sind die weißen Areale (Abbildung 3A und B), auf denen zuvor Blasen gewesen waren. Starke Erytheme fanden sich bei den illustrierten Personen beispielsweise am Skrotum (Abbildung 3D), dem Oberschenkel (Abbildung 3C) und der Hüfte (Abbildung 3A, B). Diese Symptome sind typisch für die perkutane Vergiftung mit HD. Daher wurden Blutproben genommen und zur biomedizinischen Aufklärung analysiert.
Biomedizinische Verifikation der HD-Vergiftung
Zur Verifikation einer HD-Vergiftung müssen HD-spezifische Biomarker in biologischen Matrizes wie Blut, Plasma, Urin oder Gewebe nachgewiesen werden. Bei diesen Markern kann es sich um das Gift selbst, sein Hydro-lyseprodukt TDG und seine enzymatischen Biotransformationsprodukte 1,1′-Sulfonylbis-[2-(methylsulfinyl)ethan] (SBMSE) und 1-Methylsulfinyl-2-[2-(methylthio) ethylsulfonyl] ethan (MSMTESE) handeln [2]. Letztere sind im Urin zugänglich. Der wesentliche Nachteil dieser Marker jedoch besteht in ihrer kurzen Verweilzeit von nur wenigen Tagen im lebenden Organismus. Die vorliegenden Proben wurden jedoch erst 15 Tage nach potenzieller Exposition genommen. Somit musste nach Biomarkern gesucht werden, die eine deutlich längere Halbwertzeit besitzen.
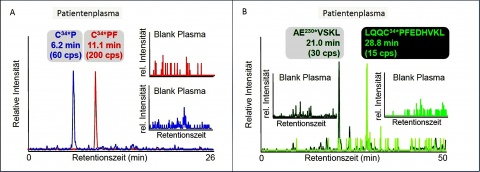
Die HD-HSA-Addukte sind nachgewiesenermaßen für mehr als 3 Wochen stabil [11]. Daher wurden die Proben zuerst auf die Präsenz des aus HSA gebildeten alkylierten Dipeptides (C34*P) [8-11] sowie des Tripeptides (C34*PF) [3-7] untersucht (Abbildung 2). Bei allen Patienten, die zum Blutentnahmezeitpunkt noch erkennbare Hautläsionen zeigten, verlief dieser selektive und sensitive Nachweis mittels µLC-ESI MS/HR MS für beide Peptide positiv. Exemplarisch zeigt Abbildung 4A das eindeutige Auftreten der Peaks für C34*P (Retentionszeit, tR, 6,2 min) und C34*PF (tR 11,1 min). Unbelastete Plasmaproben (Blank Plasma), die nicht mit HD in Kontakt gekommen waren, zeigten erwartungsgemäß keine Interferenzen (Abbildung 4A). Allein der Nachweis dieser beiden etablierten Biomarker galt nach den Kriterien der OVCW schon als eindeutiger Beleg für die HD-Vergiftung.
Zur steten Erweiterung des Methodenspektrums wurde aber zudem in den Realproben nach neuen Biomarkern gesucht, die sich durch die Protease Pepsin aus alkyliertem HSA generieren lassen (Abbildung 2). In Übereinstimmung mit in vitro Proben, bei denen nur Plasma mit HD versetzt worden war, ließen sich die beiden alkylierten Peptide AE230*VSKL (tR 21,0 min, Abbildung 4B) und LQQC34*PFEDHVKL (tR 28,8 min, Abbildung 4B) detektieren (Abbildung 2). Im Gegensatz zu den bisherigen etablierten Markern, die alle einen alkylierten Cys34*-Rest tragen, beinhaltet das Hexapeptid AE230*VSKL einen alkylierten Glutaminsäure-Rest. Wenngleich eine solche Veresterung von sauren Aminosäureseitenketten prinzipiell schon bekannt war, gab es bislang noch keinen Biomarker, der diese chemische Modifikation nutzte. Durch massenspektrometrische Analyse mit modernem hoch-auflösendem Flugzeit-Massenanalysator konnte die Identität beider Substanzen zweifelsfrei belegt und berichtet werden [3]. Diese beiden Biomarker wurden noch nie zuvor zum Beleg einer HD-Vergiftung genutzt. Sie konnten aber eindeutig und ohne Interferenzen in den Plasmaproben all der Patienten gefunden werden, die Hautläsionen zeigten (Abb. 4B). Somit waren die Resultate der Analysen kongruent für die beiden etablierten Biomarker (C34*P und C34*PF) wie auch für die beiden neuen Marker (AE230*VSKL und LQQC34*PFEDHVKL). Alle erforderlichen Qualitätskriterien, die von der OVCW für biomedizinische Verifikationsanalytik erhoben werden, wie beispielsweise die Übereinstimmung von Referenz-substanzen und Biomarkern aus der Probe hinsichtlich ihres chromatografischen und massenspektrometrischen Verhaltens, wurden einwandfrei erfüllt. Diese Qualitätsbelege verdeutlichten die besondere Eignung beschriebener Peptide als neue Biomarker einer HD-Exposition.
Der Vergleich der über alle positiv getesteten Plasmaproben gemittelten Intensitäten (Peakflächen) aller vier Peptidmarker ergab, dass das Tripeptid C34*PF am intensivsten vertreten und damit am besten nachweisbar war. Folgende relative Intensitätsverhältnisse mit Standardabweichung ließen sich finden [3]:
Trotz der graduellen Intensitätsunterschiede waren alle Peptide gut und eindeutig detektierbar und belegten die HD-Vergiftung.
Neben der Detektion der oben beschriebenen Peptid-Biomarker wurde noch ein weiteres etabliertes bioanalytisches Verfahren angewandt, um die HD-Inkorporation eindeutig zu belegen. Zu diesem Zweck wurde durch alkalische Hydrolyse TDG von endogenen Proteinen des Plasmas abgespalten und für die GC-MS Analyse derivatisiert. Die Detektion des TDG-Derivates gelang nur in zwei der vier zuvor positiv getesteten Personen (Daten nicht gezeigt), was vermutlich auf die limitierte Empfindlichkeit des GC-MS Verfahrens zurückzuführen war.
Zusammenfassung und Ausblick
Es ist gelungen, reale HD-Vergiftungen in Plasma durch Detektion der etablierten Peptid-Biomarker C34*PF und C34*P sowie durch derivatisiertes TDG zu beweisen. Zusätzlich wurde erfolgreich eine neue Methode entwickelt und etabliert, die es ermöglichte, die zwei neuen Peptid-Biomarker AE230*VSKL und LQQC34*PFEDHVKL nachzuweisen. Die Befunde, die auf diesen vier verschiedenen Biomarkern basierten, waren kongruent, sodass die Eignung und der Wert der neuen Marker unmittelbar dokumentiert wurden. Die zukünftige Forschung wird sich der Suche nach weiteren Markern widmen, um sowohl das Zeitfenster zu erweitern, welches zur Probennahme nach Exposition zu Verfügung steht, als auch um die Empfindlichkeit zu verbessern und die Anzahl möglicher Expositionsbiomarker zu vergrößern.
Kernsätze
- Eine potenzielle Vergiftung mit dem Hautkampfstoff Schwefellost (HD) wurde bioanalytisch durch Untersuchung von Plasma eindeutig bewiesen.
- Ein direkter Nachweis von HD ist schon wenige Tage nach Exposition nicht mehr möglich, da das Gift schnell im Körper umgesetzt und seine Biotransformationsprodukte ausgeschieden werden.
- Es wurden zwei etablierte und zwei neue Peptid--Biomarker detektiert, die spezifisch für eine HD-Vergiftung sind.
- Die Methoden zur Erfassung der neuen Biomarker erfüllten alle von der Organisation für das Verbot Chemischer Waffen (OVCW) geforderten Qualitätskriterien.
- Durch Pepsin werden aus dem alkylierten humanen Serumalbumin ein Hexa- (AE230*VSKL) und ein Dodecapeptid (LQQC34*PFEDHVKL) generiert.
- InstPharmToxBw konnte somit als designiertes Labor der OVCW (eines von weltweit nur 17 Laboren) für biomedizinische Verifikation sein Kompetenzspektrum erweitern.
Literatur
- Gandor F, Gawlik M, Thiermann H, John H: Evidence of sulfur mustard exposure in human plasma by LC–ESI–MS-MS detection of the albumin-derived alkylated HETE–CP dipeptide and chromatographic investigation of its cis/trans isomerism. J Anal Toxicol 2015; 39: 270-279.
- John H, Balszuweit F, Kehe K, Worek F, Thiermann H: Toxicokinetic aspects of nerve agents and vesicants. In: Gupta R (ed) Handbook of toxicology of chemical warfare agents, 2nd edn. Academic Press/Elsevier, Amsterdam, 2015; mpp 817-856.
- John H, Koller M, Worek F, Thiermann H, Siegert M: Forensic evidence of sulfur mustard exposure in real cases of human poisoning by detection of diverse albumin-derived protein-adducts Arch Toxicol 2019 (in press); DOI 10.1007/s00204-019-02461-2.
- John H, Siegert M, Gandor F, Gawlik M, Kranawetvogl A, Karaghioshoff K, Thiermann H: Optimized verification method for detection of an albumin-sulfur mustard adduct at Cys34 using a hybrid qua-drupole time-of-flight tandem mass spectrometer after direct plasma proteolysis. Toxicol Lett 2016; 244: 103-111.
- John H, van der Schans MJ, Koller M, Spruit HET, Worek F, Thiermann H, Noort D.: Fatal sarin poisoning in Syria 2013: forensic verification within an international laboratory network. Forensic Toxicol 2018; 36: 61-71.
- John H, Willoh S, Hörmann P, Siegert M, Vondran A, Thiermann H: Procedures for analysis of dried plasma using microsampling devices to detect sulfur mustard-albumin adducts for verification of poisoning. Anal Chem 2016; 88: 8787-8794.
- Noort D, Hulst A, de Jong L, Benschop H: Alkylation of human serum albumin by sulfur mustard in vitro and in vivo: mass spectrometric analysis of a cysteine adduct as a sensitive biomarker of exposure. Chem Res Toxicol 1999; 12: 715-721.
- OPCW (2015): Report of the OPCW fact-finding mission in Syria regarding alleged incidents in Marea, Syrian Arab Republic August 2015; S/1320/2015. https://www.opcw.org/sites/default/files/documents/Fact_Finding_Mission/s-1320-2015_e_pdf. Accessed 15 Dec 2018.
- OPCW (2017): OPCW fact-finding mission confirms use of chemical weapons in Khan Shaykhun on 4 April 2017. https://www.opcw.org/media-centre/news/2017/06/opcw-factfinding-mission-confirms-use- chemical-weapons-khan-shaykhun-4. Accessed 15 Dec 2018.
- OPCW (2018) In response to persistent allegations of chemical weapon attacks in Syria, the OPCW Fact Finding Mission (FFM) was set up in 2014 “to establish facts surrounding allegations of the use of toxic chemicals, reportedly chlorine, for hostile purposes in the Syrian Arab Republic”. https://www.opcw.org/fact-finding-mission. Accessed 15 Dec 2018
- OPCW (2018) OPCW issues report on technical assistance requested by the United Kingdom, April 12, 2018. https://www.opcw.org/media-centre/news/2018/04/opcwe. Proofing issues-report-technical-assistance-requested-united-kingdom. Accessed 15 Dec 2018
- OPCW (2018) Statement by H.E. Ambassador Kenneth D. Ward permanent representative of the United States of America to the OPCW at the eighty-sixth session of the executive council, https://www.opcw.org/sites/default/files/documents/EC/86/en/ec86nat06_ e_.pdf. Accessed 15 Dec 2018
- Steinritz D, Striepling E, Rudolf KD, Schröder-Kraft C, Püschel K, Hullard-Pulstinger A, Koller M, Thiermann H, Gandor F, Gawlik M, John H.: Medical documentation, bioanalytical evidence of an accidental human exposure to sulfur mustard and general therapy recommendations. Toxicol Lett 2016; 244: 112-120.
Erklärung zum Interessenkonflikt: Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Bildquellennachweis
Abbildungen: Institut für Pharmakologie und Toxikologie der Bundeswehr
Zitierweise
John H, Koller M, Worek F, Thiermann H, Siegert M: Einsatz des Hautkampfstoffs Schwefellost im Nahen Osten: Neue Methoden zum Beweis der Vergiftung. WMM 2019; 63(7): 226-230.
Für die Verfasser
Regierungsdirektor Prof. Dr. Harald John
Institut für Pharmakologie und
Toxikologie der Bundeswehr
Neuherbergstraße 11, 80937 München
E-Mail: [email protected]
* Institut für Pharmakologie und Toxikologie der Bundeswehr, München
Datum: 02.09.2019