Optimierung der Angiogenese und Wundheilung von freien mikrovaskulären Transplantaten mittels endothelialer Progenitorzellen (EPC)
Einleitung
Die militärischen Konflikte der vergangenen 100 Jahre haben gezeigt, dass kampfhandlungsbedingte Verletzungen neben den Extremitäten in erster Linie zu fast 40 % den Kopf-Hals-Bereich betreffen (BELMONT et al., 2010). Diese häufig sehr schweren Defektverletzungen im Kopf-Hals-Bereich stellen neben der physischen auch eine extreme psychische Belastung für die betroffenen Kameradinnen und Kameraden dar.
Während derartige Verletzungen noch während der ersten beiden Weltkriege kaum oder nur unzureichend zu versorgen waren, konnten in den
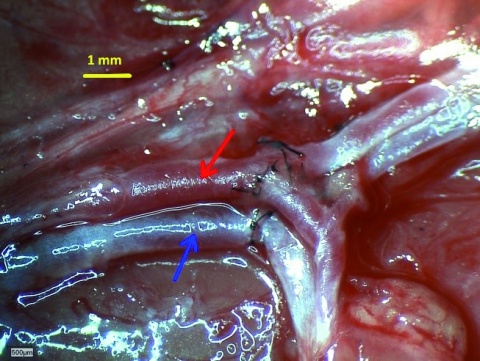
Hauptrisikofaktoren für einen Lappenverlust sind neben einer intraoperativen Überschreitung der Ischämiezeit des Transplantats, insuffizienten arteriellen und venösen Anastomosen sowie Thrombosen der zu- und abführenden arteriellen und venösen Transplantatgefäße vor allem Voroperationen, lokale Infektionen und schwere Traumata im Kopf-Hals-Bereich. Meist bietet die daraus resultierende Minderperfusion zusätzlich einen optimalen Nährboden für sekundäre Wundinfektionen, die mit weiteren prolongierten Hospitalisationsraten und persistierenden funktionellen Einbußen einhergehen und ebenfalls zu einem Verlust des Transplantats führen können. Eine beschleunigte und verbesserte Revaskularisation und damit Blutversorgung ist folglich als Schlüsselfaktor unabdingbar für eine optimale und suffiziente Transplantateinheilung sowie eine reduzierte Misserfolgsrate.
Ziel der Studie
Ziel dieser Studie war die Untersuchung des Einflusses von endothelialen Progenitorzellen (EPC) auf die Revaskularisation und Wundheilung mikrovaskulär anastomosierter Transplantate in einem Kleintiermodell (Ratte)[1], um dadurch neue Strategien zur Verbesserung der Erfolgsraten mikrovaskulärer Transplantate bei schweren einsatzbedingten Defektverletzungen im Kopf-Hals-Bereich zu entwickeln.
Stand der Forschung: Vorangegangene Studien untersuchten bereits den Einfluss verschiedener proangiogener Wachstumsfaktoren (z.B. VEGF[2], sowie eine Kombination aus bFGF[3]/PDGF[4]/VEGF) auf die Revaskularisation und Wundheilung von Schnitt- und Stanzwunden an normoglykämischen und diabetischen Mäusen. Es konnte gezeigt werden, dass eine kombinierte Präkonditionierung der Wunden mit bFGF/PDGF/VEGF zu einer signifikanten Verbesserung der Revaskularisation und Wundheilung im Sinne eines beschleunigten Wundverschlusses und eines verbesserten funktionellen Ergebnisses führte. Ebenso konnte durch die präoperative Vorbehandlung mit den genannten Faktoren eine signifikante Steigerung der Blutgefäßanzahl sowie eine Verbesserung der biomechanischen Stabilität der Wunden zu den verschiedenen Entnahmezeitpunkten erzielt werden (ACKERMANN et al. 2011).
ZAN et al. untersuchten den Einfluss von VEGF auf die Revaskularisation und Überlebensrate präfabrizierter Hautlappen (axial pattern flaps, gestielte
MÜCKE et al. konnten mit Hilfe eines Leistenlappenmodells (groin flap) an Ratten ebenfalls zeigen, dass verschiedene lokale Applikationsformen von VEGF nach postoperativem Ligieren des arteriellen Gefäßstiels und einer dadurch bedingten Ischämie einen positiven Einfluss auf die Perfusion, die Vaskularisation und das Gesamtüberleben der Leistenlappen hatte (MÜCKE et al. 2011).
Limitierend war bislang allen diesen Studien gemeinsam, dass zum einen lediglich der Einfluss proangiogener Wachstumsfaktoren untersucht und diese zum anderen lediglich bei Wunden sowie gestielten Lappentransplantaten getestet wurden. Der Einfluss eines proangiogenen Primings auf freie Lappentransplantate mit dem wichtigen und kritischen Faktor der Gefäßanastomosen wurde bislang nicht untersucht.
Im Gegensatz zu proangiogenen Wachstumsfaktoren könnten EPCs außerdem einen signifikant höheren proangiogenen Effekt hervorrufen und sind daher für die wehrmedizinische Forschung von besonderem Interesse.
Material und Methoden
Zwölf Wochen alte, männliche Ratten (Sprague Dawley; n=24) wurden in zwei Gruppen A und B zu je 12 Tieren randomisiert. Am OP-Tag (Tag 0) wurde bei jedem der Tiere in der Regio pectoralis ein freier mikrovaskulärer Pectoralis-Hautlappen gehoben, der anschließend mittels End-zu-Seit Anastomosen an die A. und V. femoralis in der Regio inguinalis anastomosiert und dort eingebracht wurde. In der Kontrollgruppe A erfolgte unmittelbar postoperativ eine subkutane Applikation von NaCl und in der Versuchsgruppe B eine lokale subkutane Applikation von EPCs in den transplantierten Lappen.
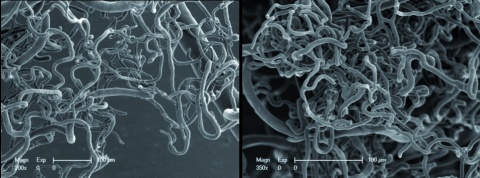
Am 7. post-OP Tag wurden die Tiere getötet. Bei je 6 Tieren aus jeder der Gruppen A und B erfolgte zunächst mittels einer anti-CD31 Immunhistologie eine morphometrische Detektion der Gefäßanzahl, -größe und -dichte in den Transplantaten. Bei den restlichen 6 Tieren aus jeder der Gruppen A und B erfolgt die 3D-Darstellung der mikrovaskulären Gefäßarchitektur in den Transplantaten mittels eines Microvascular Corrosion Castings[5] in Kombination mit 3D-rasterelektronenmikroskopischen Aufnahmen.
Ergebnisse
Die immunhistologische Auswertung zeigte, dass die lokale EPC-Applikation (Versuchsgruppe B) im Vergleich zur Kontrollgruppe A nach 7 Tagen zu einer signifikanten Steigerung der Revaskularisation im Sinne einer erhöhten Gefäßanzahl, Gefäßgröße sowie Gefäßdichte geführt hat (p jew. <0,05). Diese Ergebnisse konnten in der 3D-rasterelektronenmikroskopischen Visualisierung der Microvascular Corrosion Casts bestätigt werden. Auch hier kam es durch die lokale EPC-Applikation nach 7 Tagen zu einer deutlich sichtbaren Steigerung der Gefäßanzahl, Gefäßgröße und Gefäßdichte im Vergleich zur Kontrollgruppe (siehe Abbildung 2).
Diskussion: Durch die Applikation endothelialer Progenitorzellen konnte die Revaskularisation und Wundheilung im murinen Kleintiermodell signifikant verbessert werden. EPCs könnten somit möglicherweise auch zur Verbesserung der Erfolgsraten mikrovaskulärer Transplantate bei schweren Defektverletzungen im Kopf-Hals-Bereich eingesetzt werden.
Literatur:
- Belmont PJ Jr. et al.: Epidemiology of Combat Wounds in Operation Iraqui Freedom and Operation Enduring Freedom: Orthopaedic Burden of Disease. J Surg Orthop Adv 2010; 19: 2 – 7.
- Belmont PJ Jr. et al.: Incidence and epidemiology of combat injuries sustained during “the surge“ portion of operation Iraqui Freedom by a U.S. Army brigade combat team. J Trauma 2010; 68: 204 - 210.
- Ackermann M et al.: Priming with a combination of proangiogenic growth factors improves wound healing in normoglycaemic mice. Int J Mol Med 2011; 27: 647 – 653.
- Ackermann M et al.: Priming with a combination of proangiogenic growth factors enhances wound healing in STZ-diabetic mice. Eur Surg Res. 2011; 47: 81-89.
- Zan T et al. Transplanted endothelial progenitor cells increase neovascularization of rat prefabricated flaps. J Plast Reconstr Aesthet Surg 2010; 63: 474 – 481.
- Mücke T et al.: The influence of different VEGF administration protocols on the perfusion of epigastric flaps in rats. Brit J Oral Maxillofac Surg 2011; 51: 555-562.
Vollständige Literatur beim Verfasser
Bildquelle: A. Pabst, Koblenz
Stabsarzt Dr. Dr. Andreas Pabst
Bundeswehrzentralkrankenhaus Koblenz
E-Mail: [email protected]
[1] Tierversuche genehmigt vom Landesuntersuchungsamt Rheinland-Pfalz (23 177 07/G 12-1-091)
[2] VEGF = Vascular Endothelial Growth Factor
[3] bFGF = basic Fibroblast Growth Factor
[4] PDGF = Platelett Derived Growth Factor
[5] Verfahren zur Darstellung von Mikrogefäßen durch Injektion von Harzen und anschließende Mazeration des Gewebes
Datum: 09.12.2016
Quelle: Wehrmedizinische Monatsschrift 2016/11










