REGENERATION DER DENTALEN PULPA
Wurzelkanalbehandlung heute Der menschliche Zahn ist, bei genauerer Betrachtung, ein komplexes kleines Organ, zusammengesetzt aus verschiedenen Hart- und Weichgeweben. Die mineralisierten Gewebe – Schmelz, Dentin und Zementum – umschließen dabei das Weichgewebe der dentalen Pulpa.
Über eine Öffnung am Apex steht dieses mit den umliegenden Gewebestrukturen in Verbindung. Entwicklungsgeschichtlich sind Pulpa und Dentin eng miteinander verbunden, da nach erfolgter Zelldifferenzierung ektomesenchymaler Zellen zu sogenannten Odontoblasten diese Zellen beginnen, Dentin zu bilden und somit das Weichgewebe oder Endodont einzumauern. Dabei hinterlässt jeder Odontoblast einen Zellfortsatz im Dentin, welches dadurch bedingt eine tubuläre Struktur aufweist. Aufgrund dieser engen Verbindung sprechen wir auch vom Pulpa-Dentin-Komplex, und Dentin ist, ähnlich dem Knochen, als vitales Gewebe zu sehen. Wird aufgrund von äußeren Einflüssen, meist Karies oder Trauma, der schützende Hartgewebsmantel teilweise zerstört, kommt es über das Eindringen von Bakterien sowie deren Toxinen zur Entzündungsreaktion im Pulpagewebe, welche bei fortdauernder und übermäßiger Reizeinwirkung oder ausbleibender therapeutischer Intervention zur Gewebszerstörung und Nekrose führt.
Das Ziel der endodontischen Therapie besteht nun darin, irreversibel geschädigtes oder nekrotisches Pulpagewebe zu entfernen, die Zahl der Bakterien im Wurzelkanalsystem durch ausreichende Desinfektion zu dezimieren und den entstehenden Hohlraum anschließend mit einem Wurzelfüllmaterial zu verschließen. Dadurch soll eine weitere Ausbreitung von Mikroorganismen verhindert werden, eine Ausheilung der beteiligten Gewebsstrukturen ermöglicht und der Zahn möglichst langfristig in der Mundhöhle erhalten werden. Als Wurzelkanalfüller dienen hierbei synthetische Materialien, zumeist Guttapercha in Kombination mit einem härtenden Sealer. Dadurch ist in über 90% der Fälle ein Zahnerhalt möglich (Fleming CH et al. 2010), jedoch geht mit dem Verlust des Endodonts auch dessen Funktion verloren, darunter die Innervation und Befeuchtung des Dentins, die immunologische Abwehrleistung sowie die Bildung von Reizoder Reparaturdentin.
Der Erhalt einer vitalen Pulpa ist insbesondere bei jugendlichen Zähnen mit nicht abgeschlossenem Wurzelwachstum äußerst kritisch, da mit deren Verlust, meist nach Trauma, auch das Wurzelwachstum zum Erliegen kommt. Dabei erschwert der weit offene Apex mit dünn auslaufenden, frakturanfälligen Dentinwänden die suffiziente Wurzelkanalfüllung erheblich. Das bisher geläufige Therapiekonzept der Apexifikation, durch welche im apikalen Bereich eine Hartgewebsbarriere induziert werden soll, ist zeitaufwändig und führt auch bei erfolgreichem Abschluss zumeist zwar zu einer Verdickung der Dentinwände, nicht jedoch zu einer Zunahme des Wurzellängenwachstums.
Durch die rasche Entwicklung regenerativer Strategien im Bereich des Tissue Engineering gibt es jedoch mittlerweile Bestrebungen, Neuerungen auch in der Zahnheilkunde gewinnbringend anzuwenden. Derzeit wird aktiv an der Entwicklung von Verfahren geforscht, durch welche zukünftig die Wurzelkanalbehandlung in der heutigen Form zumindest in ausgewählten Fällen durch regenerative Verfahren verdrängt werden könnte.
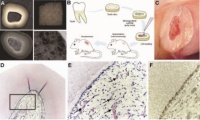
Abb. 1: Tissue Engineering der dentalen Pulpa. (A) Zahnscheibe und Trägermaterial aus PLLA. Das Scaffold (Trägermaterial) wird zugeschnitten und in die Pulpakammer eingebracht. Auf das poröse Material werden anschließend die Zellen gesät. (B) Schematische Darstellung des Vorgehens. (C) Zahnscheibe in situ vier Wochen nach Transplantation. (D) Zahnscheibe und neu gebildetes Gewebe in der Übersicht nach histologischer Färbung (HE). (E) Vergrößerte Abbildung von (D). Lockeres Bindegewebe und Blutgefäße (Pfeile) sind erkennbar. (F) Die dem Dentin angelagerten Zellen exprimieren Dentin Sialoprotein (Dsp), ein odontoblastenspezifisches Protein. Immunhistochemischer Nachweis von Dsp. Aus: Cordeiro MM, Dong Z, Kaneko T, Zhang Z, Miyazawa M, Shi S, Smith AJ, Nör JE. Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth. J Endod 2008; 34: 962-969.
Regeneration und Tissue Engineering
Die beiden Begriffe Regeneration und Tissue Engineering sind voneinander abzugrenzen. Regeneration bezeichnet die Fähigkeit des Organismus, verlorengegangenes oder verletztes Gewebe zu ersetzen und die Gewebefunktion wiederherzustellen. Hierbei wird eine Restitutio ad integrum erreicht. Im Gegensatz dazu ist das Tissue Engineering ein hochgradig interdisziplinärer Wissenschaftsbereich, welcher vor 25 Jahren definiert wurde als „... die Anwendung der Prinzipien und Methodik der Ingenieur- und Lebenswissenschaften zur Erlangung eines fundamentalen Verständnisses der Beziehung zwischen Struktur und Funktion in physiologischen und pathologisch veränderten Geweben, welches der Entwicklung biologischer Ersatzgewebe dienen kann, um die Organfunktion wiederherzustellen, zu erhalten oder zu verbessern…“ (Skalak R / Fox CF 1988). Dem Tissue Engineering liegt das Konzept zugrunde, (Stamm)Zellen mit einem geeigneten Trägermaterial zu kombinieren und mit Hilfe von Wachstumsfaktoren Zelldifferenzierung und Gewebebildung zu induzieren. Postnatale Stammzellen zum Einsatz in der regenerativen Medizin können mittlerweile aus einer Vielzahl von Geweben isoliert werden (Van Blitterswijk 2008). Dreidimensionale Zellverbände werden entweder direkt in den Wirtsorganismus transplantiert oder zunächst in Zellkultur zur Gewebebildung gebracht und anschließend in den Körper transplantiert. Mit Hilfe des Tissue Engineering können derzeit bereits verschiedenste Gewebe gezüchtet werden; hierzu gehören Blutgefäße, Haut, Knochen und Knorpel, Strukturen des Nervensystems, aber auch Organsysteme wie Trachea, Blase, Darm oder Pankreas (Van Blitterswijk 2008). Als Träger steht eine Vielzahl an natürlichen und synthetischen Materialien zur Verfügung, die je nach Anwendungsbereich spezifisch ausgewählt werden können. Während natürliche Materialien wie Fibrin, Kollagen oder zellfreie Extrazellulärmatrix der physiologischen Umgebung der Zellen eher entsprechen, bieten synthetische Biomaterialien den Vorteil, Parameter wie Molekulargewicht der Ausgangssubstanz, Steifigkeit, chemische Zusammensetzung oder Bioabbaubarkeit genau kontrollieren zu können. Wachstums- und Differenzierungsfaktoren spielen für das Tissue Engineering eine zunehmende Rolle, und gewebsspezifische Signalmoleküle können mit dem Trägermaterial in situ gebracht werden. Dabei werden zunehmend Mechanismen entwickelt, welche eine Einbindung und verzögerte und kontrollierte Freisetzung dieser Faktoren ermöglichen. Seit der Isolation dentaler Stammzellen aus der Pulpa von bleibenden Zähnen (Gronthos S et al. 2000) im Jahre 2000 wurde auch im Bereich der Zahnheilkunde vermehrt daran geforscht, diese Zellen für regenerative Zwecke einzusetzen. Diese Stammzellen, welche nur einen geringen Prozentsatz der Gesamtpopulation der Pulpazellen ausmachen, können mittels verschiedener Verfahren herausselektiert werden. Bei Gewebeschädigung mit Verlust dentinbildender Odontoblasten wie bei der exponierten Pulpa vermitteln diese Zellen Regeneration und Heilung. Angelockt von chemotaktischen Signalmolekülen, welche im entzündeten Gewebe freigesetzt werden, können sie migrieren, sich am Ort des entzündlichen Geschehens teilen und vermehren und zu dentinbildenden Zellen differenzieren. Es kommt zur Ausbildung einer Hartgewebsbrücke, welche als aktive Abwehrleistung der Pulpa zur Abgrenzung gegenüber Noxen oder Bakterien zu werten ist. Im Umgang mit dentalen Pulpastammzellen wurde deren Potential zur Differenzierung in verschiedene andere Gewebe nachgewiesen, darunter Knorpel, Knochen, Muskel- und Fettgewebe (Gronthos S et al. 2000; Miura M et al. 2003). Somit besteht die berechtigte Hoffnung, diese Zellen gewinnbringend zur Regeneration der dentalen Pulpa einsetzen zu können.
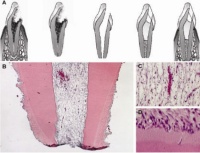
Abb. 2: (A) Schematische Darstellung des Vorgehens: Trepanation, Extraktion, Wurzelkanalaufbereitung und Apexektomie, Füllen des Wurzelkanals mit Trägermaterial und Zytokin (koronal) und mit Trägermaterial und Stammzellen (apikal), Replantation. (B) Histologische Darstellung der Gewebeneubildung nach vier Wochen. (C, D) Die höhere Vergrößerung zeigt Blutgefäße und die dem Dentin angrenzenden Zellen. Aus: Nakashima M, Iohara K. Regeneration of dental pulp by stem cells. Adv Dent Res 2011; 23: 313-319.
Pulparegeneration in der Forschung
Bereits vor der Isolation dentaler Pulpastammzellen wurden erstmals Versuche zur Züchtung von Pulpagewebe in vitro durchgeführt, wobei Pulpafibroblasten auf verschiedene Trägermaterialien aufgebracht wurden. Nach 60 Tagen hatte sich auf einem Polyglykolsäurenetz ein dreidimensionaler Zellverband gebildet, während Kollagen- und Alginat- Träger für das Zellwachstum weniger geeignet schienen (Mooney DJ et al. 1996; Bohl KS et al. 1998). Mittlerweile werden zunehmend vielversprechende Berichte zur Pulparegeneration publiziert. Mittels eines Zahnscheibenmodells konnte in einer aufsehenerregenden Publikation gezeigt werden, dass die Züchtung dentalen Pulpengewebes möglich ist (Cordeiro MM et al. 2008) (Abb. 1). Pulpastammzellen aus Milchzähnen wurden in einem Polylactid-glycolid (PLGA)-Trägermaterial in die leere Pulpakammer der Scheiben eingebracht. Diese wurden bei immundefizienten Mäusen für einen Zeitraum von 4 Wochen subkutan transplantiert. Nach dieser Zeitspanne hatte sich innerhalb der Dentinscheibe ein vaskularisiertes, pulpenähnliches Gewebe gebildet. Die dem Dentin anliegenden Zellen waren zu Odontoblasten differenziert und exprimierten das dentinspezifische Dentin Sialoprotein (Dsp).
Des Weiteren konnte nachgewiesen werden, dass die Zellen neues, tubuläres Dentin an die bestehende Dentinwand der Zahnscheibe absonderten. Der Nachweis der Dentinbildung gelang mittels einer Serie von Tetrazyklin-Injektionen, welche bei den Versuchstieren als Linien nachweisbare Störungen der Hartsubstanzbildung hervorrufen. Diese Linien waren an den Zähnen der Versuchstiere sowie an den implantierten Zahnscheiben nachweisbar (Sakai VT et al. 2010). Ähnliche Versuche wurden mit dentalen Pulpastammzellen in PLGA durchgeführt, wobei jedoch anstatt der Zahnscheiben Dentinzylinder verwendet wurden. Diese wurden auf einer Seite mit einem bioaktiven Zement (MTA) verschlossen, was die Situation im Wurzelkanal imitieren sollte. Vier Wochen nach subkutaner Transplantation waren auch hier pulpaähnliches Gewebe und Dentinbildung nachweisbar (Huang GT et al. 2010). Eine japanische Arbeitsgruppe entwickelte ein Versuchsmodell am Hund, wobei in diesem Fall eine angiogene Subpopulation von dentalen Pulpastammzellen anhand von Oberflächenmarkern aus der Gesamtzellpopulation herausselektiert wurde. In einer ersten Versuchsreihe wurde an Hundezähnen eine Pulpotomie bis zum Pulpakammerboden durchgeführt. Der Hohlraum wurde daraufhin mit angiogenen Pulpastammzellen in einem Kollagen-Trägermaterial gefüllt und koronal verschlossen. Bereits 14 Tage später war Gewebeneubildung nachweisbar, und nach 60 Tagen war die Pulpakammer mit vaskularisiertem Gewebe gefüllt, welches vom ursprünglichen Pulpagewebe nicht zu unterscheiden war (Iohara K et al. 2009). In einer Nachfolgearbeit wurden Zähne am Hund extrahiert, trepaniert, der Wurzelkanal aufbereitet, die Wurzelspitze um 1 mm gekürzt und die Öffnung am Apex auf 0,8 mm Durchmesser erweitert. Daraufhin wurde die apikale Hälfte des Wurzelkanals mit einem Kollagenträger und den Stammzellen gefüllt, der koronale Anteil mit Material ohne Zellen, aber beschickt mit dem chemotaktisch wirkenden Wachstumsfaktor SDF-1 (stromal cell-derived factor 1). Die Zähne wurden daraufhin replantiert, und nach 14 und 60 Tagen erfolgte die histologische Untersuchung der extrahierten Zähne. Wurzelkanal und Pulpakammer waren mit pulpaähnlichem Weichgewebe gefüllt (Nakashima M / Iohara K 2011) (Abb. 2). Mit immunhistochemischen Verfahren konnten Blutgefäße und sogar Nervfortsätze nachgewiesen werden. Diese Arbeiten zeigen auf eindrucksvolle Weise, dass die Regeneration der Pulpa nach Transplantation eines mit dentaler Stammzellen und Wachstumsfaktoren beladenen Trägermaterial prinzipiell möglich ist.
In eigenen Arbeiten beschäftigen wir uns insbesondere mit dem Trägermaterial. Während konventionelle Trägermaterialien wie Polyether (PLA, PGA) oder Kollagen für das Tissue Engineering prinzipiell gut geeignet sind, verfolgen wir die Strategie, mittels eines individualisierten, bioaktiven Trägermateriales Zellverhalten und -differenzierung zu optimieren. Ausgangsmaterial ist ein peptidbasiertes Hydrogel. Kurze Peptidmoleküle mit einer definierten Aminosäuresequenz können durch molekulare Selbstorganisation (Self-Assembly) nanofibröse Strukturen bilden, dadurch Wasser binden und Gele bilden.
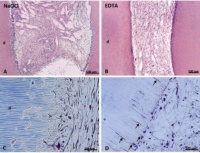
Zellen können problemlos in diese Hydrogele eingesät werden. Ausgehend von einer Peptidsequenz konnten diese durch Inkorporation einer enzymatisch spaltbaren Sequenz und eines Zelladhäsionsmotivs bioaktiv und bioabbaubar gestalten (Galler KM et al. 2010). Durch die Einbindung verschiedener Wachstumsfaktoren zur Stimulation der Gefäßeinsprossung und der Differenzierung der eingesäten Zellen wurde das Material weiter modifiziert. Dentale Pulpastammzellen wurden mit diesem bioaktiven Gel kombiniert, in Dentinzylinder eingebracht und subkutan bei immundefizienten Mäusen implantiert. Nach 5 Wochen konnte ein vaskularisiertes, pulpaähnliches Weichgewebe nachgewiesen werden (Galler KM et al. 2012). Die Vorbehandlung des Dentins war jedoch hierbei von Bedeutung: Dentinzylinder, welche zur Desinfektion für 10 Minuten in 5% Natriumhypochlorit gelagert wurden, zeigten eine Resorption des oberflächlichen Dentins durch die eingesäten Zellen. In einer zweiten Gruppe, in welcher das Dentin nach Desinfektion mit 17%igem EDTA oberflächlich demineralisiert worden war, fand Zelldifferenzierung entlang der Dentinwand statt. Die dem Dentin anliegenden Zellen exprimierten das dentinspezifische Dentin Sialoprotein. Des Weiteren erstreckten sich Zellfortsätze in die vorhandenen Dentintubuli (Abb. 3), so wie es physiologischerweise im Dentin vorzufinden ist. Hierfür ausschlaggebend ist die durch das EDTA ausgelöste Freisetzung von Wachstumsfaktoren, welche mit der Dentinbildung im Hartgewebe eingemauert werden und zu einem späteren Zeitpunkt durch Demineralisation mobilisiert werden können.
Abb. 3: Dentale Pulpastammzellen nach Einbringen in das bioaktive Hydrogel in Dentinzylindern und Implantation für fünf Wochen. (A, B) Niedrige Vergrößerung des neugebildeten Gewebes in Dentinzylindern nach Vorbehandlung mit NaOCl (links) oder EDTA (rechts). Während mit NaOCl Resorptionslakunen beobachtet werden, liegen die Zellen dem Dentin nach EDTA-Vorbehandlung eng an. (C, D) Die höhere Vergrößerung zeigt deutlich die Resorptionen. In EDTA-konditioniertem Dentin strecken die Zellen Fortsätze in das angrenzende Dentin.
Pulparegeneration in der Klinik
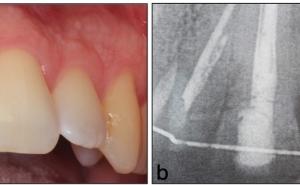
Parallel zu den vielversprechenden Ansätzen in der Forschung wurden in den letzten 10 Jahren klinische Fallberichte publiziert, welche eine Regeneration der Pulpa bei jugendlichen Zähnen mit nicht abgeschlossenem Wurzelwachstum beschreiben (Banchs F / Trope M 2004; Jung IY et al. 2008; Petrino JA et al. 2010). Nach erfolgter Desinfektion des Wurzelkanals ist dem klinischen Protokoll dieser Fälle die Provokation einer Einblutung gemeinsam. Nach Spülung des Wurzelkanals mit Natriumhypochlorit und Einbringen einer medikamentösen Einlage wurde in einer zweiten Sitzung durch mechanische Irritation oder Überinstrumentierung eine Einblutung in den Wurzelkanal erzeugt und der Zahn bakteriendicht verschlossen. Das Blutkoagel im Wurzelkanal dient hierbei als Leitschiene für die Geweberegeneration, welche ein Fortschreiten des Wurzelwachstums und eine Einengung des Wurzelkanals entsprechend dem physiologischen Ablauf ermöglicht. Dabei konnte sogar bei Fällen mit ausgeprägten periapikalen Läsionen mit der Zeit eine Ausheilung beobachtet werden. Genauere Kenntnisse der zugrundeliegenden Biologie lassen vermuten, dass es durch die Einblutung zugleich zur Einschwemmung von Stammzellen aus der apikalen Papille der sich bildenden Zahnwurzel kommt. Diese Zellen bilden im heranreifenden Zahn Wurzelpulpa und Wurzeldentin und können in dieser besonderen Situation auch Pulpagewebe regenerieren (Lovelace TW et al. 2011).
Obwohl diese Ansätze vielversprechend sind, liegen bis dato ungenügende Fallzahlen vor, welche für die Festschreibung klinischer Leitlinien nötig sind. Es werden jedoch derzeit klinische Studien durchgeführt, in welchen die vorhandenen Protokolle optimiert werden. Parallel dazu wird der Einfluss einzelner Parameter und Behandlungsschritte in vitro auf ihre Wirksamkeit getestet.
Aktuelle Ansätze
Zur Entwicklung neuer Therapieansätze zur regenerativen Endodontie ist eine Zusammenführung von Klinik und Forschung unerlässlich. Tiermodelle zeigen, dass es möglich ist, durch das Einbringen eines mit Pulpastammzellen beladenen Trägermaterials eine Regeneration der Pulpa zu erzielen. Die Transplantation von Stammzellen ist jedoch mit etlichen Problemen behaftet, hierbei sind insbesondere Entnahmezeitpunkt, Lagerung, in vitro Zellkultur und Rückführung in den Patienten zu nennen. Vorsichtigen Schätzungen zufolge würde sich demnach die Regeneration einer Zahnpulpa auf etwa 40 000 Euro beziffern. Vereinfachte und schnellere, nicht-invasive Verfahren zur Stammzellisolation könnten neue Wege eröffnen, es bleibt jedoch auch hierbei das Kosten-Nutzen Verhältnis abzuwägen.
Einfachere Verfahren wären mittels zellfreier Therapieansätze denkbar, wobei über bioaktive Trägermaterialien körpereigene ortständige (Stamm)Zellen rekrutiert und in den Wurzelkanal gelockt werden könnten. Durch die Einbindung chemattraktiver Signalmoleküle und bestimmter Wachstumsfaktoren könnten diese Zellen migrieren, proliferieren und differenzieren. Während die beschriebenen klinischen Protokolle Regeneration bewirken können und – wenngleich zunächst unbewusst - mit ortständigen Stammzellen arbeiten, folgen sie nicht dem Prinzip des Tissue Engineering. Der Einsatz optimierter, speziell für die Pulparegeneration maßgeschneiderter Biomaterialien könnte die Erfolgsquote regenerativer Therapien verbessern. Eine Ausdehnung solcher Therapieansätze auf Zähne mit abgeschlossenem Wurzelwachstum wäre wünschenswert. Bei reversibel entzündeter Pulpa könnte im Sinne einer Pulpotomie unbeschädigtes Gewebe belassen werden, welche einen Pool von Stammzellen beherbergt, von welchen Regeneration ausgehen kann. Hilfreich wäre hierbei die Entwicklung von Hilfsmitteln, welche klinisch eine Unterscheidung von reversiblen und irreversiblen Bereichen ermöglicht. Denkbar wären hierbei in der Dentinflüssigkeit vorhandene Entzündungsmarker. Erste Ansätze existieren bereits, es konnte gezeigt werden, dass in entzündlich verändertem Pulpagewebe eine Gewebsprotease, MMP-9, nachgewiesen werden kann (Zehnder M et al. 2011). Bei Zähnen mit abgeschlossenem Wurzelwachstum und gegebenenfalls periapikaler Läsion bleibt der zukünftige Einsatz regenerativer Verfahren fraglich. Es ist jedoch auch in diesen Fällen denkbar, durch Einwanderung von Zellen aus der periapikalen Region Gewebeneubildung zu erzielen. Die bisher gängigen Protokolle zur Wurzelkanalbehandlung werden hierbei voraussichtlich vom Behandler in abgewandelter Form zu bearbeiten sein.
Zusammenfassung und Fazit
Als häufigste endodontische Therapie zum Zahnerhalt wird die Wurzelkanalbehandlung einschließlich Obturation des Wurzelkanalsystems mittels eines synthetischen Materials standardmäßig durchgeführt. Neue Erkenntnisse aus Klinik und Forschung geben jedoch Grund zur Annahme, dass eine Regeneration der dentalen Pulpa im Sinne des Tissue Engineering möglich sein könnte. Ergebnisse aus dem Bereich der Grundlagenforschung zeigen, dass dentale Stammzellen nach Einsaat in ein geeignetes Trägermaterial Pulpagewebe und tubuläres Dentin bilden können. Klinische Fallberichte beschreiben ein Prozedere bei jugendlichen Zähnen mit nicht abgeschlossenem Wurzelwachstum, das nach Provokation einer Einblutung in den Wurzelkanal zur Regeneration der dentalen Pulpa mit Fortschreiten des Wurzelwachstums und sogar zur Ausheilung ausgedehnterer periapikaler Läsionen führen kann. Diese Entwicklungen lassen einen Paradigmenwechsel im Bereich der Endodontie erwarten, nach welchem regenerative Behandlungskonzepte in ausgewählten Fällen zunehmend in den klinischen Alltag Einzug halten könnten.
Datum: 17.09.2012
Quelle: Wehrmedizin und Wehrpharmazie 2012/2