Vorkommen von Bacillus cereus in Kaffeevollautomaten verschiedener Verpflegungs- und Betreuungseinrichtungen der Bundeswehr
Aus der Laborabteilung II, Veterinärmedizin, Mainz (Leiter Oberstveterinär Dr. Th. Reiche) des Zentralen Instituts des Sanitätsdienstes der Bundeswehr, Koblenz (Leiter: Oberstarzt Prof. Dr. D. Leyk)
B. Bovermann
Zusammenfassung
Einleitung: Die den Mischgetränken aus Kaffeevollautomaten zugesetzte Milch birgt das Risiko einer bakteriellen Kontamination, insbesondere mit dem toxinbildenden Bacillus (B.) cereus. Zur Abschätzung des Gefährdungspotenzials für die Nutzer sind Kenntnisse über das Vorhandensein dieses Erregers in den Automaten erforderlich.
Material und Methode: Der Milchanteil trinkfertiger Heißgetränke, eine Probe des verwendeten Topping-Pulvers aus der Kaffeemaschine sowie jeweils ein Originalgebinde des Toppings derselben Charge verschiedener Modelle von 22 Kaffeevollautomaten in 21 Verpflegungs- und Betreuungseinrichtungen der Bundeswehr wurden im Verlauf von zwei Monaten auf das Vorhandensein von B. cereus untersucht. Die mikrobiologische Untersuchung der Proben umfasste zum einen den kulturellen Nachweis möglicher B. cereus-Kolo-nien sowie deren Fähigkeit, die Enterotoxine Nhe und Hbl zu bilden. Zum anderen wurden die verschiedenen Lebensmittelmatrices direkt auf Vorhandensein der o. g. Bakterientoxine untersucht.
Ergebnisse: B. cereus fanden sich in allen drei Probenarten im Bereich von 101 bis 106 KbE/g. Die isolierten Keime konnten mindestens eines der beiden Enterotoxine bilden und auch in vier der untersuchten Lebensmittelmatrices konnte mindestens eines der Enterotoxine nachgewiesen werden. In den verschiedenen Heimbetrieben waren die trinkfertigen Heißgetränke mit B. cereus kontaminiert, während in den beprobten Truppenküchen lediglich in den Originalgebinden bzw. in den Toppings aus der Kaffeemaschine B. cereus nachweisbar war.
Diskussion/Schlussfolgerungen: Die Untersuchungsergebnisse lassen vermuten, dass B. cereus aufgrund seiner hohen Tenazität und Fähigkeit, Biofilme zu bilden, nicht nur ausschließlich in Lebensmitteln, sondern auch in mit diesen in Kontakt stehendem Küchenequipment vorkommt. Inwieweit dies ein tatsächliches gesundheitliches Risiko für den Verbraucher darstellt, muss durch weitere Untersuchungen geklärt werden. Kaffeevollautomaten in Verpflegungs- und -Betreuungseinrichtungen sollten in jedem Fall bei einer Risikoanalyse, z. B. im Zusammenhang mit lebensmittelbedingten Ausbruchsgeschehen, berücksichtigt werden. Präventiv ist die regelmäßige Durchführung von Reinigungs- und Desinfektionsmaßnahmen nach Herstellerangaben mit den entsprechend wirksamen Mitteln weiterhin unabdingbar.
Schlüsselworte: B. cereus-Intoxikation, Kaffeevollautomaten, Gefährdungspotenzial, lebensmittelbedingtes Ausbruchsgeschehen, Präventionsmaßnahmen
Summary
Background: Milk added to hot mixed drinks from fully automated coffee makers can be contaminated by toxin producing bacillus (B.) cereus. To estimate the potential risk for customers, information about the occurrence of this germ in these machines is needed.
Material and methods: Samples of the milk component of prepared hot drinks, the topping powder from the container inside the machine and from a new package of topping powder of the same charge were taken from 22 fully automated coffemakers used in 21 canteens and dining halls of the Bundeswehr. Microbiological examination was performed to proof the occurrence of B. cereus and its ability to produce enterotoxins Nhe and Hbl. Furthermore, the different samples were examined for presence of the above mentioned bacterial toxins.
Results: B. cereus was detected in all three types of samples in a concentration from 101 up to 108 cfu/g. The isolated germs were able to produce one or both of the two enterotoxins. In 4 samples at least a minimum of 1 enterotoxin was found. Ready to drink hot drinks prepared in smaller canteens showed contamination with b. cereus whereas in larger troops dining halls the bacillus only could be found in topping powder and not in drinks.
Discussion / conclusions: Regarding the results of this study that B. cereus – due to its high tenacity and its ability to produce a biofilm – will not only be found in food products but also in the equipment when in contact with contaminated food. To what extent this represents an actual health risk to the consumer requires further investigation. Nevertheless – fully automated coffeemakers should be taken into account as a possible source in case of an outbreak. As preventive measures, regular cleaning and disinfection procedures (in accordance with manufacturer specification) with effective detergents remain indispensable.
Keywords: intoxikation from B. cereus, fully automated coffeemakers, risk, food induced outbreak, prevention
Einleitung
„Heißgetränkebereiter“ (nach DIN) oder einfach „Kaffeevollautomaten“ bieten die Möglichkeit, verschiedene Kaffeespezialitäten oder Milch- bzw. Kakao-Mischgetränke zu wählen. Während schwarzer Kaffee keine mikrobiologischen Probleme erwarten lässt, ist durch den Zusatz von Milch als empfindliches Lebensmittel mit mikrobiologischen Gefahren während der Zubereitung bzw. Abgabe aus den Geräten zu rechnen. Je nach Bauart des jeweiligen Kaffeevollautomaten wird Milch als kühlpflichtige Vollmilch, H-Milch oder Milchpulver (Topping) in der Maschine bereitgestellt. Kaffeevollautomaten finden sich in Truppenküchen, Kantinen und Betreuungseinrichtungen und auch in Verpflegungseinrichtungen im Einsatz.
Um das Gefährdungspotenzial einer Kontamination mit dem Sporen- und Toxinbildner B. cereus abschätzen zu können, wurden Kaffeevollautomaten in Verpflegungs- und Betreuungseinrichtungen der Bundeswehr auf das Vorhandensein von B. cereus und dessen Toxinbildungsvermögen hin untersucht.
Material und Methoden
Im Zeitraum Oktober bis November 2015 wurden 22 Kaffeevollautomaten in 21 verschiedenen Verpflegungs- und Betreuungseinrichtungen in Rheinland-Pfalz, Nordrhein-Westfalen, Hessen und im Saarland untersucht.
Die Beprobung erfolgte jeweils im Anschluss an die gemäß den Herstellerangaben täglich durchzuführenden Reinigungsmaßnahmen der Geräte. Diese variieren in Abhängigkeit der Hersteller und des Gerätetyps, wobei z. T. auch verschiedene Reinigungsintervalle vorgegeben werden, wie nachfolgendes Beispiel für einen häufig verwendeten Gerätetyp zeigt:
- tägliche Reinigung (einschließlich Entleeren der Satzschublade) für alle Systeme (Brüh- und Instantsystem), die mindestens einmal benutzt wurden;
- Reinigung vor Inbetriebnahme, wenn die Maschine oder eines der Systeme länger als eine Woche nicht in Betrieb waren;
- monatliche Reinigung von Gehäuseteilen und Filtersieb im Frischwasserzulauf (falls vorhanden).
Für die tägliche maschinelle Reinigung ist nach Entleeren der Satzschublade das Reinigungsprogramm auszuwählen („Reinigen und Ausschalten“ zur Reinigung von Instant- und Brühsystem und anschließendem Ausschalten, „Zwischenreinigung“, wenn nach der Reinigung die Maschine weiter betrieben wird). Zur Reinigung einzelner Systeme kann man „Reinigen Brühsystem“ oder „Reinigen Instantsystem“ anwählen.
Für die tägliche Reinigung des Brühsystems beispielsweise erscheint in der Displayanzeige „Reinigungsmittel einwerfen“. Dazu ist es notwendig, eine vom Hersteller empfohlene Reinigungstablette (z. B. „Coffee Cleaner Tabs“) in den vorgesehenen Schacht einzuwerfen, das Reinigungsprogramm läuft dann automatisch ab. Zur täglichen Reinigung des Instantsystems ist es nötig, die Mixereinheiten auszubauen und diese entweder mit heißem Wasser und einem für Milchprodukte geeigneten Reiniger oder in der Spülmaschine zu reinigen. Anschließend sollte mit klarem Wasser nachgespült werden. Auf die gleiche Weise sollte die wöchentliche Reinigung des Instantbehälters erfolgen.
Probenmaterialien je Kaffeevollautomat waren
- Eine bis drei Proben des Milchanteils verschiedener Heißgetränke, abhängig vom Angebot milchhaltiger Getränke,
- eine Probe des Topping-Pulvers aus dem/den Behältern innerhalb des Kaffeevollautomaten sowie
- ein Originalgebinde derselben Charge (sofern vorhanden) des aktuell verwendeten Toppings.
Die Probenentnahme des Topping-Pulvers aus dem Kaffeevollautomaten erfolgte mit einem sterilen Löffel. Das Pulver wurde anschließend in ein ebenfalls steriles Gefäß gefüllt. Zur Entnahme des Milchanteils, wurde eine sterile 100 ml Glasflasche mit Schraubverschluss unter die entsprechende Auslass-Düse gestellt und ein Heißgetränk mit hohem Milchanteil (z. B. Milchkaffee) angewählt. Lediglich der Milchanteil wurde in dem Probenentnahmegefäß aufgefangen. Um die natürlichen Verbraucherbedingungen nachzuempfinden, wurde bewusst auf eine vorausgehende Desinfektion der Auslassdüse verzichtet.

Der Nachweis des Enterotoxinbildungsvermögen der Isolate erfolgte mittels GLISA-Schnelltest (Gold labelled Immuno Sorbent Assay, Handelsname Duopath® der Firma Merck). Hierbei handelt es sich um einen immunchromatographischen Screening- und Bestätigungstest mit gold-markierten Antikörpern zum Nachweis der beiden diarrhoeischen Enterotoxine Hbl (Hämolysin BL-Enterotoxin) und Nhe (Non-haemolytic Enterotoxin). Die Bestimmung von Cytotoxin K gehört noch nicht zur Routinediagnostik bei B. cereus [17]; da sich daraus für unsere Fragestellung auch keine zusätzlichen Informationen ergeben hätten, erfolgte sie nicht.
Für den Enterotoxinnachweis aus der Lebensmittelmatrix wurden 10 g bzw. 10 ml der entsprechenden Probe zusammen mit 90 ml CBY-Bouillon (Caseinhydrolysat-Bouillon mit 1 % Glucosezusatz) homogenisiert. Anschließend wurden 200 µl der homogenisierten Probe mit 2 ml CGY-Bouillon in einem 200 ml Erlenmayerkolben gemischt und für 18 - 24 h bei 36 ± 1 °C inkubiert.Entsprechend dem Toxinbildungsvermögen der aus der untersuchten Lebensmittelprobe isolierten und als B. cereus bestätigten Isolate wurden jeweils eine bis drei Einzelkolonien in 1 ml CGY-Bouillon überführt, gemischt und für 4 h bei 36 ± 1 °C inkubiert. Beide Probenansätze wurden vor dem Aufbringen auf die Testeinheit des Duopath® auf Raumtemperatur abgekühlt.
Die Testdurchführung und -auswertung erfolgte gemäß den Herstellerangaben.
Ergebnisse
Insgesamt wurden in 21 verschiedenen Verpflegungs-und Betreuungseinrichtungen in Rheinland-Pfalz, Nordrhein-Westfalen, Hessen und im Saarland Proben entnommen. Darunter fielen sowohl Truppenküchen, verschiedene Heimbetriebe, Kleinkantinen, Speiseausgabestellen und eine Krankenhaus-küche. Untersucht wurden insgesamt 88 Proben, davon 48 Heißgetränke und 23 Topping-Pulver aus 22 Kaffeevollautomaten, sowie 17 Originalgebinde der verwendeten Toppings auf das Vorhandensein von B. cereus. Abbildung 3 zeigt die Aufteilung der mit B. cereus kontaminierten Proben.
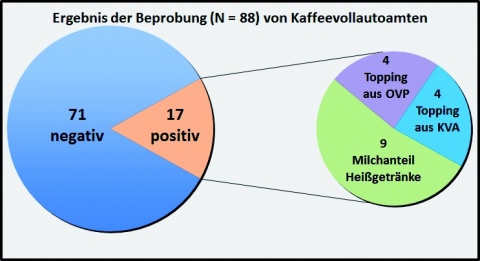
Diskussion
B. cereus
B. cereus ist nur einer von insgesamt sieben phylogenetisch voneinander nicht unterscheidbaren Spezies, die der sogenannten B. cereus-Gruppe zugeordnet werden. Die einzelnen Vertreter werden im Wesentlichen nach den durch sie verursachten Krankheiten unterschieden. Folgende Arten zählen zu der B. cereus--Gruppe (B. cereus sensu lato):
- B. cereus sensu stricto: fakultativ pathogener Erreger, Verursacher lebensmittelbedingter sowie lokaler und systemischer Erkrankungen;
- B. anthracis: obligat pathogener Erreger, Verursacher des Milzbrandes;
- B. thuringiensis: fakultativ pathogener Erreger, Verwendung als Biopestizid aufgrund der Produktion von insektiziden Toxinen; humanpathogener Krankheitserreger;
- B. mycoides, B. pseudomycoides, B. weihenstephanensis: psychrotolerante Lebensmittelverderbniserreger;
- B. cytotoxicus: •thermotoleranter Verursacher lebensmittelbedingter Erkrankungen.
B. cereus ist ein Gram-positives, bewegliches, fakultativ anaerobes Stäbchenbakterium, das durch seine Fähigkeit, Endosporen zu bilden, eine extrem hohe Tenazität besitzt. Die widerstandsfähigen Sporen sind unter anderem resistent gegenüber Trockenheit, Strahlung, extremen Temperaturen sowie pH-Wert-Schwankungen. Die vegetativen Keime sind durch die Ausbildung von Biofilmen zudem unempfindlich gegenüber verschiedensten Reinigungs- und Desinfektionsmitteln [11, 16]. Nicht nur die vegetative Form von B. cereus ist in der Lage, einen Biofilm zu bilden; ferner haben auch die Sporen ein enormes Oberflächenhaftungsvermögen. Selbst auf Edelstahl können sie über längere Zeiträume anhaften [8].
Vorkommen
B. cereus ist ein ubiquitär in der Umwelt vorkommender Keim, der unter anderem auch im Staub und im Erdboden zu finden ist. So ist es nicht unüblich, dass viele Lebensmittel pflanzlichen oder tierischen Ursprungs natürlicherweise eine geringe Kontamination mit dem Erreger bzw. dessen Sporen aufweisen. Nach Angaben der European Food Safety Authority (EFSA) ist eine geringe Kontamination unter 100 KbE/g nicht ungewöhnlich. In Folge dessen stellt ein Eintrag über das kontaminierte Ausgangsmaterial (z. B. Gewürze, Milchpulver) in andere Lebensmittel in solch einem geringen Maß kein gesundheitliches Risiko im Sinne des Verbraucherschutzes dar [8].
Pathogenität
Ein wichtiges Pathogenitätsmerkmal stellt das Toxinbildungsvermögen von B. cereus und die dadurch verursachten extraintestinalen sowie gastrointestinalen Erkrankungen dar. Diese Fähigkeit der Toxinbildung spielt eine bedeutende Rolle im Zusammenhang mit Lebensmittelinfektionen und -intoxikationen [3, 13, 25]. Grundsätzlich unterscheidet man zwei verschiedene Toxinformen: das diarrhoeische Toxin (Enterotoxin) und das emetische Toxin (Cereluid).
Zu den sogenannten Enterotoxinen oder diarrhoeischen Toxinen gehören das „Non-haemolytic Enterotoxin (Nhe)“, das „Hämolysin BL (Hbl)“ und das „Cytotoxin K“. Diese drei Toxine sind genetisch determiniert und werden nach Aufnahme des mit B. cereus kontaminierten Lebensmittels im Darm gebildet und freigesetzt. Das Nhe-Enterotoxin ist ein Komplex aus 3 unterschiedlich großen Proteinkomponenten, dessen Gene (nheA, nheB, nheC) auf einem Operon liegen. Für die maximale zytotoxische Aktivität, die durch Porenbildung letztlich zur Zelllyse führt, müssen alle drei Komponenten in einem bestimmten Verhältnis zueinander vorliegen [10, 15]. Über 90 % der B. cereus--Stämme sind in der Lage, das Nhe-Enterotoxin zu bilden [12, 24]. Das Hbl-Enterotoxin besteht ebenfalls aus drei Proteinkomponenten, deren Zusammenspiel für die zytotoxische Aktivität unabdingbar ist. Auch diese Gene (hblA, hblC, hblD) sind alle auf einem gemeinsamen Operon lokalisiert [19]. Genau wie das Nhe-Enterotoxin besitzt das Hbl-Toxin zytotoxische Wirkung in Form von Porenbildung, was ebenfalls eine Zell-lyse verursacht. Etwa 40 - 60 % der B. cereus-Stämme besitzen die Fähigkeit, Hbl-Enterotoxin zu produzieren [18]. Das Cytotoxin K wirkt als Einzelkomponente und besteht aus einem Protein, dessen Wirkung zytotoxisch, nekrotisierend und hämolytisch zu sein scheint. Derzeit sind die Varianten CytK1 und CytK2 bekannt. Bei 40 - 60 % der B. cereus Stämme ist diese Toxinbildung detektierbar [21]. Durch die Porenbildung der o. g. Enterotoxine kommt es unter anderem zu einem Verlust von Natrium- und Chlorid-Ionen, was zu einem Ungleichgewicht im Elektrolythaushalt und in Folge dessen zu einem erheblichen Flüssigkeitsverlust führt. Die Symptome, welche meist 8 - 16 Stunden nach Aufnahme des kontaminierten Lebensmittels auftreten, sind Übelkeit, Bauchkrämpfe und wässrige Durchfälle [20, 23]. Die maximale biologische Aktivität der Enterotoxine wird erst durch das kombinierte Zusammenwirken aller drei Komponenten erreicht. Um eine eindeutige Aussage über das tatsächliche enteropathogene Potenzial eines B. cereus Stammes treffen zu können, ist daher der Nachweis aller 3 Komponenten des Enterotoxin-Komplexes unerlässlich [16].
Stämme, die das emetische Toxin (Cereluid) bilden, sind im Gegensatz zu den Enterotoxin bildenden Keimen Intoxikationserreger. Zur Intoxikation kommt es, wenn eine ausreichende Toxinmenge bereits präformiert im Lebensmittel vorliegt. Das Toxin ist hitze-, säure- und proteolyseresistent sowie pH-stabil, was die Lebensmittelindustrie insbesondere im Rahmen der Lebensmittelprozessierung immer wieder vor erhebliche Probleme stellt [13]. So gestaltet sich beispielsweise eine Inaktivierung bzw. Eliminierung des Toxins, im Gegensatz zu den vegetativen Keimen, durch Erhitzungsprozesse, Entkeimungsfiltration oder Bactofugation als nicht wirksam [5]. Die Inkubation nach Aufnahme einer intoxikationsauslösenden Dosis zwischen 8 und 10 µg/kg Körpergewicht, ist mit 1 - 5 Stunden relativ kurz. Nach der Aufnahme des Toxins bindet dieses im Dünndarm an 5-HT3-Serotonin-Rezeptoren, was durch eine Stimulierung von Vagusafferenzen schließlich zum Erbrechen führt [1, 23].
In der Regel findet die für die Durchfallerkrankung bedeutsame Toxinproduktion bei den Enterotoxinen erst im Darm statt, d.h. es handelt sich um eine Intoxikation, für deren Auslöser ein mit einer ausreichenden Menge an B. cereus-Sporen oder vegetativen Zellen kontaminiertes Lebensmittel aufgenommen werden muss. In seltenen Fällen können die präformierten Enterotoxine bereits im Lebensmittel vorhanden sein, überstehen in der Regel jedoch die Magenpassage nicht.
Intoxikationsweg
Der größte Anteil der gemeldeten Ausbruchsgeschehen wurde im Zusammenhang mit der Außer-Haus-Verpflegung beschrieben. Als Ursachen wurden Fehler im Temperaturmanagement vorgekochter Speisen (z. B. zu langsames Abkühlen, nicht adäquat gekochte Speisen, zu langes Warmhalten, zu geringe Warmhaltetemperatur) angegeben. Im Bereich der Bundeswehr gibt es daher die Vorgabe der Heißhaltung von Speisen über 65 °C, um B. cereus-Sporen am Auskeimen zu hindern [2]. Das größte Problem stellt der Keim unbestritten im Bereich der Lebensmittelindustrie insbesondere im Bereich der Außer--Haus-Verpflegung dar. Hier stehen die lebensmittelbedingten Intoxikationen im Zusammenhang mit der Gemeinschaftsverpflegung durch Großküchen nach wie vor im Fokus.
Prävalenz
Nach § 7 des Infektionsschutzgesetzes (IfSG) zählt B. cereus nicht zu den meldepflichtigen Krankheitserregern in Deutschland. Daher findet ein Nachweis von B. cereus als Verursacher lebensmittelbedingter Erkrankungen meist nur im Rahmen von Ausbruchsgeschehen statt. Aufgrund dieser unzureichenden Datenlage lässt sich eine hohe Dunkelziffer nicht registrierter B. cereus-Intoxikationen vermuten. Auch wenn das Risiko einer durch B. cereus verursachten Erkrankung als gering eingeschätzt wird, sind durch den Keim bedingte Lebensmittel-Intoxikationen in den letzten Jahren dramatisch angestiegen. Die EFSA berichtete im Jahr 2011 über einen Anstieg der EU weit gemeldeten lebensmittelbedingten Ausbrüchen durch B. cereus-Toxine von 122,2 % gegenüber dem Vorjahr [9].
Bedeutung von B. cereus für die Bundeswehr
Ausbruchsgeschehen – insbesondere bei Einsätzen – können erhebliche Auswirkungen auf die Fähigkeit von Truppenteilen auf die Auftragserfüllung haben. Für bakteriell bedingte Infektionen/Intoxikationen spielen dabei Lebensmittel eine herausragende Rolle, während z. B. Noroviren als häufige Erreger gastrointestinaler Gruppenerkrankungen als Schmierinfektion über Toilettenanlagen, Armaturen an Waschbecken und/oder Türgriffe übertragen werden können [6]. KLEER et al. kamen bei epidemiologischen Untersuchungen gehäuft auftretender gastrointestinaler Symptome im Bereich der Bundeswehr in den Jahren 1994 - 1997 zu dem Ergebnis, dass 43 % der Einzelfälle und 52 % der Ausbrüche durch B. cereus bedingt waren im Wesentlichen über Verpflegungseinrichtungen verbreitet wurden [13]. Dieses korreliert mit den Ergebnissen von ERNST, der in den Jahren 1999 und 2000 Ausbrüche in 92 Verpflegungseinrichtungen der Bundeswehr in den Bundesländern Nordrheinwestfalen, Rheinland-Pfalz, Hessen und Saarland insgesamt 4 412 Oberflächenproben in Zubereitungs- und Ausgabenbereichen untersuchte und dabei in 13,7 % aller Proben B. cereus nachweisen konnte [6]. Kaffeevollautomaten waren in die damaligen Untersuchungen nicht einbezogen, haben aber auf Grund ihrer verbreiteten Verwendung in Verpflegungseinrichtungen auch im Einsatz ein erhebliches Kontaminations- /Infektionspotenzial.
Bewertung der eigenen Untersuchungsergebnisse
Das gesundheitliche Risiko von durch B. cereus-Toxin ausgelösten Krankheitsgeschehen, die sich im Rahmen der Gemeinschaftsverpflegung rasch zu einem Ausbruchsgeschehen mit zahlreichen Erkrankten entwickeln können, gab Anlass zu der hier vorgestellten Untersuchung.
Die Untersuchungsergebnisse zeigen deutlich, dass sowohl trinkfertige Heißgetränke als auch verschiedene Topping-Formen aus Kaffeevollautomaten sowie die Originalgebinde der Topping-Pulver in Verpflegungs- und Betreuungseinrichtungen mit B. cereus kontaminiert sind. Sie stellen somit ein nicht zu unterschätzendes gesundheitliches Risiko im Rahmen des Verbraucherschutzes dar. Vor diesem Hintergrund sollten auch Kaffeevollautomaten bei der Aufklärung von Ausbruchsgeschehen zwingend in die epidemiologischen Untersuchungen einbezogen werden. Dies bestätigt auch eine Studie von -MACZEWSKI et al. aus dem Jahr 2015, in der an das Trinkwassernetz angeschlossene Kaffeeautomaten mikrobiologisch untersucht wurden. Auch hier konnte neben zahlreichen, zum Teil gesundheitsgefährdenden Gramnegativen Erregern B. cereus nachgewiesen werden [16].
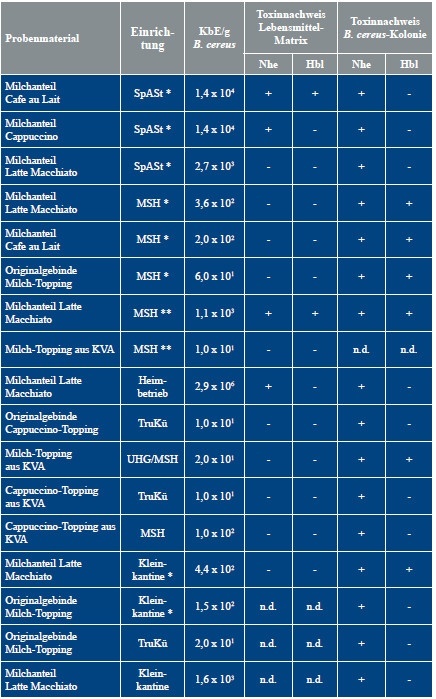
Die Untersuchungen zeigten zudem, dass sowohl die Originalgebinde als auch die Topping-Proben aus den Kaffeevollautomaten B. cereus in einer geringen Größenordnung von 101 bis 102 KbE/g aufwiesen. Nach Angaben der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) Stand Januar 2016 liegt der Warnwert für Instantprodukte bei 103 KbE/g Lebensmittel [4]. Im Milchanteil der unterschiedlichen Heißgetränke variierte die Anzahl der nachgewiesenen Keime jedoch zwischen 102 und 106 KbE/g, lag also zum Teil deutlich über dem von der DGHM vorgegebenen Warnwert von 103 KbE/g. Nach Berichten der EFSA liegt die Größenordnung an vegetativen Zellen bzw. Sporen im Zusammenhang mit durch B. cereus hervorgerufenen lebensmittelbedingten Erkrankungen im Bereich von 105 bis 108 KbE/g Lebensmittel. In manchen Fällen wurde jedoch bereits ein Ausbruchsgeschehen bei einer Keimzahl von 103 bis 104 KbE/g Lebensmittel beobachtet [8]. Die hohen Keimzahlen in den trinkfertigen Kaffeespezialitäten deuten auf eine Kontamination der Maschinenbestandteile hin. Hier liegt die Vermutung nahe, dass beispielsweise die Schlauchsysteme aufgrund der Ausbildung eines Biofilms mit dem Erreger kontaminiert sind.
Weiterhin fällt auf, dass in den Truppenküchen nur drei Proben aus insgesamt zehn untersuchten Kaffeevollautomaten mit B. cereus kontaminiert waren. In keinem der trinkfertigen Heißgetränke konnte der Keim nachgewiesen werden. Lediglich aus zwei Originalgebinden des verwendeten Topping-Pulvers sowie aus einer Probe aus dem Kaffeevollautomaten konnte er in der geringen Konzentration von 101 KbE/g isoliert werden. Dies könnte zum einen darin begründet sein, dass die Truppen-küchen in der Regel eine viel höhere Anzahl täglicher Verpflegungsteilnehmer zu bewältigen haben als die Heimbetriebe. Gerade während der Mittagsverpflegung bedeutet dies eine sehr intensive Nutzung der Kaffeevollautomaten und somit ein regelmäßiges Durchspülen der Maschinenbestandteile, insbesondere der Schläuche, mit heißem Wasser. Zum anderen sind die Betreiber der Kaffeeautomaten angehalten, die durch den Hersteller vorgegeben regelmäßigen Reinigungsintervalle einzuhalten und auch die Reinigung selbst nach dessen Angaben durchzuführen. Die Beprobungsergebnisse könnten darauf hinweisen, dass das Küchenpersonal der Truppenküchen stringenter nach den Herstellerangaben arbeitet.
Generell ist eine Eliminierung von B. cereus aufgrund der hohen Tenazität der Sporen nicht einfach. Im Falle der Kaffeevollautomaten ist die Auswahl an wirksamen Reinigungs- und Desinfektionsmaßnahmen zudem stark eingeschränkt, da diese mit Material und Technik der Automaten kompatibel sein müssen. Die vom Hersteller mitgelieferten Reinigungstabletten sind in jedem Fall zwingend und regelmäßig anzuwenden. Dabei variieren die Zusammensetzungen solcher Reinigungstabletten geringfügig in Abhängigkeit des jeweiligen Herstellers und der Art der Nutzung (Privathaushalt/Gastronomie) der Maschine. Die meisten Reinigungstabletten für die in der Gastronomie genutzten Kaffeevollautomaten enthalten als Hauptbestandteil Aktivsauerstoff in Form von Natriumcarbonat-Peroxohydrat als desinfizierende Komponente sowie Kaliumcarbonat als Reiniger.
Peroxidverbindungen, wie Wasserstoffperoxid und Peressigsäure, stellen im Bereich der Lebensmittelindustrie zwei sehr potente Desinfektionsmittel mit breitem Wirkstoffspektrum insbesondere gegenüber Sporen dar [23, 7]. Die Präparate gelten aufgrund der rückstandslosen Zersetzung als gesundheitlich unbedenklich und gut umweltverträglich. Zwar zeigt Peressigsäure eine eingeschränkte Materialverträglichkeit, diese wird jedoch durch den Zusatz von Korrosionsinhibitoren stark verbessert. Auch den geringen Eiweiß- und Kältefehlern kann durch höhere Konzentrationen und längere Einwirkdauer entgegengewirkt werden. Einzig die schleimhautreizenden Eigenschaften insbesondere von höher konzentrierter Peressigsäure gilt es bei der Verwendung zu beachten. Eine Alkalisierung kann jedoch die reizende Wirkung einschränken. Die wohl bekanntesten handelsüblichen Präparate sind Wofasteril® und PES 15/23.
Optional können die Reinigungsintervalle auch verkürzt werden. Insbesondere für Leitungssysteme eignen sich Präparate mit einem hohen Hypochloridanteil (pH-Wert >8), um die Sporenanzahl deutlich zu reduzieren bzw. diese zu eliminieren. Die thermische Desinfektion kann eine weitere Möglichkeit bei der Behandlung einzelner maschineller Bestandteile sein. Eine thermische Desinfektion von mindestens drei Minuten bei Temperaturen > + 105 °C führt zu einer deutlichen Reduzierung der Keimzahlen um mindestens fünf log-Stufen und kann sogar ein Abtöten aller vorhandenen Sporen bewirken [8].
Die Anwendung verschiedenster Präventionsstrategien im Hinblick auf die Bekämpfung von B. cereus als Ursache für lebensmittelbedingte Erkrankungen ist auch weiterhin unabdingbar. Dies gilt nicht nur für die industrielle Lebensmittelproduktion und die Herstellung von verzehrfertigen Lebensmitteln im Rahmen der Gemeinschaftsverpflegung. Der Reinigung und Desinfektion von maschinellem Equipment und Bedarfsgegenständen, die mit den Lebensmitteln in Kontakt kommen, sollte ebenfalls große Bedeutung beigemessen werden.
Schlussfolgerungen
B. cereus bedingte gastrointestinale Erkrankungen stellen nach wie vor ein nicht zu unterschätzendes Risiko im Rahmen der Gemeinschaftsverpflegung dar. Der meist milde Krankheitsverlauf, das ubiquitäre Vorkommen des Keims in der Umwelt – und somit geringfügig auch in Lebensmitteln -, die hohe Tenazität aufgrund der Sporenbildung und das unterschiedlich ausgeprägte Toxinbildungsvermögen („highproducer“) erschweren seine Bekämpfung nach wie vor. Durch die fehlende Meldepflicht und die demzufolge hohe Dunkelziffer der durch B. cereus bedingten Erkrankungen besteht allerdings die Gefahr, den Keim als Verursacher von „Food borne diseases“ aus dem Fokus zu verlieren.
Die in dieser Arbeit erhobenen Daten sollten Anlass bieten, sich der möglichen gesundheitlichen Risiken durch Hygienemängel – insbesondere im Rahmen der Gemeinschaftsverpflegung – bewusst zu bleiben. Die Nichteinhaltung der vorgegebenen gerätspezifischen Reinigungs- und Desinfektionsintervalle sowie -verfahren bei Kaffeevollautomaten birgt hier ein nicht zu unterschätzendes Risiko. Dieses resultiert einerseits aus dem Einbringen des Milch-Toppings, das per se ein sensibles Lebensmittel in Bezug auf B. cereus darstellt und wie hier aufgezeigt, bereits im Vorfeld kontaminiert sein kann. Andererseits kann es durch verbleibende Pulverreste im Schlauchsystem der Maschine zur weiteren Keimvermehrung bzw. zum Aussporen kommen, was letztlich zu einer gesundheitsgefährdend hohen Keimbelastung des trinkfertigen Heißgetränks führen kann.
Zur Gewährleitung eines effektiven Gesundheitsschutzes der Verpflegungsteilnehmer sollten Kaffeevollautomaten, die in Einrichtungen der Gemeinschaftsverpflegung eingesetzt werden, unbedingt in die routinemäßig durchgeführten Hygienekontrollen miteinbezogen werden. Dabei kann die Beprobung auf die gleiche Weise, wie bereits in dieser Arbeit beschrieben, durchgeführt werden. Zusätzlich ist es ratsam, die Funktionselemente der Maschine (z. B. die Schläuche oder schwierig zu reinigende Bestandteile wie Düsen oder Ventile) in die Beprobung mit einzubeziehen. Dabei sind zwingend bei Auslandseinsätzen die gleichen hygienischen Vorgaben einzuhalten wie im Inland. Daher sollten auch die Vorgaben für Hygienestatuskontrollen in den Einsatzgebieten für die Einsatzlabore Veterinärmedizin (VetMed) entsprechend ergänzt werden. Diese Empfehlung, Kaffeevollautomaten in die Überprüfungen des Hygienestatus einzubeziehen, gilt gleichermaßen auch für den zivilen Verbraucherschutz.
Nicht zuletzt sollte bei der zukünftigen Beschaffung von Kaffeevollautomaten zur Bewertung der herstellerseits vorgeschriebenen Reinigungs- und Desinfektionsverfahren und insbesondere die zugelassenen Desinfektionsmittel lebensmittelhygienische Fachexpertise hinzugezogen werden
Literatur
- Agata N, Ohta M, Mori M, Isobe M: A novel dodecadepsipeptide, cereluide, is an emetic toxin of B. cereus. FEMS Microbiol. Lett. 1995; 129: 17 - 20.
- Bundesinstitut für Risikobewertung (BfR)“ Warmhaltetemperatur von Speisen sollte über 65 °C betragen“, Stellungnahme Nr. 008/2008 des BfR vom 14. Januar 2008.
- Bennet SD, Walsh KA, Gould HL: Foodborne Disease Outbreaks caused by B. cereus, Clostridium perfringens, and Staphylococcus aureus-United States, 1998 - 2008. Clin Infect Dis. 2013; 57(3): 425 - 433.
- Deutsche Gesellschaft für Hygiene und Mikrobiologie (DGHM). Veröffentlichte mikrobiologische Richt-und Warnwerte zur Beurteilung von Lebensmitteln. (Stand 22.01.2016).
- Ehling-Schulz M, Fricker M, Scherer S: Identification of emetic toxin producing B. cereus strains by a novel molecular assay. FEMS Microbiol. Lett. 2004; 232: 189 - 195.
- Ernst C: Optimierung von Desinfektionsverfahren in Verpflegungs- und Betreuungseinrichtungen der Bundeswehr im Hinblick auf die Bacillus cereus-Belastung von Oberflächen und Lebensmitteln: Dissertation in Veterinärmedizin an der Freien Universität Berlin, 2003; http://www.diss.fu-berlin.de/diss/receive/FUDISS_thesis_000000001034
- Ernst C, Schulenburg J, Jakob P et al.: Efficacy of amphoteric surfactant- and peracetic acid-based disinfectants on spores of bacillus cereus in vitro and on food premises of the German armed forces. J Food Prot 2006; 69(7): 1605 - 1610.
- European Food Safety Authority (EFSA): Opinion of the Scientific Panel on biological hazards (BIOHAZ) on B. cereus and other Bacillus spp. in foodstuffs. The EFSA Journal 2005; 175: 1 - 48.
- European Food Safety Authority (EFSA) and European Center of Disease Control (ECDC): The European Union Summary report on trends and sources of zoonoses, zoonozic agents and food-borne outbreaks in 2011. The EFSA Journal 2013;11(4): 3129 [250 pp].
- Fagerlund A, Lindbäck T, Storset AK, Granum PE, Hardy SP: B. cereus Nhe is a pore-forming toxin with structural and functional properties similar to the ClyA (HlyE, SheA) family of haemolysins, able to induce osmotic lysis in epithelia. Microbiology 2008; 154 : 693 - 704.
- Hayrapetyan, H., Muller, L., Tempelaars, M., Abee, T., Groot., N., M., Comparative analysis of biofilm formation by B. cereus reference strains an undomesticated food isolates and the effect of free iron. International Journal of Food Microbiology 200 (2015), 72 - 79
- In`t Veld PH, Ritmeester WS, Delfgou-Van Asch EH, Dufrenne JB, Wernars K, Smit E, Van Leusden FM: Detection of genes encoding for enterotoxins and determination of the production of enterotoxins by HBL blood plates and immunoassays of psychotrophic strains of B. cereus isolated from pasteurized milk. Int J Food Microbiol.2001; 64 (1 - 2): 63 - 70.
- Kleer J, Bartholomä A, Levetzow R et al.: Bakterielle Lebensmittel-Infektionen und Intoxikationen in Einrichtungen zur Gemeinschaftsverpflegung 1985 bis 2000. Arch Lebensmittelhygiene 2001 (52): 76 - 79.
- Kreienbrink G, Pöllein W, Fender T, Emmler J, Schotte U, Binder A: Lebensmittelbedingte Gruppenerkrankug in der Bundeswehr unter besonderer Berücksichtigung von Noroviren. Wehrmedizinische Monatsschrift 2012; 10: 240 - 246.
- Lindbäck T, Fagerlund A, RØdland M S, Granum PE: Characterization of the B. cereus Nhe enterotoxin. Microbiology 2004; 150(12): 3959 - 3967.
- Maczewski S, Graetz A, Winterfeld I, Jakob C, Mattner F: Stellen an das Trinkwassernetz angeschlossene Kaffeeautomaten ein Risiko für Patienten dar? HygMed 2015; 40 (9): 361 - 364
- Messelhäuser U, Ehling-Schulz M: Pathogene Mikroorganismen, B. cereus-Vorkommen, Nachweis und Präventionsstrategien. Hamburg: Behr`s Verlag; 2. Auflage 2014.
- Moravek KM, Dietrich R, Buerk C et al.: Determination of the toxic potential of B. cereus isolates by quantitative enterotoxin analyses. FEMS Microbiol. Lett. 2006; 257: 293 - 298.
- Moravek KM.: Nachweis und Expression und Bedeutung der von B. cereus produzierten Enterotoxin-Komplexe. Dissertation aus dem Institut für Hygiene und Technologie der Lebensmittel tierischen Ursprungs (Lehrstuhl: Prof. Dr. E. Märtlbauer) der Tierärztlichen Fakultät der Universität München, München 2006; https://edoc.uni-muenchen.de/5714/ (accessed: 15.09.2016).
- Reis ALS, Montanhini, MTM., Bittencourt JVM, Destro TM, Bersot LS: Gene detection and toxin production evaluation of hemolysin BL of B. cereus isolated from milk and dairy products marketed in Brazil. Braz. J. Microbiol. 2013) 44(4): 1195 - 1198.
- Stenfors Arnesen LP, Fagerlund A, Granum PE: From soil to gut: B. cereus and its food poisoning toxins. FEMS Microbiol. 2008; 32(4): 579 - 606.
- Sudhaus N, Pina-Pérez MC, Martínez A, Klein G: Inactivation Kinetics of Spores of Bacillus cereus Strains Treated by a Peracetic Acid–Based Disinfectant at Different Concentrations and Temperatures. Foodborne Pathogens and Disease 2012; 9(5): 442 - 452.
- Ueda S, Yamaguchi M, Iwase M, Kuwabara Y: Detection of Emetic B. cereus by Real-Time PCR in Foods, Biocontrol Science, 2013; 18(4): 227 - 232.
- Wijnands LM, Dufrenne JB, Rombouts FM, In`t Veld PH, Van Leusden FM: Prevalence of potentially pathogenic B. cereus in food commodities in the Netherlands. J Food Prot. 2006; 69 (11): 2587 - 2594.
- Zhang Z, Feng L, Xu H, Liu C, Shah NP, Wei H: Detection of viable enterotoxin-producing B. cereus and analysis of toxigenicity from ready-to-eat foods and infant formula milk powder by multiplex PCR. Journal of Dairy Science 2016; 99(2): Article in press; https://www.reserachgate.net/publication/287388321 (Accessed: 15.09.2016)
Bildquellen:
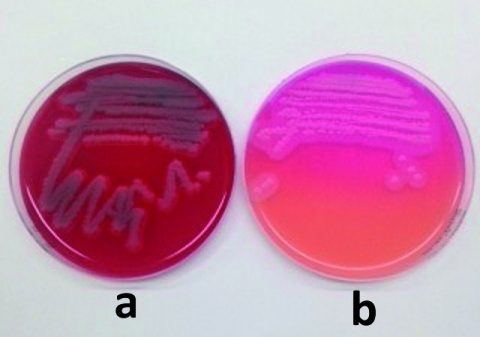
Abbildung 1 und 2: B. Bovermann, Mainz
Zitierweise:
Bovermann B: Vorkommen von Bacillus cereus in Kaffeevollautomaten verschiedener Verpflegungs- und Betreuungseinrichtungen der Bundeswehr. Wehrmedizinische Monatsschrift 2017; 61(2/3): 42 - 49.
Citation:
Bovermann B: Occurence of Bacillus cereus in fully automated coffeemakers in different canteens and dining halls of the Bundeswehr. Wehrmedizinische Monatsschrift 2017; 61(2/3): 42 - 49.
Verfasser:
Oberstabsveterinär Birte Bovermann
Zentrales Institut des Sanitätsdienstes der Bundeswehr Koblenz, Außenstelle Mainz
Laborabteilung II, Veterinärmedizin
Generaloberst Beck Str. 1f, 55129 Mainz
E-Mail: [email protected]
Kernaussagen
- B. cereus sollte aufgrund seines Toxinbildungsvermögens als Verursacher lebensmittelbedingter Infektionen nicht unterschätzt werden.
- Kaffeevollautomaten sowie die eingebrachten Topping-Pulver stellen ein gesundheitliches Risiko der durch B. cereus-bedingten Intoxikationen dar.
- Insbesondere Betreuungseinrichtungen, wie kleinere Heimbetriebe, sollten auf regelmäßige Reinigung und Desinfektion der mit den Topping-Pulvern in Kontakt kommenden Bestandteile des Kaffeevollautomaten achten.
- Das vom Hersteller vorgegebene Reinigungsregime der Kaffeevollautomaten ist unbedingt einzuhalten und sollte je nach Bedarf und Nutzung der Maschine ergänzt werden.
- Kaffeevollautomaten einschließlich der trinkfertigen Heißgetränke und der verwendeten Topping-Pulver sollten unbedingt in die routinemäßig durchgeführten Hygienestatuskontrollen sowie in die Risikoanalyse im Zusammenhang eines lebensmittelbedingten Ausbruchsgeschehens miteinbezogen werden.
Datum: 14.03.2017
Wehrmedizinische Monatsschrift 2017/2-3