TOLLWUT - EINE DIAGNOSTISCHE HERAUSFORDERUNG IM EINSATZ
Die Tollwut gilt als älteste bekannte vom Tier auf den Menschen übertragbare Krankheit. Neben dem klassischen Tollwutvirus (Genotyp 1) werden derzeit sechs weitere Genotypen unterschieden, die überwiegend bei Fledermäusen vorkommen. Empfänglichkeit und
Ausprägung klinischer Symptome sind je nach Tierart und Genotyp sehr unterschiedlich. Einige Fledermausarten und Wildfleischfresser gelten als Reservoir der Erkrankung und können latent infiziert sein. In Mitteleuropa ist die Infektion mittlerweile selten. Nach Tilgung der Tollwut in der Fuchspopulation werden aber in Deutschland zunehmend Virus-positive Fledermäuse gefunden. In der Regel handelt es sich um das EBLV-1 (European bat lyssavirus), selten um EBLV-2.
Die hohe Letalität, verbunden mit dem endemischen Vorkommen in derzeitigen und möglicherweise zukünftigen Einsatzländern, erfordert eine feldtaugliche zuverlässige Diagnostik dieser Viruserkrankung.
Diagnostik der Tollwut
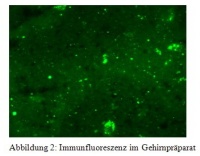
Goldstandard und Arbeitsvorschrift der WHO ist nach wie vor der Nachweis des Virus in der Immunfluoreszenz (Abbildung 2). Abklatschpräparate werden von den betroffenen Gehirnabschnitten hergestellt, mit fluoreszierenden Seren markiert und bei 200- bis 400-facher Vergrößerung im Mikroskop untersucht. Intrazytoplasmatische Einschlüsse sind als kleine staubförmige oder auch als größere runde oder ovale Aggregate sichtbar mit brillant grün strahlender Fluoreszenz. Der Test stellt einige Anforderungen an die Erfahrung des Untersuchers und ist daher regelmäßig durchzuführen. Außerdem sollte die anatomische und zelluläre Integrität des Gehirns weitgehend erhalten sein. Besonders in Einsatzgebieten ist dies nicht immer der Fall, bei höheren Temperaturen kommt es schnell zu autolytischen Prozessen. Der Nachweis von Tollwut-Virus mit der Immunfluoreszenz lässt sich in frischem bis wenige Tage altem Gehirnmaterial gut durchführen und auswerten. In älteren Proben treten störende unspezifische Fluoreszenzen auf, außerdem ist bei fortschreitender Autolyse und zunehmendem Verlust der Organstruktur die Entnahme aus besonders geeigneten Hirnabschnitten nicht mehr möglich, so dass der Test nicht sicher beurteilt werden kann.
Als schnelles, hoch sensitives Verfahren - auch aus stark autolytischen Proben - wurde daher am ZInstSanBw Kiel die Real-time PCR etabliert.
Die kompakte Diagnostik-Einheit besteht aus einer Schüttelmühle zur Aufbereitung der Organe (Fa. Retsch), einem Aufreinigungsautomaten zur Extraktion der RNA (EZ 1, Fa. Qiagen) und dem Smart-Cycler zur Durchführung der Real-time PCR (Fa. Cepheid). Die kompletten Untersuchungen einschließlich der Organaufbereitung und RNA-Extraktion können in 4 Stunden abgeschlossen werden.
Die Leistungsfähigkeit der PCR wurde für folgende Kriterien getestet:
• Nachweis von Tollwutvirus-RNA in Proben von 11 verschiedenen Tierarten (Fleisch-, Pflanzenfresser, Fledermäuse) einschließlich Mensch.
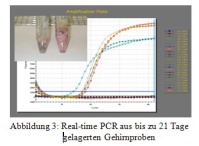
• Nachweis von Virus-RNA aus Gehirnmaterial nach Lagerung bis zu 21 Tage bei 4 ° C bzw. bei Raumtemperatur mit fortschreitender Autolyse des Organmaterials. Dies hat nur geringen Einfluss auf die Empfindlichkeit der PCR-Reaktion (Abbildung 3).
• RNA-Extraktion in der Spanne von 5 mg bis 100 mg (Maximum der Testkit-Kapazität) Organmaterial zeigt eindeutige PCR-Ergebnisse und dokumentiert die Robustheit des Tests.
Durch die Auswertung der Reaktion mit fluoreszierenden Sonden als Real-time Nachweis müssen die Amplifikate nach Ablauf der PCR nicht mehr weiter bearbeitet werden. Das Kontaminationsrisiko durch hoch angereicherte DNA-Produkte wird auf ein Minimum begrenzt. Die kompakte Bauart und die einfache, übersichtliche Bedienung der Geräte ermöglichen es, mit der Ausstattung sowohl im Zentralinstitut als auch im Einsatzlabor optimal zu arbeiten. Das Spektrum der nachweisbaren Mikroorganismen kann mit entsprechenden Primer-Sonden-Systemen einfach und schnell an die Erfordernisse angepasst bzw. erweitert werden.
Die Verfahren zur Diagnostik der Tollwut werden in dem Sonderforschungsvorhaben „Nachweis des Tollwutvirus nach automatisierter RNA-Präparation aus Organen mittels Realtime-RT-PCR unter Einsatzbedingungen (01Z5-S-850708)“ bearbeitet (in Kooperation mit WHO - Nat. Referenzzentrum, Friedrich-Löffler-Institut, Wusterhausen, Dr. T. Müller).
Datum: 18.01.2009
Quelle: Wehrmedizin und Wehrpharmazie 2009/1