Antiinfektiva in der Intensivmedizin
Carsten Veita, Maja Florentine Iversena
Zusammenfassung
Die antiinfektive Therapie ist im intensivmedizinischen Alltag eine der wesentlichen Determinanten eines zeitnahen Behandlungserfolgs. Dabei machen (Multi)--Resistenzen und umfangreiche antiinfektive Vorbehandlungen die Wahl der geeigneten Substanzgruppe zunehmend anspruchsvoll und komplex. Insbesondere vor diesem Hintergrund ist die Eingrenzung und begleitende Detektion des Erregers durch Anamnese, Klinik und mikrobiologische Aufarbeitung elementar. Nicht selten müssen auch Pilzinfektionen in den Therapiebestrebungen berücksichtigt werden.
Neben der Wahl der antiinfektiven Therapeutika sind auch deren Dosierung und Verabreichungsdauer entscheidend und weichen häufig von den in der Literatur empfohlenen Standards ab. Idealerweise erfolgt im Bereich der antiinfektiven Medizin eine enge interdiszi-plinäre Zusammenarbeit zwischen Intensivmedizin, Mikrobiologie und klinischer Pharmakologie.
Schlüsselworte: Resistenzentwicklung, kalkulierte Antibiotikatherapie, Candida, Sepsis, MRE, therapeutisches Drugmonitoring, TDM
Keywords: resistance development, calculated antibiotic therapy, candida, sepsis, MDR, therapeutic drugmonitoring, TDM
Einleitung
Infektionen durch Bakterien und/oder Pilze gehören zu nicht seltenen Komplikationen einer intensivmedizinischen Behandlung bzw. sind selbst der Grund dafür. Die zunehmende Resistenz- und Multirestistenzentwicklung stellen dabei die behandelnden Ärztinnen und Ärzte vorerhebliche Herausforderungen. Die Diagnostik zur Detektion eines potenziellen Fokus in Kombination mit Anamnese und klinischem Zustand bietet einen Anhalt auf zu erwartende Haupterreger und beeinflusst die Wahl der antibiotischen Therapie.
Vorgeschaltet vor eine kalkulierte Antibiotikatherapie sind die Erregerisolierung und die mikrobiologische Aufarbeitung. Pilzinfektionen, insbesondere schwer therapier-bare invasive Formen, nehmen in der Intensivmedizin an -Bedeutung zu. Etwa 20 % der Sepsisfälle auf Intensiv-stationen in Europa begründen sich in Pilzinfektionen [8]. Bis dato ist diesem Bereich der Infektiologie wenig -Augenmerk geschenkt worden; die meisten Erkennt-nisse hierbei wurden bei der Behandlung hämato-onkologischer Patienten gewonnen. Häufigste Erreger von Pilzinfektionen sind Candida- und Aspergillus--Spezies.
Der Artikel gibt einen Überblick über aktuelle Therapieempfehlungen, neue Optionen und Folgerungen für den klinischen Alltag auf Intensivstationen.
Antibiotikatherapie
Erregerisolierung und Therapiebeginn
Vor jeder Initiierung einer antibiotischen Therapie sollte der Versuch einer Erregerisolierung gemacht werden. Hierzu gehören Gewinnung/Untersuchung von
- 3 Paar Blutkulturen (aerob/anaerob) aus 3 Entnahmestellen (wenn möglich durch Punktion zu gewinnen),
- Urinkulturen,
- Kulturen aus Trachealsekret bzw. bronchoalveolärer Lavage (BAL),
- Abstriche aus infizierten Wunden oder Drainagen sowie
- Material aus verdächtigen Infektfoki.
Werden in bestimmten Fällen Patienten bewusst ohne antibiotische Therapie belassen oder fiebern unter laufender Therapie (Cave Drugfever!), sollte die Gewinnung von Material dann weiterhin unabhängig vom Fieberanstieg erfolgen.
Die mikrobiologische Aufarbeitung hat einen hohen Stellenwert.
Sie ermöglicht nach Erregerisolierung eine Anpassung bzw. Begrenzung der antibiotischen Behandlung und damit eine Verminderung des Risikos von Resistenzentstehungen und Nebenwirkungen.
Entscheidend ist aber:
Keine Therapieverzögerung:Die Gewinnung von Material für eine Erregerisolierung darf den Beginn der antibiotischen Therapie nicht verzögern [2].
Grundsatz
Eine möglichst frühzeitige, ausreichend breite und hoch dosierte Antibiose ist für das Überleben des Patienten entscheidend [1].
Eine im Jahre 2006 publizierte Beobachtungsstudie von KUMAR zeigte eine um etwa 7 % erhöhte Mortalität, bedingt durch Verzögerung des Therapiebeginns um 1 h für Patienten im septischen Schock. Allerdings ist als Limitation dieser Studie zu bemerken, dass die Erhebung der Daten unter den Bedingungen des amerikanischen Gesundheitssystems erfolgte; da die Verordnung von Antibiotika nur durch einen Infectious Disease Consultant vorgenommen werden durfte, kam es in der Notaufnahme zu einer systembedingten Verzögerung des Therapiebeginns. Es ist deshalb fraglich, ob die gewonnen Erkenntnisse ohne weiteres auf Europa übertragbar sind [13]. Letztlich haben verschiedene andere Arbeitsgruppen die o.g. Thematik erneut untersucht und bestätigen den weiterhin bestehenden Grundsatz einer frühestmöglichen antiinfektiven Therapie mit einem zu erwartenden stündlichen Anstieg der Letalität in der Sepsis um 0,3 % bzw. 1,8 % im septischen Schock [14, 18].
Die persönliche Meinung der Autoren hierzu ist, dass eine wenn möglich angepasste antiinfektive Therapie nach weiterhin stringenter und zeitnaher Diagnostik, -adaptiert an das klinische Bild, sinnvoller erscheint als eine unkritische und vermeidbar „übertriebene“ Verordnung, die aus Sorge um eine therapeutische Lücke ausschließlich der Maßgabe „hit hard and early“ entspricht. Damit ist gemeint, dass die Diagnostik zur Detektion des potenziellen Fokus in Kombination mit Anamnese und klinischem Zustand des Patienten einen Anhalt auf zu erwartende Haupterreger liefern kann und die Wahl der antibiotischen Therapie beeinflussen sollte. Beispiele -dafür sind Streptococcus pneumoniae bei ambulant erworbener Pneumonie (insbesondere Lobärpneumonie); Staphylococcus aureus, Enterobactericae und Pseudomonas aeruginosa bei nosokomialer Pneumonie sowie Escherichia coli und Anaerobier bei intraabdominellen Infektionen. Häufig ist insbesondere in der Frühphase der Erkrankung die Infektionsquelle allerdings nur unzureichend bekannt und die Zahl der möglichen Erreger groß.
Behandlungsdauer
Für die meisten Erreger ist eine Behandlungsdauer von 5-7 Tagen ausreichend, eine längere Therapiedauer verbessert das Outcome nicht, erhöht aber den Selektionsdruck und die Rate an Nebenwirkungen [8]. Ausnahmen mit längerer Behandlungsdauer bestehen bei bestimmten Erregern (z. B. Legionellen, Tuberkelbakterien, Pseudomonas) sowie Krankheitsbildern (z. B. Meningitis, Endokarditis, Enzephalitis, Osteomyelitis). Auf die Relevanz des Biomarkers Procalcitonin, insbesondere zur Bestimmung des Therapieendes, wird nachfolgend weiter eingegangen.
Behandlungsentscheidungen
Vor jeder Behandlungsentscheidung sind klinische und paraklinische Parameter auf ihre Validität zu überprüfen, eine Antibiotikaanamnese der letzten 3 Monate zu erheben und weitere relevante – im Sinne einer möglichen Veränderung des Keimspektrums – beeinflussende Faktoren zu prüfen (siehe unten). Hierzu gehören
- Alter > 65 Jahre,
- Krankenhausaufenthalt > 5 Tage,
- reduzierter Immunstatus, z. B. durch
- Kortisontherapie,
- Diabetes,
- Tumore,
- andere immundefiziente Erkrankungen,
- strukturelle Lungenerkrankungen,
- Organversagen usw.
Jeder auf der Intensivstation liegende Patient, bei dem der Verdacht auf eine Infektion oder Reinfektion besteht, sollte bezüglich Notwendigkeit liegender invasiver Zugänge, deren Wechsel und der Option einer Sanierung der möglichen Infektionsorte überprüft werden. Beim Umgang mit intensivpflichtigen Patienten gelten die allgemeinen Standards der Hygiene, um eine Infektionswahrscheinlichkeit oder Übertragungsrisiken zu reduzieren.
Antibiotika-Regime
Ein eingesetztes Antibiotikum sollte nach 48 h (maximal 72 h) Wirkung zeigen – wenn nicht, bedarf es einer Regimeänderung. Eine mittelfristige Dosisanpassung an Leber- und/oder Nierenfunktionsstörungen ist obligat. In Hinblick auf die Nierenfunktion mehren sich Erkenntnisse, dass eine zu konsequente Anpassung der Dosis eine Unterdosierung bedingen kann; diese sollte in der Initialphase in der Regel unterbleiben und im Verlauf kritisch evaluiert werden.
In diesem Zusammenhang muss bedacht werden, dass Dosierungsrichtlinien antibiotischer Substanzen anhand pharmakokinetischer Untersuchungen an zumeist gesunden Probanden festgelegt werden. Die Veränderungen der Metabolisierung bei Intensivpatienten, z. B. durch erhöhtes/erniedrigtes Herzzeitvolumen, verändertes Verteilungsvolumen aufgrund „capillary leckage“ oder (häufig) reduziertem Plasmaeiweißgehalt, sollten eher zu einer höheren initialen Dosierung von Antibiotika auf Intensivstationen führen. Intensivpatienten mit schweren Infektionskrankheiten, z. B. schwerer Sepsis und septischem Schock, sind eine intensivmedizinisch-interdisziplinäre Herausforderung.
Insbesondere Beta-Laktamantibiotika weisen eine zeitabhängige Abtötungskinetik auf. Gleichzeitig benötigen Intensivpatienten aus den o.g. Gründen eine Gewährleistung möglichst langanhaltender Wirkstoffkonzentrationen oberhalb der minimalen Hemmstoffkonzentration (MHK) für die jeweiligen Erreger. Ideal wäre daher eine patientenindividuelle kontinuierliche Applikation der Tageskumulativdosis, was allerdings neben einer täglichen Spiegelbestimmung auch eine pharmakologische Dosisberechnung notwendig macht. Wir haben uns daher bis zur im BwKrhs Hamburg geplanten Implementierung einer routinemäßigen Spiegelbestimmung (TDM) für die Etablierung einer prolongierten Gabe entschieden. Diese Vorgehensweise ist bereits gut untersucht ist und lässt höhere Wirkspiegel erwarten [1, 7, 20].
Biomarker zur Therapiesteuerung
Es stellt sich immer wieder die Frage geeigneter Biomarker zur Steuerung der antibiotischen Therapie und Unterscheidung zwischen Sepsis und systemischer Inflammation nicht infektiöser Genese. Procalcitonin (PCT) ist dabei der gegenwärtig am besten untersuchte Marker. Aber auch das PCT unterliegt differenten Einschätzungen der verschiedenen Metanalysen der letzten Zeit [20].
Eine Metanalyse von WACKER et al aus dem Jahre 2013 untersuchte 3487 Publikationen zum PCT, von denen 30 vordefinierten Qualitätskriterien entsprachen. Das führte zur Auswertung der Daten von 3244 Patienten und ergab für das Procalcitonin eine mittlere Sensitivität für die Diagnose Sepsis von 77 % bei einer Spezifität von 79 % [27]. Daher ist PCT zwar besser als andere Marker zur Detektion einer Sepsis geeignet, sollte allerdings niemals allein die Indikation für oder gegen den Einsatz einer Antibiotikatherapie begründen.
Weitaus größere Signifikanz und Vorteilhaftigkeit ergibt sich im Einsatz zur Steuerung der Beendigung der antibiotischen Therapie. Hier konnten verschiedene Arbeitsgruppen eine signifikante Verkürzung der Therapiedauer durch PCT-Steuerung ohne Auswirkung auf Liegedauer und Sterblichkeit nachweisen. Dies ist besonders in Hinsicht auf die zunehmende Resistenzentwicklung des intensivmedizinisch relevanten Keimspektrums von Bedeutung [11]. Letztlich ist der Biomarker Procalcitonin eine relevante Unterstützung in der Therapieentscheidung für oder gegen eine antibiotische Therapie. Allerdings kann dieses explizit nicht allein von einer Wertbestimmung abhängig gemacht werden.
Antibiotikaauswahl
Die am Häufigsten zur Anwendung kommenden pseudomonaswirksamen Antibiotika sind:
- Piperacillin/Tazobactam,
- Meropenem,
- Imipenem,
- Cefepim,
- Ceftazidim sowie
- Ciprofloxacin und Levofloxacin.
Bei intraabdominellem Fokus sollten aufgrund regelhaft bedeutsamer Enterobacteriacea und Anaerobier Cephalosporine (cave: Enterokokkenlücke) mit Metronidazol kombiniert oder Piperacillin/Tazobactam bzw. Carbapeneme verwendet werden. Ceftazidim bedarf in der Regel der Ergänzung durch ein Antibiotikum mit grampositivem Wirkspektrum.
Ambulant erworbene Pneumonien müssen aufgrund der Möglichkeit ursächlich atypischer Erreger, wie Mykoplasmen oder Legionellen, in Kombination mit einem Makrolidantibiotikum behandelt werden. Dabei empfiehlt sich bei wachen Patienten die orale Komedikation mit Azithromycin für 3 Tage.
Bei urogenitalen Infektionen (Ausnahme: spezielle -venerische Infektionen) sind unter Berücksichtigung -antibiotischer Vorbehandlungen zumeist alle Substanzklassen anwendbar. Ciprofloxacin und Levofloxacin sind wegen zunehmender Resistenzlage der Enterobacteriaceae und Pseudomonaden in diesem Zusammenhang allerdings nicht mehr als kalkulierte Monotherapie zu empfehlen.
Aminoglykoside, aufgrund synergistischer Effekte häufiger Kombinationspartner von Betalaktamen (Effizienznachweis dieser Therapie ist umstritten), sollten einmal täglich gegeben (Ausnahme: Sepsis bei Endokarditis) und spiegelkontrolliert werden. Für bestimmte Antibiotika gelten aufgrund der Toxizität (z. B. Aminoglykoside) bzw. Wirksamkeit (z. B. Vancomycin mit einem Talspiegel 15-20 mg/l) Spiegelkontrollen als klinisch etabliert.
Eine 2012 veröffentlichte Studie von TUMBARELLO et al. gibt einen wichtigen Hinweis auf den Einsatz von Antibiotika bei primär resistenten Erregern (in dem Fall Carbapenemresistenz). Ist die mittlere Hemmkonzentration nicht zu hoch, scheint eine Dosisanpassung noch erfolgversprechend zu sein und sollte bei der zunehmenden Zahl von multiresistenten (MDR) Pathogenen im klinischen Alltag Berücksichtigung finden [23].
Gezielte Antibiotikatherapie nach Erregernachweis
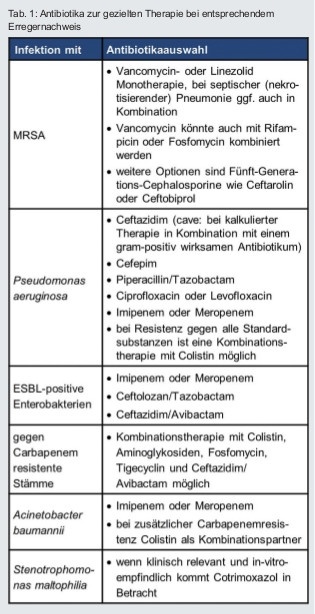
Die gezielte adäquate Therapie bei Nachweis von Infektionen mit MRSA, Pseudomonas, Acinetobacter baumannii, Stenotrophomonas maltophilia, ESBL-bildenden Enterobakterien oder Carbapenem-resistenten Enterobakterien zeigt Tabelle 1.
Inhalative Antibiotikagabe
Zur inhalativen Antibiotikagabe gibt es wenig neue Erkenntnisse und keine klare Empfehlung. Eine Metaanalyse von SOLE et al. mit zumeist retrospektiven Kohortenstudien erbrachte gering verbesserte klinische Heilungsraten und eine geringere Sterblichkeit zugunsten der inhalativen Antibiotikatherapie [21]. Eine randomisiert kontrollierte Studie, die inhalierbares Amikacin und Fosfomycin bei beatmungsassoziierten Pneumonien (VAP) testete, konnten keinen Vorteil gegenüber Placebo zeigen [12].Neue Antibiotika
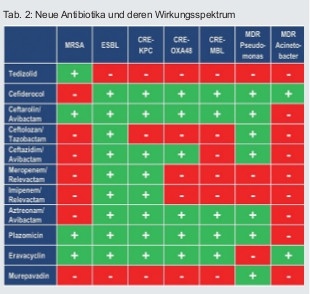
In den letzten Jahren sind einige neue Antibiotika bzw. Kombinationen auf den Markt gekommen (Wirkungsspektrum siehe Tabelle 2).
- Tedizolid ist ein Oxazolidinon; es wirkt aufgrund anderer Bindungseigenschaften auch bei gegen Linezolid resistenten Staphylokokkus aureus und ist deutlich stärker bakterizid.
- Ceftolozan/Tazobactam gehört wie Ceftarolin und Ceftobiprol zu den Cephalosporinen der 5. Generation. Die Substanz ist gegen ESBL-Stämme wirksam, weil in Deutschland Klasse A ESBL dominieren, bei denen die Beta-Laktamase durch durch Tazobactam inhibiert werden kann.
- Ceftazidim/Avibaktam erweitert das Wirkspektrum des schon bekannten Cephalosporins Ceftazidim (3. Generation) durch Kombination mit dem neuen Beta-Laktamasehemmer Avibaktam auf die meisten resistenten Enterobacteriacae (auch ESBL) und einige Metallo--Beta-
-Laktamasen, die häufig zur Carbapenemresistenz führen.
Empirische Initialtherapie
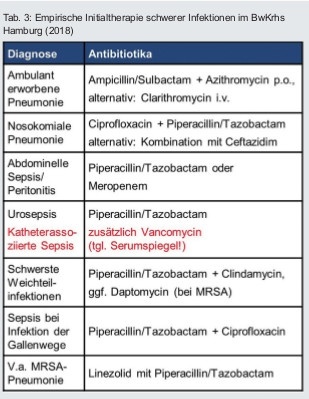
Auf der Intensivstation des BwKrhs Hamburg erfolgt aktuell – nach Sicherstellung von Material für eine Erregerisolierung, wenn immer möglich – die antibiotische Initialtherapie gem. Tabelle 3. Eine regelmäßige Anpassung erfolgt im Rahmen des Antibiotic Stewardship.
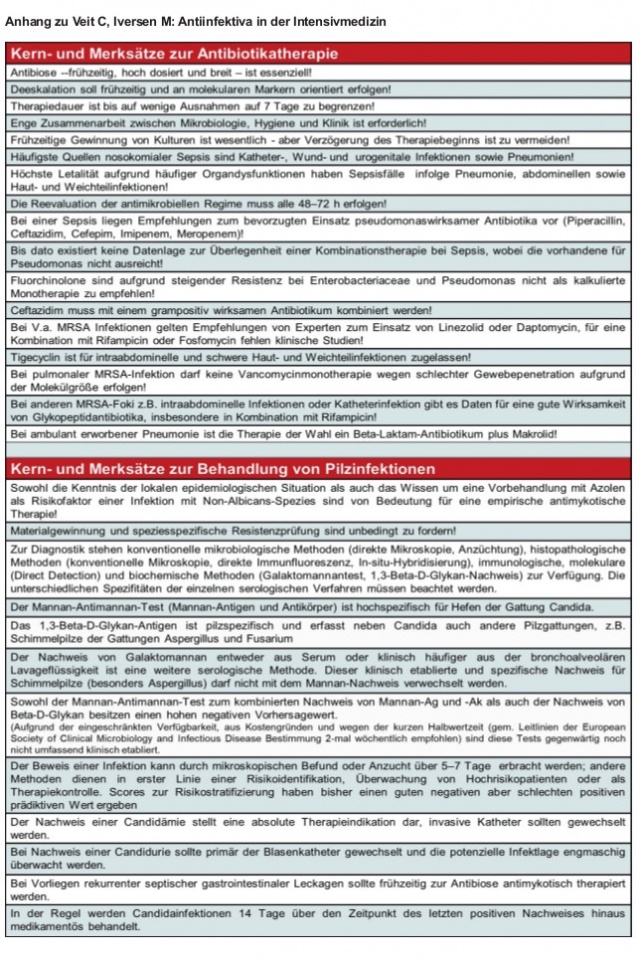
Kernsätze zur Antibiotikatherapie
Zur Übersicht werden die Kernaussagen dieses Beitragsteils zur Antibiotikathetapie im Anhang zusammengefasst.
Antimykotika
Insbesondere schwer therapierbare invasive Verläufe von Pilzinfektionen gewinnen in der Intensivmedizin an Bedeutung. Bei variierenden Studienergebnissen – abhängig von untersuchtem Patientenklientel und Diagnosezeitpunkt (Infektionsnachweis bei Aufnahme vs. Hospitalisation) – liegen diese in Europa zwischen 5 und 20 % der Sepsisfälle auf Intensivstationen [4, 8, 17, 25]. Die meisten Erkenntnisse über diese Infektionen wurden im Rahmen der Behandlung von hämatoonkologischen Patienten gewonnen.
Den größten Teil der Pilzinfektionen verursachen Candida- und Aspergillus-Spezies. Candidainfektionen sind zumeist nosokomial verursacht.
Candida-Infektionen
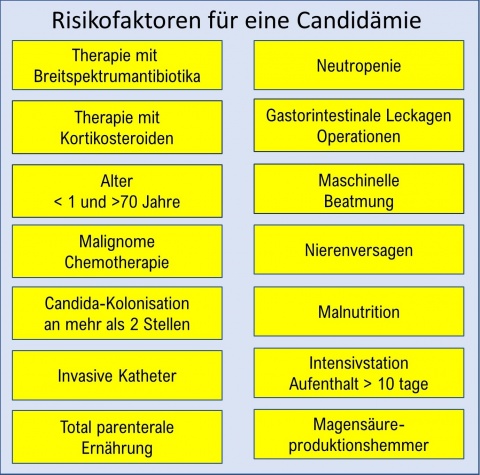
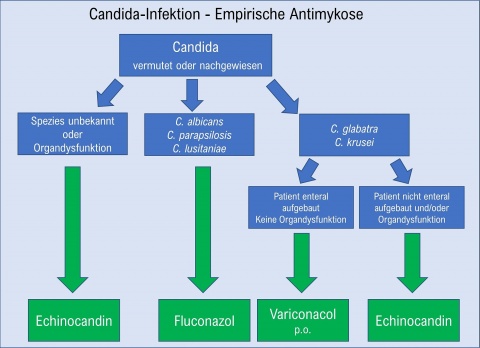
Invasive Candidämien sind, da sie zumeist schwer kranke und damit häufig immungeschwächte Patienten betreffen, mit einer erhöhten direkten Letalität (relatives Risiko 14-fach!) verbunden. Die häufigsten Ursachen sind die Invasion über den physiologisch besiedelten Darm und invasive Katheter. 95 % aller Candidämien werden durch Candida. albicans (häufigste Spezies), C. glabrata, C. parapsilosis und C. tropicalis verursacht. Das Risiko einer Candidämie (Risikofaktoren siehe Abbildung 1) lässt sich durch eine selektive oropharyngeale Dekontamination (SOD) reduzieren.Die höchste Letalität weisen C. glabrata und C. krusei auf, vermutlich weil sie unzuverlässig (glabrata) bzw. nicht (krusei) auf eine Fluconazoltherapie ansprechen. C. parapsilosis zeigt zwar eine niedrige Letalitätsrate auf, neigt aber dazu, Biofilme in und um invasive Zugänge zu bilden und ist damit einer antimykotischen Therapie schwer zugänglich. C. tropicalis und C. krusei sind häufig bei hämatoonkologischen Patienten vorzufinden [25].
Bezüglich der physiologischen Darmbesiedlung mit C. albicans und dem damit verbundenen sekundären Infektionsrisiko gibt es einige Studien, die eine Verminderung der Morbidität (ohne Beeinflussung der Mortalität) durch eine zusätzliche antimykotische Therapie bei Patienten mit rezidivierenden Darmperforationen oder Fisteln zeigen konnten. BASSETTI et al.w beschäftigen sich in einer Multicenterstudie 2015 intensiv mit der Epidemiologie, Outcome und Mortaliätsprediktoren der abdominellen Candidiasis. [3]
Zur Behandlung von Candidainfektionen liegt eine umfangreiche Leitlinie der Infectious Diseases Society of America (IDSA) vor, in der alle klinischen Situationen, Infektionsorte und Candidaspezies mit den entsprechenden Empfehlungen betrachtet werden [15]. Für Candidämien wird eine Primärtherapie mit einem Echinocandin empfohlen [15, 17]. Bei nicht schwer kranken Patienten ohne Risiko für eine Azolresistenz (nicht neutropen, keine Vortherapie) kann Fluconazol als Alternative angewendet werden.
- Eine Candidämie sollte zu einer täglichen Blutkulturabnahme führen, bis negative Befunde vorliegen.
- Die Therapiedauer beträgt 14 Tage nach Negativierung der Blutkultur.
- Innerhalb einer Woche sollte eine ophtalmologische Untersuchung (Cave: Endophthalmitis, Coriretinitis, vereinzelt vitritis) erfolgen, bei neutropenen Patienten erst eine Woche nach Anstieg der neutrophilen Granulozyten [16].
- Eine Candidainfektion ohne positive Blutkultur soll für 2 Wochen nach klinischer Verbesserung behandelt werden.
- Ein Candidanachweis in den Atemwegen ist praktisch immer eine Kolonisation und damit nicht behandlungsbedürftig.
Schimmelpilzinfektionen
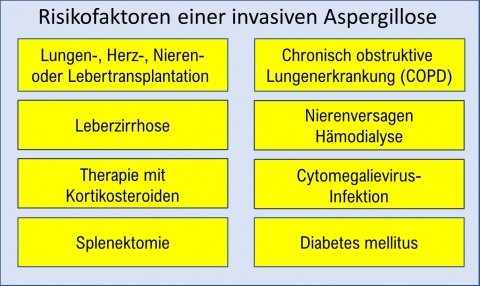
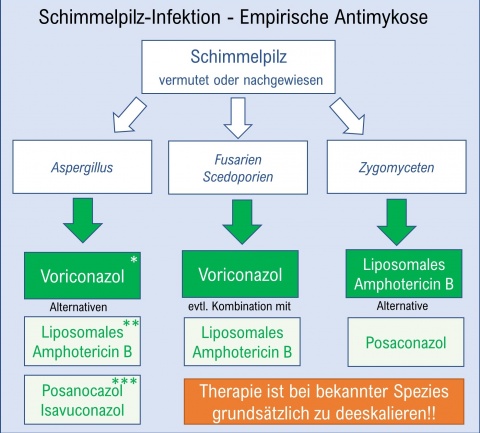
Schimmelpilzinfektionen nehmen in der Intensivmedizin an Häufigkeit zu. Epidemiologisch wenig bedeutsam sind Zygomyzeten und Fusarien, von größerer Relevanz sind Aspergillus-Spezies und darunter A. fumigatus, gefolgt von A. flavus, A. terreus (höchste Sterblichkeitsrate), A. niger und A. nidulans. Retrospektive Analysen konnten zeigen, dass etwa 20 % der wegen einer Influen-za auf Intensivstation aufgenommenen Patienten eine invasive Aspergilleninfektion hatten [9]. Sie verursachen lebensgefährliche Infektionen (Letalität 65-80 %) bei der wachsenden Gruppe immungeschwächter Patienten. Die Dissemination der Pilze tritt nach Einatmung der Sporen oder über kontaminierte kutane Läsionen auf. Die Überlebenschancen von Patienten mit invasiver Aspergilleninfektion sind begrenzt, insbesondere wenn diese beatmungspflichtig werden. Bis dato wurde das vordergründig der zumeist vorliegenden Immunsuppression der Erkrankten und der pathogenen Eigenschaften des Erregers zugeschrieben. Eine 2011 von TROKE et al. publizierte Observationsstudie zur klinischen Effizienz von Voriconazol zur Therapie der Aspergilleninfektion lieferte Hinweise darauf, dass mit höheren Plasmaspiegeln bessere klinische Ergebnisse erzielt werden können [22]. Eine 2012 von HOPE et al veröffentlichte Arbeit zeigte eine breite individuelle Varianz der Serumkonzentration bei Patienten unter Voriconazoltherapie. Beide Punkte legen nahe, dass ein Drug-Monitoring zur Steuerung der Therapie dieses kritischen Krankheitsbildes eine wesentliche Rolle spielt [10]. Neue Grenzwerte für Aspergillus-Antimyogramme wurden 2013 publiziert [9]. Die Risikofaktoren für die Entwicklung einer invasiven Aspergilleninfektion zeigt Abbildung 2.Empirische Antimykose (Leitfäden)
Zwei Leitfäden zur antimykotischen Therapie bei Candida- bzw. Schimmelpilzinfektionen sind in den Abbildungen 3 und 4 dargestellt.
Kernsätze zur Antibiotikatherapie
Fazit
Die Wahl der „richtigen“ kalkulierten antiinfektiven Therapie im intensivmedizinischen Alltag wird die behandelnden Teams insbesondere in Zukunft vor komplexe Entscheidungen stellen: Resistenzlage, Zunahme der Risikopatienten, umfangreiche antiinfektive Vortherapien und prolongierte Krankheitsverläufe werden diese nicht vereinfachen. Dem Antibiotic Stewardship kommt eine entsprechende Bedeutung zu. Neue „Reserveantibiotika“ sind auf dem Weg und werden sich als Rückfallebene im Behandlungsalgorithmus etablieren.
Was bleibt, sind die prinzipiellen Grundsätze der gerichteten antiinfektiven Therapie, die
- frühzeitig und ausreichend hoch dosiert,
- auf das Zielgebiet fokussiert und
- die individuellen Gegebenheiten von Patient und Gesundheitseinrichtung berücksichtigend
erfolgen muss.
Literatur
- Abdul-Aziz MH, Sulaiman H, Mat-Nor MB, et al.: Beta-Lactam Infusion in Severe Sepsis: a prospective. two-centre, open-labelled randomized controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis. Intensive Care Med. 2016; 42(10): 1535-1545.
- Andes DR, Safdar N, Baddley JW, et al.: Impact of treatment strategy on outcomes in patients with candidemia and other forms of invasive candidiasis: a patient-level quantitative review of randomized trials. Clin Infect Dis. 2012; 54(8): 1110-1122.
- Bassetti M et al.: A Multicenter Multinational Study of Abdominal Candidiasis: Epidemiology, Outcomes and predictors of Mortality. Intensive Care med 2015; 41: 1601-1610
- Bassetti M et al.: EUCANDICU Project Incidence and Outcome of invasive Candidiasis in ICU in Europe. Crit Care 2019 14;23(1):219.
- Dalhoff K, Abele-Horn M, Andreas S et al: Epidemiologie, Diagnostik und Therapie erwachsener Patienten mit nosokomialer Pneumonie – S-3 Leitlinie, Update 2017 (FF: Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e. V.). AWMF Online; , letzter Aufruf 12. Juli 2019.
- De Jong E, van Oers JA, Beishuizen A, et al.: Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients. Lancet Infect Dis. 2016; 16(7): 819-827.
- Dulhunty JM, Roberts JA, Davis JS, et al.: A Multicenter Randomized Trial of Continuous versus Intermittent ß-Lactam Infusion in Severe Sepsis. Am J Respir Crit Care Med. 2015 192 (11):1298-1305.
- Engel C, Brunkhorst FM, Bone HG et al.: Epidemiology of Sepsis in Germany: results from a national prospective multicenter Study. Intensive Care Med 2007; 33: 606-618
- Hope WW, Cuenca-Estrella M, Lass-Flörl C, et al.: EUCAST technical note on voriconazole and Aspergillus spp. Clin Microbiol Infect. 2013;19(6): E278-E280.
- Hope WW: Population pharmacokinetics of voriconazole in adults. Antimicrob Agents Chemother. 2012; 56(1): 526-531.
- Iankova I et al.: Efficacy and Safety of Procalcitonin Guidance in Patients with suspected or confirmed Sepsis. Crit Care med 2018; 46(5): 691-698.
- Kollef MH, Ricard JD, Roux D, et al.: A Randomized Trial of the Amikacin Fosfomycin Inhalation System for the Adjunctive Therapy of Gram-negative Ventilator-Associated Pneumonia: IASIS Trial. Chest 2017; 151(6): 1239-1246.
- Kumar A, Roberts D, Wood KE, et al.: Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006; 34: 1589-1596.
- Liu VX, Fielding-Singh V, Greene JD et al. The Timing of Early Antibiotics and Hospital Mortality in Sepsis. Am J Respir Crit Care Med. 2017; 196(7): 856-863.
- Maertens JA, Raad II, Marr KA, et al.: Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi (SECURE): a phase 3, randomised-controlled, non-inferiority trial. Lancet 2016; 387(10020): 760-769.
- Oude Lashof AML, Rothova A, Sobel JD, et al.: Ocular Manifestations of Candidemia. Clin Infect Dis 2011: 53(3): 262-268.
- Pappas PG, Kauffmann CA, Andes DR et al.: Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis 2016; 62(4): e1-e50.
- Rhodes A et.al.: Sepsis Campaign Bundle Update 2018. Intensive Care med. 2017; 43(3): 304-77
- Schauwvlieghe AFAD, Rijnder BJA, Philips N, et al.: Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study. Lancet Respir Med 2018; 6(19): 782-792.
- Schuts EC, Hulscher MEJL, Mouton JW, et al.: Current evidence on hospital antimicrobial stewardship objectives. Lancet Infect Dis. 2016; 16(7): 847-856.
- Solé-Lleonart C, Rouby JJ, Blot S, et al.: Nebulization of Antiinfective Agents in invasively Mechanically Ventilated Adults: A Systemic Review and Meta-analysis. Anaesthesiology. 2017; 126(5): 890-908.
- Troke PF, Hockey HP, Hope WW: Observational Study of the Clinical Efficacy of Voriconazole and Its Relationship to Plasma Concentrations in Patients. Antimicrob Agents Chemother. 2011; 55(10): 4782-4788.
- Tumbarello M, Viale P, Viscoli C, et al.: Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniae carbapenemase–producing K. pneumoniae: Importance of Combination Therapy. Clinical Infectious Diseases 2012; 55(7): 943-950.
- Vincent JL, Bihari DJ, Suter PM, Bruining HA, White J, Nicolas-Chanoin MH, et al.: The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995; 274(8): 639-644.
- Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006 ;34(2): 344-353.
- von Lilienfeld-Toa M, Wagener J, Eisnele H, et al.: Invasive Pilzinfektionen. Dtsch Arztebl Int 2019; 116(16): 271-278.
- Wacker C, Prkno A, Brunkhorst FM, Schlattmann P: Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis. Lancet Infect Dis. 2013;13(5): 426-435.
Zitierweise
Veit C, Iversen M: Antiinfektiva in der Intensivmedizin. WMM 2019; 63(9): 305-312.
Verfasser
Flottillenarzt Dr. Christian Veit
Flottillenarzt Dr. Maja Florentine Iversen
Bundeswehrkrankenhaus Hamburg-
Klinik für Anästhesie, Intensiv – und Notfallmedizin, Schmerztherapie
Lesserstrasse 180, 22049 Hamburg
E-Mail: [email protected]
Datum: 16.10.2019