Sepsistherapie
REFRESHER INTENSIVMEDIZIN
Carsten Veita, Maja Florentine Iversena
Zusammenfassung
Die Sepsis ist ein komplexes Krankheitsbild, definiert als lebensbedrohliche Organdysfunktion durch die fehlregulierte Wirtsantwort auf eine Infektion. Die Mortalität ist mit 10-20 % für die Sepsis und 40-60 % im Falle der Entwicklung eines septischen Schocks sehr hoch.
Nach erneuter Überarbeitung der Sepsisleitlinien 2016 durch die Surviving Sepsis Campain (SSC) wurden in der Folge strukturierte Behandlungsbündel herausgehoben, die – in der ersten Stunde umgesetzt – nachweislich das Outcome dieser schwer kranken Patienten positiv beeinflussen.
Der Artikel beschreibt grundsätzliche und supportive Therapieansätze und beleuchtet die Hintergründe. Im Vordergrund der therapeutischen Bemühungen stehen Kontrolle der Infektion und zügige hämodynamische Stabilisierung der Patienten.
Schlüsselwörter: Sepsis, septischer Schock, SSC, hämodynamische Stabilisierung, Überlebensrate, Infektion, Behandlungsbündel
Keywords: sepsis, septic shock, SSC, hemodynamic stabilization, survival rate, infectious disease, treatment bundle
Einleitung
Dieser Beitrag soll einen Überblick über die gegenwärtige Studienlage und den aktuellen Stand der Therapie des komplexen Krankheitsbildes „Sepsis“ – einem lebensbedrohlichen Krankheitsbild und einer Herausforderung für alle Behandelnden, besonders unter Einsatzbedingungen – geben.Die Diagnose „Sepsis“ wurde erstmalig im Jahre 1992 mit der Sepsis-1-Definiton fixiert [3]; 2003 folgte eine Revision und die Sepsis-2-Definition wurde formuliert. Für beide Definitionen galt:
- Sepsis: Erfüllung von 2 oder mehr SIRS[1]-Kriterien und Vorliegen einer Infektion über die
- schwere Sepsis mit zusätzlichem Organversagen, gefolgt vom
- septischen Schock mit begleitender Hypotension trotz adäquater Volumengabe.
Anhaltend kritisch diskutiert wurde die Tatsache, dass ein Großteil der Patienten auf Normalstationen 2 und mehr SIRS-Kriterien erfüllten, ohne eine Sepsis zu haben. Eine Abschätzung der Prognose gestaltete sich ebenfalls schwierig. 2014 wurde die nunmehr gültige, dritte internationale Konsensus-Definition für Sepsis und septischen Schock (Sepsis-3-Definition) erarbeitet [22]:
Sepsis ...
... ist eine lebensbedrohliche Organdysfunktion durch fehlregulierte Wirtsantwort auf eine Infektion.
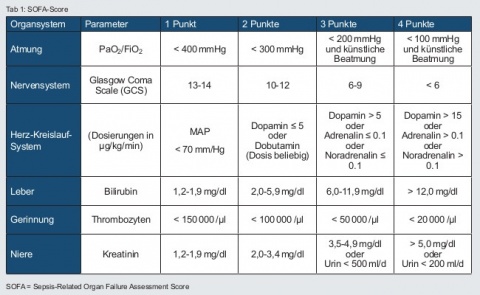
Die Organdysfunktion ist als Erhöhung um ≥ 2 Punkte im SOFA-Score (siehe Tabelle 1) beschrieben. Sofern keine Organdysfunktionen vorbekannt sind, kann von einem SOFA-Score = 0 ausgegangen werden. Bei schweren Verläufen kann es zur Ausbildung eines septischen Schocks kommen.
Septischer Schock ...
... ist ein Zustand, bei dem trotz adäquater Flüssigkeitssubstitution Vasopressoren zum Erhalt eines mittleren arteriellen Blutdrucks (MAP) von ≥ 6 mmHg erforderlich sind und gleichzeitig eine Erhöhung des Serumlaktats von > 2 mmol/l vorliegt.
Grundsätze
Die Behandlung von septischen Patienten stellt eine große Herausforderung an den Intensivmediziner dar. Die hohe Mortalität des septischen Schocks von 50-60 % blieb trotz intensiver Studien und therapeutischer Bemühungen in den letzten Jahren weitestgehend unverändert. Die Komplexität dieses Krankheitsbildes verlangt eine enge Zusammenarbeit der beteiligten Fachbereiche (Intensivmedizin, Mikrobiologie, Chirurgie...). Das hohe Ziel des Intensivmediziners besteht in diesem Fall darin, eine fachliche Expertise zu erlangen, die das pathophysiologische Verständnis, die diagnostischen Möglichkeiten sowie Prophylaxe und Therapie vereint.
Dabei kann die sog. „Early Goal Directed Therapy“- Studie (EGDT) von Rivers, 2001, sozusagen als „Mutter“ aller folgenden Sepsisstudien bezeichnet werden [19]. Diese Studie zeichnetet sich zwar nicht durch ein exzellentes Studiendesign oder „erschlagend“ hohe Fallzahlen aus, konnte aber eindrucksvoll eine signifikante Mortalitätssenkung für die nach dem Protokoll „EGDT“ therapierten Patienten in der Sepsis zeigen. In der Folge wurden nun gleich drei große Studien (PROCESS, ARISE, ProMISe) im New England Journal of Medicine N(EJM) veröffentlicht, die alle zeigen konnten, dass ein protokoll-basiertes Arbeiten (orientiert an Rivers „EGDT“) keinen signifikanten Mortalitätsunterschied ausmacht [17].
Haben wir uns also alle geirrt? Vermutlich nicht, denn erst durch die Rivers-Studie wurde klar, auf was es in der konsequenten Therapie der Sepsis ankommt, welche Zielpunkte in der erfolgreichen Therapie anzustreben sind. Diese Studie hat alle weiteren Entwicklungen in der modernen Intensivmedizin maßgeblich und nachhaltig beeinflusst und relevante Prozeduren in den Stationsalltag implementiert. Der Intensivmediziner „weiß“ mittlerweile genau was er machen muss, ohne dem Protokoll strikt folgen zu müssen. Für den auszubildenden Arzt ist ein protokoll-basiertes Arbeiten sicher, effektiv und auf keinen Fall schlechter.
Aktuelle Sepsis-Definition
quick-SOFA
3 Indikatoren für eine Organdysfunktion:
- Atemfrequenz ≥ 22/min
- Verändertes Bewusstsein, GCS < 15
- Systolischer Blutdruck ≤ 100 mmHg
Der quick-SOFA dient als Screening auf das Vorliegen einer Sepsis abseits der Intensivstation, 2 von 3 Kriterien machen eine Sepsis wahrscheinlich.
Im Mittelpunkt der Diagnose „Sepsis“ steht die lebensbedrohliche Organdysfunktion, objektiviert anhand des SOFA-Scores. Eine Organdysfunktion ist definiert als akute Änderung des SOFA-Scores um ≥ 2 Punkte. Wenn der Ausgangsscore nicht bekannt ist, kann dieser bei Patienten ohne vorbekannte Organdysfunktion mit Null angenommen werden.
Ein septischer Schock liegt vor, wenn folgende Kriterien erfüllt sind:
Kriterien des septischen Schocks:
- Vasopressorgabe erforderlich, um bei persistierender Hypotension einen mittleren arteriellen Druck ≥ 65 mmHg aufrecht zu erhalten,
UND
- Serum-Laktat > 2 mmol/l trotz adäquater Volumensubstitution
Die SIRS-Kriterien werden nicht mehr verwendet. Hintergrund ist eine Arbeit von KAUKONEN et al. aus dem Jahre 2015, die gezeigt hat, dass jeder 8. Patient mit einer Sepsis übersehen wurde, wenn 2 oder mehr SIRS-Kriterien zur Diagnosefindung genutzt wurden [14].
Sepsisursachen und Prävention
Ateminfektionen sind neben intraabdominellen Infektionen die häufigsten Ursachen für eine Sepsis. Etwa 50 % der Sepsiserkrankungen sind in nosokomialen Infektionen begründet. Maßnahmen zur Prophylaxe haben dabei eine fundamentale Bedeutung, Empfehlungen sind mit hohen (hier in Klammern angegeben) Evidenzgraden versehen:
Sepsis-Prophylaxe:
- Infektionsprävention (A)
- Infektions-Surveillance (B)
- Oberkörperhochlagerung 45 Grad bei Beatmung (B)
- frühe enterale Ernährung (A), selektive Darmdekontamination (SDD) oder orale Dekontamination zur Prophylaxe einer beatmungsassoziierten Pneumonie (VAP) bei Beatmung > 48 h (B)).
Diagnostik und Therapie
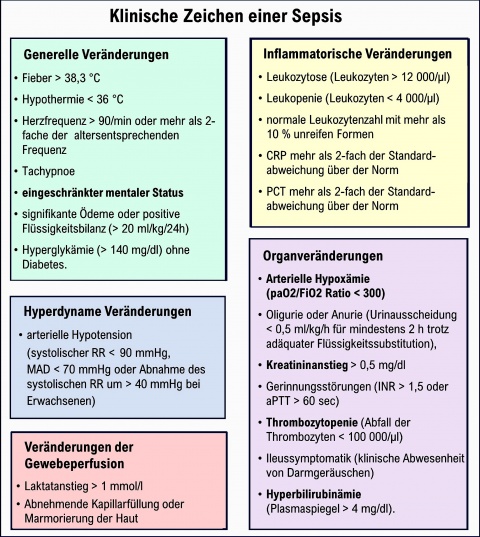
Klinische Zeichen einer Sepsis
Die im Rahmen einer Sepsis festzustellenden generellen, inflammatorischen, hypodynamen und Organveränderungen sowie die Veränderungen in der Gewebeperfusion, die z.T. auch in den SOFA-Score einfließen, sind in Abbildung 1 dargestellt.
„Sepsis-Bündel“
Maßnahmenbündel („Sepsis-Bündel“) waren seit dem ersten Erscheinen der Sepsisleitlinien ein zentrales Element. Studien, wie die von Seymour et al. aus 2017 konnten zeigen, dass eine hohe Adhärenz zu den Bündeln mit einer geringeren Hospitalsterblichkeit verbunden ist [21]. In der neuen Leitlinie hat man den Fokus auf die erste Stunde gelegt. Die folgenden Maßnahmen sollten innerhalb der ersten Stunde umgesetzt werden:
„Sepsis-Bündel“:
- Messung Lactat und Wiederholung, wenn Lactat > 2 mmol/l
- Abnahme von Blutkulturen vor Beginn der Antibiotikatherapie
- Gabe eines Breitbandantibiotikums
- Flüssigkeitsgabe 30 ml/kg KG Kristalloid bei Hypotension oder Laktat > 2 mmol/l
- Vasopressorgabe, wenn trotz Flüssigkeit kein MAD > 65 mmHg zu erzielen ist.
Als hilfreicher diagnostischer Laborparameter einer systemischen Inflammation ist Interleukin-6 (IL-6) verfügbar. Von größerer Bedeutung, weil spezifischer für eine “generalisierte” Infektion, zeigt sich die klinisch etablierte Procalcitonin- (PCT-) Bestimmung. Das Lipopolysaccharid bindende Protein (LBP), das durch Expression von Oberflächenspezifika vor allem gramnegativer Bakterien eine Erkennung von Infektionen möglich machen könnte, hat sich in der klinischen Praxis nicht allgemein durchsetzen können.
„Hit hard and early!“
Ein Grundsatz in der Therapie der Sepsis, die Tarragona- Strategie “Hit hard and early”, wurde durch die im Journal of the American Medical Association (JAMA) publizierte „MaxSep-Studie“ der deutschen SepNet-Studiengruppe genauer beleuchtet [5]. Ein unsachgemäßer Antibiotikagebrauch vermag die Letalität der Sepsis zu erhöhen. Daher sollte ein besonderes Augenmerk auf den potenziellen Fokus, die lokale Erreger- und Resistenzsituation, die Anamnese und die Risikofaktoren des Patienten in Hinblick auf zu erwartende Erreger gelegt und eine sinnvolle kalkulierte Antibiotikatherapie initiiert werden. Gemäß Antibiogramm sollte sobald wie möglich deeskaliert werden. Einzig kausale Therapieansätze sind die Fokussanierung (< 6 h) und die antibiotische Behandlung (< 1 h).
Source-Control
Bezüglich der Source control wird nach einhelliger Expertenmeinung der Eingriff mit geringster physiologischer Belastung bei adäquater Effektivität empfohlen, dazu können auch Entfernung und/oder Wechsel von Fremdmaterial gehören (invasive Zugänge). Eine Materialgewinnung zur mikrobiologischen Aufarbeitung sollte unbedingt angestrebt werden, darf aber den Beginn der antimikrobiellen Therapie nicht unnötig verzögern.
Keimspektrum und Antibiose
Statistisch halten sich unter den Erregern bakterieller Sepsisfälle grampositive und gramnegative die Waage. Die wichtigsten grampositiven Bakterien in unseren Breiten sind bei ambulant erworbener Sepsis Pneumokokken, bei nosokomialer Sepsis Staphylokokken (inkl. MRSA) und Enterokokken.
Unter den gramnegativen Bakterien dominieren ambulant Enterobacteriaceae (Escherichia coli, Klebsiellen) und stationär Pseudomonaden, Acinetobacter und Klebsiellen. Ein Zuwachs multiresistenter Keime wie MRSA, ESBL, Pseudomonaden oder Acinetobacter ist zu erwarten.
Bis dato liegt keine randomisiert kontrollierte Studie (RCT) vor, welche die Überlegenheit einer antibiotischen Kombinationstherapie belegt. Allerdings existieren Tiermodelle sowie klinische Studien, in denen unter Antibiotikakombinationstherapie bei schweren Infektionen (z. B. Endokarditis, gramnegative Bakteriämien oder Patienten mit Neutropenie), ein verbessertes klinisches Outcome gezeigt wurde [9].
Die Gesamtdauer einer antibiotischen Therapie bei Sepsis richtet sich nach der Grunderkrankung, dem Keimspektrum und dem klinischen Verlauf, sollte aber in der Regel 7 Tage nicht überschreiten. Bei klinischer Remission sollte der PCT-Spiegel zur Steuerung der antibiotischen Therapie genutzt werden. In einem systemischen Review und einer Metaanalyse von WACKER et al. wurde 2013 die Bedeutung von PCT als Marker einer Sepsis erneut evaluiert [25]. Die Auswertung von 30 eingeschlossenen Studien ergab, dass PCT hilfreich, aber als alleiniger Marker bei der Diagnose Sepsis nicht ausreichend ist. Die Bestimmung des PCT im Verlauf wurde als sinnvoll und empfehlenswert eingestuft.
Eine 2018 publizierte Metanalyse von IANKOVA et al. untersuchte einen PCT-Algorithmus mit einem Cut-off von 0,5 ng/ml oder einem Abfall von 80 % als Absetzkriterium einer antiinfektiven Therapie [13]. Die PCT-gesteuerte Patientengruppen hatten kürzere antibiotische Therapiedauern ohne negativen Einfluss auf die Sterblichkeit oder die Dauer des Intensivaufenthaltes als die Kontrollgruppen.
Supportive Therapie
Pathophysiologische Veränderungen führen zu einer Verschlechterung der Mikrozirkulation. Deshalb gilt:
Ziel der hämodynamischen Stabilisierung ist die Wiederherstellung und Aufrechterhaltung einer -nutritiven Organversorgung.
Beeindruckend konnte bereits 2001 eine monozentrische Studie von RIVERS et al. den Einfluss einer frühzeitigen Optimierung („Early Goal-Directed Therapy“ – EGT) bestimmter Zielparameter auf die Letalität septischer Patienten nachweisen [19]. Obgleich die Bedeutung des Rivers-Protokolls in den neuen Leitlinien an Stringenz verloren hat, ist die Therapiesteuerung anhand klinischer Parameter uneingeschränkt gültig; zielführend dabei sind:
- MAP > 65 mmHg,
- ScvO2 > 70 %,
- Laktat < 3 mmol/l und
- Diurese > 0,5 ml/kg/h.
Zu diesem Zweck wurden Volumenersatz, Erythrozytenkonzentrate, positiv inotrope Substanzen und Vasopressoren verwendet, auf die im Folgenden eingegangen wird.
Volumenersatz
Zum Thema Volumenersatz liegen aktuell sehr klare und eindeutige Empfehlungen vor. Mit hohem Evidenzgrad (1B) wurde sich für kristalloiden Flüssigkeitsersatz und gegen kolloidale Substitutionslösungen ausgesprochen. Ausschlaggebend waren die drei großen randomisierten Studien VISEP [4], CRYSTAL [18] und CHEST [16]. Unter den kristallinen Lösungen mehrt sich das pathophysiologische Verständnis dahingehend, dass balancierte Lösungen mit insbesondere physiologischem Chloridanteil verwendet werden sollten.
Positiv ionotrope Substanzen und Vasopressoren
Dobutamin kann nach aktuellen Studien die Mikrozirkulation unabhängig von systemischen Effekten verbessern, für einen Einfluss auf die Prognose fehlt die Evidenz.
Noradrenalin ist Vasopressor der Wahl, wenn durch adäquate Volumengabe kein MAP > 65 mmHg erreicht werden kann. Die Gabe von Dopamin im septischen Schock geht mit einer erhöhten Letalität einher [7], die Anwendung sollte daher vermieden werden (Empfehlung Grad 2C, SSC[2]).
Der Ansatz einer Prävention akuter Organdysfunktionen mittels Levosimendan im Rahmen septischer Kardiomyopathien war das Ziel einer großen randomisierten Studie [12]. Der Calcium-Sensitizer ist ein Medikament mit positiv inotroper und vasodilatierender Komponente und wird zur Therapie der dekompensierten Herzinsuffizienz eingesetzt. Levosimendan war als additive Therapie nicht mit einer Mortalitätsreduktion oder Reduktion von Organdysfunktionen verbunden.
Vasopressin gilt als ultima ratio im katecholaminrefraktären Schock. Es gibt aktuelle Veröffentlichungen von septischen Patienten mit moderatem Katecholamin-Bedarf, die möglicherweise eine Reduktion höhergradiger Nierenversagen und damit begründet weniger Nierenersatzverfahren auf Intensivstationen zur Folge haben, wenn frühzeitig (im Stadium Risk) niedrig dosiert Vasopressin im Vergleich zu Noradrenalin zur Stabilisierung angewendet wurde. Des Weiteren scheint bei septischen Patienten der pulmonale Gefäßwiderstand (pulmonary vascular resistance – PVR) unter Vasopressin weniger anzusteigen als unter Noradrenalin. Demgegenüber stehen Daten, die eine deutlich schlechtere Mikrozirkulation unter Vasopressin zeigten. Insgesamt gilt es, weitere Studien abzuwarten und ggf. nur ein ausgewähltes und in bisherige Arbeiten integriertes Patientenkollektiv für eine derartige Therapie auszuwählen. Eine Metaanalyse von MCINTYRE et al. untersuchte 2018 den additiven Effekt von Vasopressin im distributiven Schock. Dabei zeigte sich lediglich ein niedrigeres Risiko für Vorhofflimmern ohne Einfluss auf weitere Endpunkte. Damit gibt es aktuell auch aufgrund der hohen Kosten des Medikamentes keinen überzeugenden Vorteil für den Einsatz von Vasopressin in der Sepsis oder im septischen Schock [15].
Erythrozytentransfusionen
Untersuchungen zu Erythrozytentransfusionen haben gezeigt, dass ein restriktives Regime bis zu einem Hb von 7 g/dl bei unselektierten kritisch Kranken zu keiner Erhöhung der Letalität führt. Die Transfusion von Ery-throzyten beinhaltet vor allem bei älteren Präparaten neben den klassischen Transfusionsrisiken negative Effekte auf die Immunabwehr, das Infektionsrisiko, die Wundheilung und das Tumorwachstum.
Auf der anderen Seite zeigte sich in der EGDT Studie von RIVERS, dass die nach Algorithmus therapierte Patientengruppe (16 %-ige Mortalitätsreduktion) einen signifikant höheren Verbrauch an Erythrozytenkonzentraten hatte. Ebenso hat die SOAP[3] Studie ergeben, dass die Gabe von Erythrozyten bei septischen Patienten kein unabhängiger Risikofaktor ist, sondern die 30-Tage-Überlebensrate im Transfusionsarm höher war [24].
Zusammenfassend wurden die Empfehlungen herausgegeben, bei normaler Gewebeoxygenierung (ScvO2 > 70 %, Lactat < 3 mmol/l) und in Abwesenheit einer KHK oder Blutung einen Hb < 7 g/dl als Trigger zu nehmen.
Toxineliminierung
In Hinblick auf die Eliminierung bakterieller Toxine und inflammatorischer Sepsismediatoren scheinen – unabhängig von Nierenfunktionsstörungen – synthetische High-Flux-Filter eine effektive Entfernung zu ermöglichen. Allerdings liegen derzeit keine Daten aus randomisierten kontrollierten Studien vor, die einen Überlebensvorteil dieser Verfahren in der klinischen Praxis zeigen konnten [20].
Hydrocortison
Zwei große multizentrisch randomisierte Studien erbrachten scheinbar widersprechende Ergebnisse bezüglich der Therapie mit Hydrocortison. Während die APROCCHSS-Studie [1] einen signifikanten Vorteil für Hydrocortison in Bezug auf die 90-Tage-Sterblichkeit zeigte, war dies bei der ADRENAL-Studie nicht der Fall [23]. Die Patienten in der APROCCHSS-Studie waren allerdings insgesamt schwerer erkrankt. Damit bleibt die Empfehlung bestehen, Hydrocortison in einer Dosierung 200 mg/die nur im therapierefraktären septischen Schock einzusetzen. Der Streit um einen sinnvollen Einsatz von Hydrocortison geht weiter. Auf Risiken wie Hypernatriämien, Hyperglykämien und erhöhte Raten sekundärer Infektionen ist dabei zu achten.
Selen
Zur Gabe des Antioxidans Selen kann keine allgemeine Empfehlung gegeben werden. Die prospektiv randomisierte Studie SISPCT der deutschen SepNet-Studiengruppe, die unter anderem die Wirksamkeit von Selen bei schwerer Sepsis und septischem Schock untersuchte, konnte keinen Vorteil zugunsten einer Gabe von Selen zeigen [2]. Die SSC spricht eine Empfehlung Grad 2C gegen die Anwendung von Selen in der Sepsis aus.
Intensivierte Insulintherapie
Eine allgemeine Übertragung der intensivierten Insulintherapie auf Intensivpatienten sollte nach den Daten der durchgeführten Folgestudien, z. B. VISEP, NICE SUGAR TRIAL, aufgrund erhöhter Komplikationsraten unterbleiben [4, 11]. Durch die SSC wird ein protokollgestütztes Blutglukosemanagement mit einem Empfehlungsgrad 1A empfohlen. Zielwerte wurden mit 180 mg/dl als obere und 110 mg/dl als untere Grenze definiert.
Immunglobuline
Es gibt IgM-angereicherte i. v. zu verabreichende Immunglobulinpräparate, die insbesondere bei Neonaten und erwachsenen chirurgischen Patienten mit gramnegativem septischem Schock einen Überlebensvorteil erbrachten, wenn die Therapie frühzeitig begonnen wurde. Kosten der Präparate und differente Studienlage verhindern gegenwärtig eine breite Anwendung. Die 2018 publizierte CIGMA-Studie untersuchte 160 hospitalisierte Patienten mit schwerer Community Aquired Pneumonie (CAP). Es zeigten sich keine signifikanten Unterschiede in der 28-Tage-Sterblichkeit oder in Hinblick auf ventilator-freie Tage, allerdings erbrachte die Post-Hoc-Analyse eine verminderte Sterblichkeit in der Patientengruppe mit hohen CRP- und niedrigen IgM-Werten [26].
Albumin
Wie bereits zuvor erwähnt, stellt die Anwendung von Kolloiden/HAES zur Kreislaufstabilisierung in der Sepsis keine therapeutische Option dar. Deshalb wurden verschiedene Studien zur Verwendung von Albumin aufgelegt. Die SAFE-Studie konnte zeigen, dass Albumin sicher und gleich effektiv ist wie eine konventionelle Flüssigkeitstherapie [10]. Eine Metanalyse aus 17 randomisierten Studien zeigte einen statistischen Überlebensvorteil zu Gunsten der mit Albumin behandelten Patienten [8]. Eine der letzten randomisierten Studien zu diesem Thema konnte keine Mortalitätsreduktion nachweisen [6]. Es scheint aber der Einsatz von Albumin (Hochdosis, 20 %) zusammen mit Kristalloiden in der Volumentherapie und Kreislaufstabilisierung umso effektiver zu sein, je schwerer der septische Schock ist. Eine routinemäßige Substitution (Albumin 5 %) ist sicherlich nicht sinnvoll, kann aber im Falle einer Synthesestörung angezeigt sein und ist zumindest als nicht schädlich bewertet.
Weitere Ansätze
Es gab und gibt noch zahlreiche andere Ansätze, die supportive Sepsistherapie zu verbessern (z. B. AT III, rTFPI, Pentoxyfyllin, LPBG, Zytochrom C, NAD+ oder HMBG 1 Antagonisten, usw.), die positive Trends oder experimentelle Effekte aufzeigten, allerdings nicht den Kriterien randomisiert kontrollierter Studien entsprechend bestätigt werden konnten und damit keine allgemeine Empfehlung erhielten.
Schlussbemerkungen
Die internationale Kooperation, wie sie in erster Linie durch die SSC vorangetrieben wurde, hat maßgeblich dazu beigetragen, aus einem besseren Verständnis der Pathophysiologie der Sepsis und des septischen Schocks und auf der Basis immer besser werdender Studienlagen die Therapie dieses schweren und lebensbedrohlichen Krankheitsbildes weiterzuentwickeln und die Überlebenschance der Patientinnen und Patienten zu erhöhen. Vor allem vor dem Hintergrund der Resistenzentwicklung und der Zunahme des Risikos nosokomialer Infektionen wird es auf eine enge multidisiziplinäre Zusammenarbeit ankommen, um Diagnostik und Therapie, aber insbesondere die Infektionsprävention voranzutreiben. Dieses gilt für den Klinikbetrieb in gleicher Weise wie für die ambulante Gesundheitsversorgungen und die Behandlung von Verletzten, Verwundeten und Kranken im Einsatz.
Literatur
- Annane D et al. Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. N Engl J Med. 2018; 378: 809-818
- Bloos F et al.: Effect of Sodium Selenite Administration and Procalcitonin-Guided Therapy on Mortality in Patients With Severe Sepsis or Septic Shock: A Randomized Clinical Trial. JAMA Intern Med. 2016; 176: 1266-1276.
- Bone RC et al.: Definitions for sepsis and organ failure and guidelines for the use ofinnovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101: 1644-1655.
- Brunkhorst FM et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 2008; 358: 125-139.
- Brunkhorst FM et al.: Effect of empirical treatment with Moxifloxacin and Meropenem vs Meropenem on sepsis-related organ dysfunction in patients with severe sepsis: JAMA 2012; 307(22): 2390-2399.
- Caironi P et al.: Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med. 2014; 370: 1412-1421
- De Backer D et al.: Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis. Crit Care Med. 2012 Mar; 40: 725-30
- Delaney AP et al.: The role of albumin as a resuscitation fluid for patients with sepsis. Crit Care Med. 2011; 39(2): 386-391.
- Dellanoy PY et al.: Impact of combination therapy with aminoglycosides on the outcome of ICU-acquired bacteraemias. Eur J Clin Microbiol Infect Dis 2012; 31(9): 2293-2299.
- Finfer S et al.: A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med. 2004; 350: 2247-2256.
- Finfer S et al.: Intensive versus conventional glucose control in critically Ill patients. N Engl J Med 2009; 360(13): 1283-1297.
- Gordon AC et al.: Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N Engl. J Med. 2016; 375:1 638-1648.
- Iankova I et al.: Efficacy and Safety of Procalcitonin Guidance in Patients With Suspected or Confirm Sepsis. Critical Care Medicine 2018; 46: 691-698
- Kaukonen KM et al.: Systemic inflammatory response syndrome criteria in defining severe sepsis. N Engl J Med. 2015 ed. 2015; 372: 1629-1638.
- McIntyre WF et al. Association of Vasopressin Plus Catecholamine Vasopressors vs. Catecholamines Alone With Atrial Fibrillation in Patients With Distributive Shock. JAMA 2018; 319: 1889-1900.
- Myburgh C et al.: Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012 Nov 15; 367: 1901-1911.
- Nguyen HB et al.: Early goal-directed therapy in severe sepsis and septic shock: insights and comparisons to ProCESS, ProMISe and ARISE. Crit Care. 2016; 20: 160.
- Perner A et al.: Hydroxyethyl Starch 130/0.42 versus Ringer’s Acetate in severe sepsis. N Engl J Med 2012; 367: 124-134.
- Rivers E et al. Early goal-directet therapy in the treatment of severe sepsis and septiv shock. N Engl J Med. 2001; 345: 1368-1377.
- Schädler D et al.: The effect of a novel extracorporeal cytokine hemoadsorption device on IL-6 elimination in septic patients: A randomized controlled trial. PloS ONE. 2017; 12(10): e0187015.
- Seymour CW et al.: Time to Treatment an Mortality during Mandated Emergency Care of Sepsis. N Engl J Med. 2017; 376: 2235-2244.
- Singer M et al.: The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315: 801-810.
- Venkatesh Bet al.: Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med. 2018; 378: 797-808.
- Vincet JL et al.: Are blood transfusions associated with greater mortality rates? Results of the Sepsis Occurrence in Acutely Ill Patients study. Anesthesiology 2008, 108(1): 1-39.
- Wacker C et al.: Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis. Lancet Infect Dis 2013; 13(5): 426-435.
- Welte T et al.: Efficacy and safety of trimodulin, a novel polyclonal antibody preparation, in patients with severe community-acquired pneumonia: a randomized, placebo-controlled, double-blind, multicenter, phase II trial. Intensive Care Med. 2018; 44(4): 438-444.
Zitierweise:
Veit C, Iversen MF: RERESHER INTENSIVMEDIZIN – Sepsistherapie. WMM 2019; 63(9); 298-304.
Für die Verfasser
Flottillenarzt Dr. Carsten Veit
Flottillenarzt Dr. Maja Florentine Iversen
Bundeswehrkrankenhaus Hamburg – -Klinik für Anästhesie, Intensiv- und Notfallmedizin, Schmerztherapie
Lesserstrasse 180, 22049 Hamburg
E-mail: [email protected]
[1] SIRS = Systemic Inflammatory Response Syndrome)
[2] SSC (Surviving Sepsis Campaign) ist eine im Jahre 2002 gegründete Arbeitsgemeinschaft der Society of Cirtical Care Medicine (SCCM, USA) und der European Society of Interive Care Medicine (ESICM). Die SSC erarbeitet unter anderem Guidelines für Diagnostik und Therapie in der Intensivmedizin. (www.survivingsepsis.org)
[3] SOAP = Sepsis Occurrence in Acutely Ill Patients
Datum: 15.10.2019